·论 著·
周 毅,朱一飞*,李世平,王 颖,檀红玲,檀国军
(河北医科大学第二医院神经内科,河北 石家庄 050000)
[摘要] 目的探讨α硫辛酸对实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠轴索损伤的影响。方法选取36只Wistar大鼠,采用豚鼠全脊髓匀浆(guinea pig spinal cord homogenate,GPSCH)诱导免疫以建立EAE大鼠模型。EAE大鼠于第1次发病之日起分别给予生理盐水(EAE组)、100 mg·kg-1·d-1α硫辛酸(LA组)、2 mg·kg-1·d-1地塞米松(DXM组)进行腹腔注射,连续注射7 d。统计各组大鼠复发率;采用Kono评分评估各组大鼠神经功能变化;采用组织病理学观察大鼠轴索损伤变化。结果EAE组、LA组和DXM组复发率分别为58.3%(7/12)、8.3%(1/12)、0;LA组和DXM组复发率均明显小于EAE组,组间比较差异有统计学意义(P<0.05);LA组与DXM组比较差异无统计学意义(P>0.05)。发病后7 d、14 d,LA组和DXM组神经功能评分均明显低于EAE组,组间比较差异有统计学意义(P<0.05);LA组与DXM组比较差异无统计学意义(P>0.05)。组织病理学结果显示,正常对照组轴索粗细均匀、走行方向一致、轴索的连续性完好;EAE组出现不同程度轴索改变,可见轴突肿胀、增粗、弯曲,着色不均,呈锯齿状或串珠状,不连续,甚至断裂,髓鞘结构层次紊乱;LA组轴索改变较EAE组明显减轻,但仍有少部分轴索肿胀、粗细不均、排列紊乱;DXM组轴索改变情况与LA组类似。结论α硫辛酸对EAE大鼠轴索损伤具有一定保护作用。
[关键词] 多发性硬化;脑脊髓炎,自身免疫性,实验性;大鼠 doi:10.3969/j.issn.1007-3205.2015.08.003
[收稿日期]2015-03-18;[修回日期]2015-04-15
[作者简介]周毅(1978-),男,河北唐山人,河北医科大学第二医院主治医师,医学硕士,从事脑血管疾病诊治研究。
通讯作者*。E-mail:doctormartin1973@icloud.com
[中图分类号] R735.7 [文献标志码] A
Effect of α-thioctic acid on axonal injury in rats with experimental autoimmune encephalomyelitis
ZHOU Yi,ZHU Yi-fei*,LI Shi-ping,WANG Ying,TAN Hong-ling,TAN Guo-jun
(Department of Neurology,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
Abstract[] Objective To evaluate the effect of α-thioctic acid on axonal injury in rats with experimental autoimmune encephalomyelitis(EAE).Methods The study selected 36 Wistar rats,and guinea pig spinal cord homogenate(GPSCH) was used to establish EAE model rats.From this first seizure,the EAE model rats respectively were given to normal saline(EAE group),α-thioctic acid 100 mg·kg-1·d-1(LA group) and dexamethasone 2 mg·kg-1·d-1(DXM group),continuously intraperitoneal injected for 7 d.The recurrence rate of different groups were recorded.Kono score was used to assess neurological function.The immunohistochemistry was adopted to observe the axonal injury.Results The recurrence rate of EAE group,LA group and DXM group were 58.3%(7/12),8.3%(1/12) and 0.The recurrence rate of LA group and DXM group were significantly less than that of EAE group(P<0.05).After seizure 7 d and 14 d,the neurological function score of LA group and DXM group were significantly less than that of EAE group(P<0.05).The normal control group showed axon even thickness direction in the same direction,the continuity of axon intact.EAE group manifested different degrees of axon change,visible axon swelling,enlargement,bending,uneven color,a serrated or beaded,discontinuous,even rupture,myelin sheath structure level disorder.Compared with EAE group,the axonal injury of LA group significantly reduced,but there were still a few axon swelling,uneven thickness,disordered arrangement.The axonal injury of DXM group was similar to LA group.Conclusion α-thioctic acid has certain protective effect on axonal injury of EAE rats.
[Key words] multiple sclerosis;encephalomyelitis,autoimmune,experimental;rats
多发性硬化(multiple sclerosis,MS)是以中枢神经系统脱髓鞘为主要病理变化的疾病[1]。既往研究认为,中枢神经系统原发性脱髓鞘病变是导致MS患者出现神经功能障碍的主要因素[2]。近年来研究证实,除炎性脱髓鞘病变外,MS发病过程中往往还合并轴索损伤,且轴索损伤程度与MS病情严重程度密切相关[3]。因此,研究MS轴索损伤机制及其相关轴索损伤保护作用正成为近年的研究热点。α硫辛酸作为强抗氧化剂,可有效抑制机体内脂质过氧化反应,清除活性氧自由基,其对糖尿病周围神经病变患者周围神经的保护功能已得到公认[4-5]。但α硫辛酸对MS轴索损伤的保护作用尚未明确。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型可有效演绎MS的发病过程,是临床研究MS最常用的动物模型。本研究以EAE模型大鼠作为研究对象,分别采用α硫辛酸和地塞米松进行药物干预,观察药物干预对EAE大鼠发病情况和轴索组织病理改变的影响,探讨α硫辛酸对MS轴索损伤的保护作用,旨在为临床MS治疗提供新思路。
1.1 试验动物 豚鼠10只,雄性,体质量350~400 g。Wistar大鼠36只,雌性,体质量180~200 g,6~8周龄。以上动物均购于河北医科大学第二医院实验动物中心。
1.2 试验试剂及设备 α硫辛酸、地塞米松、完全弗氏佐剂(美国Sigma公司);高速低温离心机(日本三洋SCR20B型)。
1.3 动物模型建立 取上述豚鼠10只,采用10%水合氯醛(0.5 mL/100 g)进行静脉麻醉,断颈处死,于低温环境下取出豚鼠脊髓并去除脊髓膜和马尾,称质量并加入等质量的4 ℃生理盐水,采用匀浆机制备全脊髓匀浆(guinea pig spinal cord homogenate,GPSCH),之后加入等体积完全弗氏佐剂,二者充分混合后制成油包水型抗原乳剂,4 ℃保存备用。剩余36只Wistar大鼠,取四肢足垫及背部皮下5点为注射部位,分别给大鼠注射上述油包水型抗原乳剂(0.5 mL/只),并以此建立EAE动物模型。
1.4 动物干预及分组 待EAE大鼠第1次发病后将EAE大鼠随机分为3组,即EAE组、LA组和DXM组,每组12只。各组自第1天发病起分别给予不同药物进行腹腔注射,LA组给予α硫辛酸(100 mg·kg-1·d-1),DXM组给予地塞米松(2 mg·kg-1·d-1),EAE组给予等体积生理盐水,连续注射7 d。
1.5 神经功能检测[6] 神经功能评价参照Kono[7]评分标准:仅尾部无力,其余部位正常记1分;尾部、双前肢和(或)双后肢无力记为2分;尾部无力,双前肢或双后肢瘫痪,但被动翻身后仍可复原记为3分;尾部无力,双前肢及双后肢瘫痪,被动翻身后无法复原记为4分;濒死状态或死亡记为5分。
1.6 组织病理学 受试大鼠处死,快速取脊髓腰膨大组织并固定于40 g/L多聚甲醛中。PBS缓冲液冲洗标本,常规梯度乙醇溶液进行标本脱水,二甲苯透明,浸蜡,石蜡包埋。采用改良三色染色法进行组织切片染色。
1.7 统计学方法 应用SPSS 18.0统计软件进行数据分析。计量资料以![]() ±s表示,组间比较采用单因素方差分析,组内两两比较采用q检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用单因素方差分析,组内两两比较采用q检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2.1 实验大鼠第1次发病情况 GPSCH诱导免疫后,大鼠陆续出现精神不振、食欲下降、皮毛杂乱等症状;第12天大鼠第1次发病,主要表现为尾部无力、双前肢和(或)双后肢肌张力下降甚至瘫痪、斜颈、无法抬头等;第14天大鼠进入发病高峰期,临床症状加重,主要表现为四肢麻痹无力(双后肢更甚),多合并大小便失禁和精神症状(易激惹、攻击行为)。
2.2 复发率 LA组和DXM 组复发率均明显小于EAE组,组间比较差异有统计学意义(P<0.05);LA 组与DXM 组比较差异无统计学意义(P>0.05)。见表1。
2.3 神经功能缺损评分 发病后7 d、14 d,LA 组和DXM 组神经功能缺损评分均明显低于EAE组,差异有统计学意义(P<0.05);DXM组神经功能缺损评分低于LA组,差异有统计学意义(P<0.05)。见表2。
表1 3组大鼠复发率比较
Table 1 Recurrence rate in different groups (n=12,只数,%)
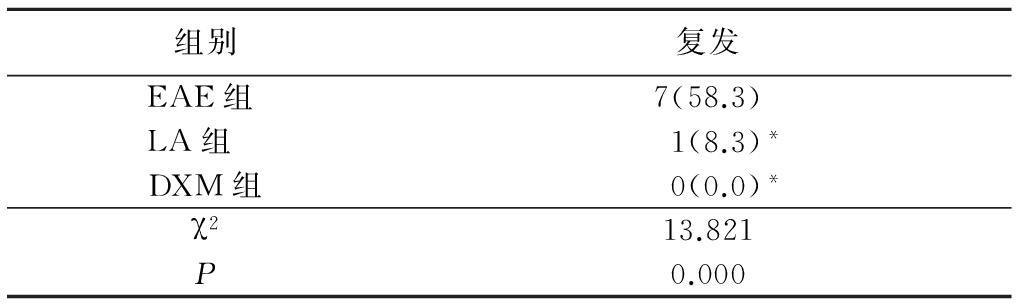
*P<0.05与EAE组比较(Scheffe检验)
2.4 组织病理学 改良Bielschowsky银染色结果显示,正常对照组轴索粗细均匀、走行方向一致、轴索的连续性完好;EAE组出现不同程度轴索改变,可见轴突肿胀、增粗、弯曲,着色不均,呈锯齿状或串珠状,不连续,甚至断裂,髓鞘结构层次紊乱(图1A);LA组轴索改变较EAE组明显减轻,但仍有少部分轴索肿胀、粗细不均、排列紊乱(图1B);DXM组轴索改变情况与LA组类似(图1C)。
表2 3组大鼠神经功能缺损评分比较
Table 2 Neurologic function score in different groups ![]() ,分)
,分)
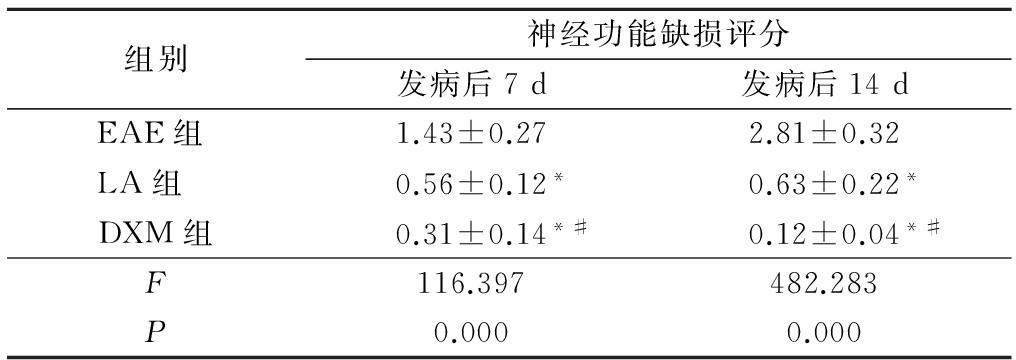
*P<0.05与EAE组比较 #P<0.05与LA组比较(q检验)
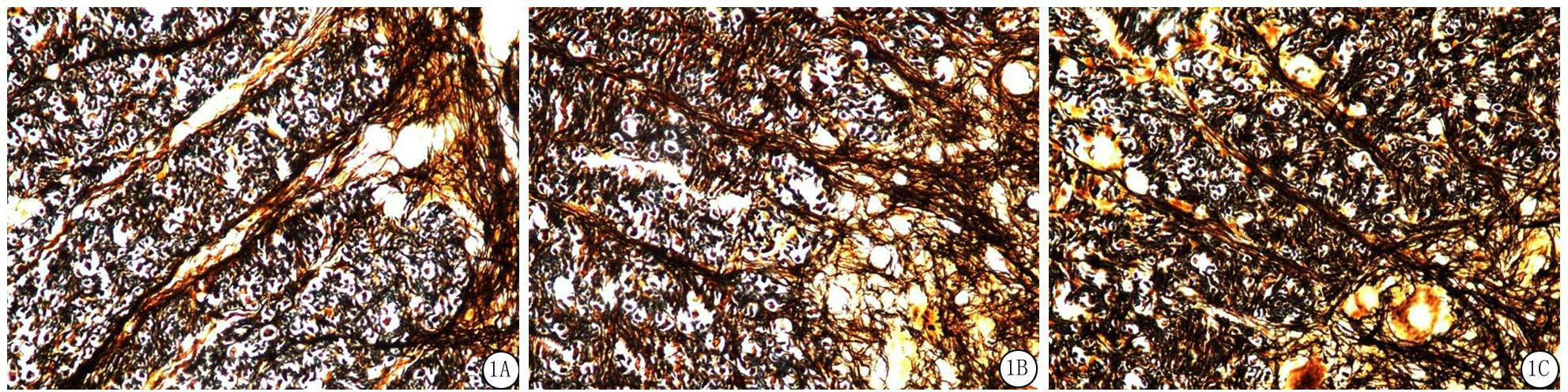
图1 各组大鼠脊髓轴索组织病理切片(改良Bielschowsky银染色×400)
A.EAE组;B.LA组;C.DXM组
Figure 1 Expression of spinal cord axon in different groups(improving Bielschowsky staining ×400)
越来越多的证据支持轴索损伤在MS的发生与发展过程中发挥重要作用[6,8]。氢质子磁共振波谱检查显示,即使在损伤不明显的MS患者脑区也出现N-乙酰天门冬氨(N-acetyl aspartate,NAA)/肌酸(creatine,Cr)比值下降现象,而NAA/Cr比值变化与轴索损伤程度密切相关,提示MS早期即存在轴索损伤现象[9]。
本研究成功建立EAE大鼠模型,观察结果显示,模型大鼠至免疫诱导后第14天(发病期),陆续出现四肢麻痹无力、大小便失禁和精神表现异常等症状;首次发病之后第7天(缓解期)病情相继缓解;首次发病后第14天大部分(复发期)大鼠再次出现肢体瘫痪症状,且此期症状表现比首次发病时更为严重,主要表现为极度消瘦(体质量下降20%~30%)、背部溃疡、口鼻出血等。改良的三色染色法结果显示EAE模型大鼠存在明显轴索损伤现象,且病程各期表现不一,发病期轴索损伤明显,缓解期轴索损伤有所减轻,复发期轴索损伤加重,更甚于首次发病期。本研究结果提示,EAE模型大鼠轴索损伤趋势与其临床病程进展一致,进一步佐证了轴索损伤与MS密切相关。探讨MS轴索损伤保护机制可能是临床治疗MS的新思路。
近年来研究证实,自由基是诱发MS的重要因素[10-11]。由单核细胞产生的氧自由基可介导一系列氧化应激反应,从而导致脱髓鞘和轴突损伤;此外,自由基还可通过激活核转录因子κB,上调肿瘤坏死因子、血管内皮细胞黏附分子1和细胞间黏附分子1的表达,从而促进MS发生和发展。因此,调节机体氧自由基水平可能是治疗MS的可靠途径[12-13]。
α硫辛酸是线粒体脱氢酶的天然辅助因子,可有效清除活性氧自由基,阻断脂质过氧化,从而减少机体氧化应激损伤。其对糖尿病周围神经病变患者周围神经的保护功能已得到公认。本研究显示,采用α硫辛酸进行干预可明显改善EAE模型大鼠神经功能损伤症状;组织病理学结果证实,α硫辛酸可明显改善EAE所致的轴索损伤现象;此外,采用α硫辛酸进行干预可明显降低EAE模型大鼠复发率。分析其原因可能与α硫辛酸对EAE所致的轴索损伤发挥保护作用有关。
综上所述,α硫辛酸对EAE大鼠轴索损伤具有一定保护作用。然而,α硫辛酸对EAE的作用机制尚未完全明确,有待进一步深入研究。
[参考文献]
[1] 纪祥,罗军,吕建广,等.脑部多发性硬化的CT、MRI表现[J].临床荟萃,2011,26(16):1452-1453,封3.
[2] 钟晓南,胡学强.多发性硬化的研究进展[J].中华神经科杂志,2014,47(12):886-887.
[3] 胡学强,钟晓南.多发性硬化的轴索损伤及其机制[J].中国现代神经疾病杂志,2012,12(2):101-107.
[4] Yi X,Nickeleit V,James LR,et al.alpha-lipoic acid protects diabetic apolipoprotein E-deficient mice from nephropathy[J].J Diabetes Complications,2011,25(3):193-201.
[5] 张孝丽,郭晖.α硫辛酸治疗糖尿病周围神经病变的研究进展[J].医学综述,2011,17(2):281-283.
[6] 周莉,樊永平.二黄方减少多发性硬化轴索损伤和复发的临床研究[J].中国中医药信息杂志,2012,19(8):14-15.
[7] Kono DH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168(1):213-227.
[8] 徐雁,崔丽英.多发性硬化和视神经脊髓炎的体液免疫机制及其干预策略[J].生命科学,2014,26(6):657-664.
[9] 陈璇,李咏梅,欧阳羽,等.不同回波时间氢质子磁共振波谱多体素技术检出多发性硬化病灶和看似正常脑白质区[J].中国医学影像技术,2011,27(1):32-36.
[10] 蔡盈盈,杜昌升.多发性硬化疾病及模型小鼠中疾病相关细胞因子和转录因子研究进展[J].中国细胞生物学学报,2012,34(8):826-836.
[11] 蒋云,童兴剑,王萌,等.尿酸与多发性硬化发生和复发的关系[J].中国神经免疫学和神经病学杂志,2013,20(2):97-100.
[12] 张菲菲,李静.多发性硬化症治疗药物研究进展[J].国际药学研究杂志,2014,41(3):296-300,341.
[13] 孟健,刘春云,张文燕,等.硫辛酸对实验性自身免疫性脑脊髓炎大鼠细胞间粘附分子-1和肿瘤坏死因子-α表达的影响[J].实用医技杂志,2008,15(6):682-685.
(本文编辑:刘斯静)
![]()