·论 著·
倪丽芳1,路世芳2,高焕云3,陈砚凝4*
(1.河北省宁晋县妇幼保健院检验科,河北 宁晋 055550;2.河北省宁晋县妇幼保健院儿科,河北 宁晋 055550;3.河北省宁晋县妇幼保健院外科,河北 宁晋 055550;4.河北医科大学第四医院病理科,河北 石家庄 050011)
[摘要] 目的观察Bcl-2蛋白与雌激素受体在不同程度宫颈病变中的表达。方法选取180例宫颈组织蜡块,其中慢性宫颈炎40例,低度宫颈上皮内瘤变(cervical intraepithelial neoplasia Ⅰ,CINⅠ)40例,高度宫颈上皮内瘤变(CINⅡ~Ⅲ)60例,宫颈癌40例(其中鳞癌35,腺癌5例)。免疫组织化学法检测ER蛋白和Bcl-2蛋白的表达水平,并进行相关性分析。结果随着宫颈病变进展,ER的阳性率逐渐降低,与慢性宫颈炎组比较,CINⅡ~Ⅲ组、宫颈鳞癌组和腺癌组差异均有统计学意义,而CINⅠ组差异无统计学意义;随着宫颈病变进展,Bcl-2蛋白阳性率逐渐升高,与慢性宫颈炎组比较,CINⅠ、CINⅡ~Ⅲ、宫颈鳞癌组和腺癌组差异均有统计学意义。CINⅡ~Ⅲ组中ER与Bcl-2的表达存在相关性,在其余组中不具有相关性。结论ER蛋白的表达水平随宫颈病变程度的提高而降低,Bcl-2蛋白的表达水平则随之升高,2种蛋白在高度分化的宫颈上皮内瘤变组织中具有明显的相关性,联合表达阳性可能是高度宫颈上皮内瘤变发生的主要机制之一。
[关键词] 宫颈肿瘤;宫颈上皮内瘤样病变;受体,雌激素 doi:10.3969/j.issn.1007-3205.2015.08.031
[收稿日期]2014-12-19;[修回日期]2015-01-04
[作者简介]倪丽芳(1979-),女,河北宁晋人,河北省宁晋县妇幼保健院主管检验师,医学学士,从事临床检验学研究。
通讯作者*
[中图分类号] R737.33 [文献标志码] B
宫颈癌是严重危害女性健康的恶性肿瘤,其在女性中的发病率仅位于乳腺癌之后,近年来有年轻化趋势[1]。目前认为,高危型人乳头瘤病毒(human papillomavirus,HPV)感染直接导致宫颈癌的前期病变,且HPV与雌激素具有协同的致癌作用[2]。雌激素受体(estrogen receptor,ER)是位于细胞膜上参与雌激素非基因转录效应的一种配体依赖型转录因子,是雌激素与肿瘤发生联系的关键中间物质,其与雌激素结合后可通过雌激素应答元件调节基因的转录[3]。Bcl-2蛋白是与细胞凋亡密切相关的细胞因子,受ER和雌二醇的影响。虽然目前已有报道显示ER、Bcl-2蛋白在宫颈癌中有不同程度的异常表达,但两者的表达水平是否有相关性目前并不清楚。本研究检测不同程度宫颈病变组织中ER和Bcl-2蛋白的表达水平,并探讨两者在宫颈癌病变中的相关性。
1.1 标本来源 选取2012年2月—2013年12月河北医科大学第四医院保存的180例宫颈组织石蜡标本。依据WHO病理组织学标准进行诊断,其中慢性宫颈炎组织石蜡标本40例,低度宫颈上皮内瘤变(cervical intraepithelial neoplasia Ⅰ,CINⅠ)组织石蜡标本40例,高度宫颈上皮内瘤变(CINⅡ~Ⅲ)组织石蜡标本60例,宫颈癌组织石蜡标本40例(鳞癌35例,腺癌5例)。慢性宫颈炎组织标本取自患有子宫肌瘤而进行子宫全切除手术的患者。排除标准:①接受过放化疗的患者;②同时患有其他恶性肿瘤的患者;③妊娠及哺乳期妇女;④代谢性疾病患者;⑤近期使用过甾体类激素的患者。患者年龄24~68岁,平均(36.5±12.4)岁,经统计学分析,不同程度宫颈病变患者年龄差异无统计学意义(P>0.05),具有可比性。
1.2 试剂 鼠抗人ER单克隆抗体(博士德)、鼠抗人Bcl-2单克隆抗体(上海亿欣)、二步法抗兔、鼠通用型免疫组织化学检测试剂盒(Dako)、山羊血清(Hyclone)。
1.3 检测方法 ①石蜡切片:将所有样品分别进行石蜡切片(切片厚度为4 μm),用3%过氧化氢孵育去内源性过氧化物酶活性,然后进行抗原修复(微波修复,中火6 min,重复4次)。②免疫组织化学染色:按照试剂盒说明分别进行ER、Bcl-2免疫组织化学染色。首先用血清进行封片,分别滴加一抗,于4 ℃孵育过夜,然后加二抗室温孵育1 h,加二氨基联苯胺显色后用苏木素进行复染,最后用中性树胶封片,镜检。
1.4 诊断标准 细胞核内出现棕黄色颗粒为ER染色的阳性表达细胞,胞浆或细胞膜呈现棕黄色颗粒为Bcl-2阳性表达细胞。镜检时,随机选取5个视野,使用图像扫描分析系统计算阳性细胞率,并以下面标准判断切片为阳性或阴性:阳性标准为阳性细胞率>10%,阴性标准为阳性细胞率<10%。
1.5 统计学方法 应用SPSS 17.0软件包对研究数据进行统计学分析。计量资料以![]() ±s表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用χ2检验;相关性分析采用列联系数检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用χ2检验;相关性分析采用列联系数检验。P<0.05为差异有统计学意义。
2.1 ER蛋白和Bcl-2蛋白的表达 慢性宫颈炎组织(图1A)和宫颈上皮内瘤变组织(图1B 和C)中的鳞状上皮细胞、腺上皮细胞和间质细胞均有ER蛋白的分布,受癌细胞侵犯的腺体中无ER蛋白分布,癌巢中有少量ER蛋白的表达(图1D和E)。慢性宫颈炎组织、宫颈上皮内瘤组织的上皮和腺体组织中均无Bcl-2表达,血管组织则染色较为明显;宫颈癌组织中在癌巢及血管处则多有分布(图2)。
2.2 不同宫颈病变组织中ER和Bcl-2表达比较 鳞癌组ER表达较慢性宫颈炎组和CIN Ⅰ组明显降低(P<0.05),CIN Ⅱ~Ⅲ组ER表达较慢性宫颈炎组也降低(P<0.05);CIN Ⅰ组、CIN Ⅱ~Ⅲ组、鳞癌组和腺癌组Bcl-2表达较慢性宫颈炎组升高(P<0.05)。见表1。
表1 不同宫颈病变组织中ER和Bcl-2表达比较 (例数,%)
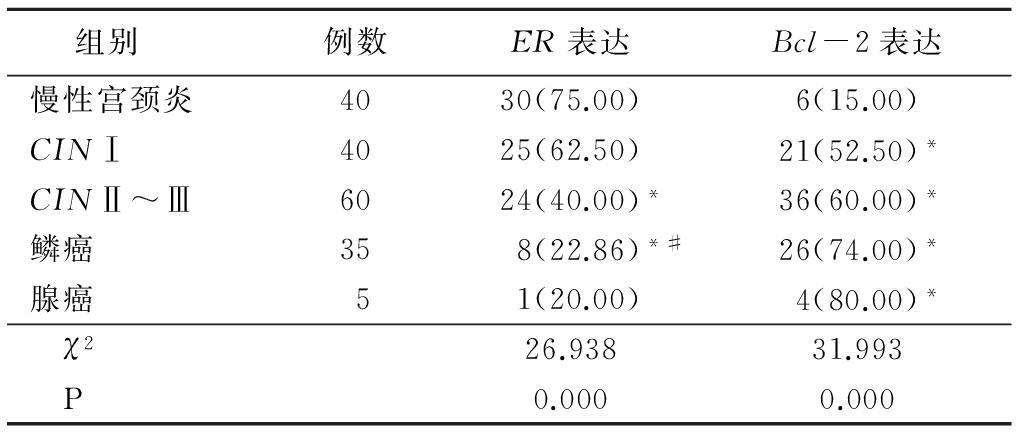
*P<0.05与慢性宫颈炎比较 #P<0.05与CINⅠ组比较(χ2检验)
2.3 ER与Bcl-2在不同宫颈病变组织中的阳性表达及相关性 在CIN Ⅰ中,Bcl-2表达阳性率52.5%(21/40)与ER表达阳性率62.5%(25/40)差异无统计学意义(P>0.05),ER与Bcl-2表达也无关联(列联系数=0.295,P=0.121);在CINⅡ~Ⅲ中,Bcl-2表达阳性率60.0%(36/60)与ER表达阳性率40.0%(24/60)差异有统计学意义(P<0.01),ER与Bcl-2表达有关联(列联系数=0.389,P=0.006);在鳞癌中,Bcl-2表达阳性率74.3%(26/35)与ER表达阳性率22.9.%(8/35)差异有统计学意义(P<0.01),ER与Bcl-2表达无关联(列联系数=0.089,P=0.683);在腺癌中,Bcl-2表达阳性率80.0%(4/5)与ER表达阳性率20.0%(1/5)差异无统计学意义(P>0.05),ER与Bcl-2表达无关联(列联系数=0.250,P=0.402)。见表2。
表2 ER与Bcl-2在不同宫颈病变组织中的阳性表达 (例数)

宫颈癌从宫颈上皮内瘤变(CINⅠ、CINⅡ、CINⅢ)逐步发展到早期浸润癌,然后再发展到浸润癌。临床研究发现宫颈浸润癌5年存活率约为67%,早期癌为90%,宫颈上皮内瘤变的存活率则为100%[4]。一般认为HPV感染和其他多种因素共同作用导致宫颈癌的发生[5]。对口服避孕药的研究发现雌激素水平与宫颈癌的发生密切相关,且其并不因绝经而发生变化[6]。雌激素不仅可以通过诱发细胞突变而导致宫颈癌细胞持续生长,还可以通过抑制细胞凋亡,致使感染HPV的宫颈细胞不断增殖[7]。外源或内源性雌激素与胞核内的的ER结合后,同目的基因启动子附近的雌激素受体反应元件再结合,与相关辅助因子形成转录起始复合物,从而启动基因的转录,调节雌激素促进细胞增殖、抑制细胞凋亡的功能[8]。Bcl-2蛋白是一种线粒体内膜蛋白,可以减少由各种刺激引起的细胞损伤,从而抑制细胞凋亡[9]。染色体易位、转录后调节异常等因素均能导致Bcl-2蛋白的过度表达,在抑制细胞凋亡的同时,能保持突变基因促进肿瘤的发生[10]。有文献报道,Bcl-2蛋白的表达水平因肿瘤分化程度不同而不同,在分化程度较高的肿瘤组织中Bcl-2蛋白的表达量也相应较高[11]。本研究检测了不同病变程度宫颈组织中ER和Bcl-2的表达水平,并探讨了两者在宫颈癌变中的相关性。研究结果显示随着宫颈病变的加重,ER蛋白表达的阳性率逐步降低,提示ER蛋白在宫颈癌进展中起着保护作用;鳞癌组与腺癌组差异无统计学意义,表明ER蛋白的表达量与肿瘤类型和分化程度无关。ER蛋白在肿瘤组织中表达量相对较低的原因可能是因为较高的雌激素水平导致雌激素-ER蛋白二聚体增多,游离的ER蛋白相应降低。Bcl-2蛋白在不同宫颈病变程度组织中的表达水平则与ER蛋白相反,其阳性率随着病变程度的加重而升高,且鳞癌组与腺癌组表达差异也无统计学意义。提示Bcl-2蛋白的表达可能与宫颈病变的分化程度有关,而与肿瘤的类型无关,其表达量的升高在宫颈癌中是一个早期事件,这对患者的预后是很有利的。通过对不同宫颈病变组织中的ER蛋白和Bcl-2阳性表达进行相关性分析,得出在CINⅡ~Ⅲ中2种蛋白的表达具有相关性,在此阶段2种蛋白的联合表达率高于鳞癌和腺癌组,说明ER蛋白在CINⅡ~Ⅲ阶段可能会调节Bcl-2的表达。雌激素-ER蛋白二聚体可通过增加内源性Ca2+浓度,并激活MAPK而导致转录因子的活化,从而进一步促进了Bcl-2的表达[12]。高度分化的宫颈上皮内瘤变可能是雌激素作用的重要时期。
综上所述,ER蛋白的表达水平随宫颈病变程度的提高而降低,Bcl-2蛋白的表达水平则随之升高,2种蛋白在高度分化的宫颈上皮内瘤变组织中具有明显的相关性。(本文图见封三)
[参考文献]
[1] Arbyn M,Castellsagué X,de Sanjose S,et al.Worldwide burden of cervical cancer in 2008[J].Ann Oncol,2011,22(12):2675-2686.
[2] Snijders PJ,Verhoef VM,Arbyn M,et al.High-risk HPV testing on self-sampled versus clinician-collected specimens:a review on the clinical accuracy and impact on population attendance in cervical cancer screening[J].Int J Cancer,2013,132(10):2223-2236.
[3] Larsen MS,Bjerre K,Giobbie-Hurder A,et al.Prognostic value of Bcl-2 in two independent populations of estrogen receptor positive breast cancer patients treated with adjuvant endocrine therapy[J].Acta Oncologica,2012,51(6):781-789.
[4] Yasmeen A,Beauchamp MC,Piura E,et al.Induction of apoptosis by metformin in epithelial ovarian cancer:involvement of the Bcl-2 family proteins[J].Gynecol Onco,2011,121(3):492-498.
[5] 朱华洁.宫颈薄层液基细胞学检查联合高危型HPV检测在宫颈病变筛查中的临床应用[J].河北医科大学学报,2012,33(6):645-648.
[6] Wynder EL,Cornfield J,Schroff PD,et al.A study of environmental factors in carcinoma of the cervix[J].Am J Obstet Gynecol,2013,68(2):1016-1052.
[7] Sundström K,Ploner A,Dahlström LA,et al.Prospective study of HPV16 viral load and risk of in situ and invasive squamous cervical cancer[J].Cancer Epidemiol Biomarkers Prev,2013,22(1):150-158.
[8] Elangovan S,Ramachandran S,Venkatesan N,et al.SIRT1 is essential for oncogenic signaling by estrogen/estrogen receptor α in breast cancer[J].Cancer Res,2011,71(21):6654-6664.
[9] Mamounas EP,Tang G,Fisher B,et al.Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative,estrogen receptor-positive breast cancer:results from NSABP B-14 and NSABP B-20[J].J Clin Oncol,2010,28(10):1677-1683.
[10] Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1/2):41-58.
[11] Smerage JB,Budd GT,Doyle GV,et al.Monitoring apoptosis and Bcl-2 on circulating tumor cells in patients with metastatic breast cancer[J].Mol Oncol,2013,7(3):680-692.
[12] Cotrim CZ,Fabris V,Doria ML,et al.Estrogen receptor beta growth-inhibitory effects are repressed through activation of MAPK and PI3K signalling in mammary epithelial and breast cancer cells[J].Oncogene,2013,32(19):2390-2402. M,Castellsagué X,de Sanjose S,et al.Worldwide burden of cervical cancer in 2008[J].Ann Oncol,2011,22(12):2675-2686.
[2] Snijders PJ,Verhoef VM,Arbyn M,et al.High-risk HPV testing on self-sampled versus clinician-collected specimens:a review on the clinical accuracy and impact on population attendance in cervical cancer screening[J].Int J Cancer,2013,132(10):2223-2236.
[3] Larsen MS,Bjerre K,Giobbie-Hurder A,et al.Prognostic value of Bcl-2 in two independent populations of estrogen receptor positive breast cancer patients treated with adjuvant endocrine therapy[J].Acta Oncologica,2012,51(6):781-789.
[4] Yasmeen A,Beauchamp MC,Piura E,et al.Induction of apoptosis by metformin in epithelial ovarian cancer:involvement of the Bcl-2 family proteins[J].Gynecol Onco,2011,121(3):492-498.
[5] 朱华洁.宫颈薄层液基细胞学检查联合高危型HPV检测在宫颈病变筛查中的临床应用[J].河北医科大学学报,2012,33(6):645-648.
[6] Wynder EL,Cornfield J,Schroff PD,et al.A study of environmental factors in carcinoma of the cervix[J].Am J Obstet Gynecol,2013,68(2):1016-1052.
[7] Sundström K,Ploner A,Dahlström LA,et al.Prospective study of HPV16 viral load and risk of in situ and invasive squamous cervical cancer[J].Cancer Epidemiol Biomarkers Prev,2013,22(1):150-158.
[8] Elangovan S,Ramachandran S,Venkatesan N,et al.SIRT1 is essential for oncogenic signaling by estrogen/estrogen receptor α in breast cancer[J].Cancer Res,2011,71(21):6654-6664.
[9] Mamounas EP,Tang G,Fisher B,et al.Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative,estrogen receptor-positive breast cancer:results from NSABP B-14 and NSABP B-20[J].J Clin Oncol,2010,28(10):1677-1683.
[10] Ola MS,Nawaz M,Ahsan H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1/2):41-58.
[11] Smerage JB,Budd GT,Doyle GV,et al.Monitoring apoptosis and Bcl-2 on circulating tumor cells in patients with metastatic breast cancer[J].Mol Oncol,2013,7(3):680-692.
[12] Cotrim CZ,Fabris V,Doria ML,et al.Estrogen receptor beta growth-inhibitory effects are repressed through activation of MAPK and PI3K signalling in mammary epithelial and breast cancer cells[J].Oncogene,2013,32(19):2390-2402.
(本文编辑:刘斯静)