·论 著·
暴云锋1,王晶晶2,诸葛铭宁3,张洪珍2*(1.河北省人民医院医学影像科,河北 石家庄 050051;2.河北省人民医院肿瘤五科,河北 石家庄 050051;3.河北省人民医院急诊科,河北 石家庄 050051)
[摘要] 目的探讨阿霉素对大鼠心肌纤维化的影响机制。方法尾静脉注射阿霉素6周(3 mg/kg,每周1次),观察大鼠的一般情况及体质量,于第7周检测血流动力学指标、羟脯氨酸含量及心肌组织形态学的变化。结果与正常对照组比较,阿霉素模型组心肌组织中的羟脯氨酸含量升高,组织病理学进一步证实阿霉素对心肌纤维化的诱导作用,血流动力学检测显示左心室舒张末期压升高,左心室收缩压、左心室压最大上升速率及最大下降速率降低,差异有统计学意义(P<0.05)。结论阿霉素可以诱导大鼠心肌纤维化,抑制心功能。
[关键词] 心内膜心肌纤维化症;阿霉素;大鼠
doi:10.3969/j.issn.1007-3205.2016.03.002
阿霉素因其抗瘤谱广、临床疗效高、对乏氧细胞同样有效等显著特点,常作为一线抗癌药物广泛应用于乳腺癌、肝癌、前列腺癌等实体瘤及血液系统恶性肿瘤的治疗[1]。有研究证实阿霉素与心脏组织的高亲和力可导致剂量依赖的不可逆转的慢性心力衰竭、心脏重塑,限制了其临床应用[2],但是具体机制尚不清楚。本研究通过尾静脉注射阿霉素(3 mg/kg,每周1次,连续6周)建立心肌纤维化动物模型,观察阿霉素对心肌纤维化的影响并探讨其可能的机制。
1.1 实验动物分组 雄性Sprague-Dawley大鼠(体质量220~260 g)购自河北省实验动物中心,均在标准实验室环境[昼夜循环,保持温度(25±1) ℃、湿度(55±10)%]中自由摄取食水。随机将大鼠分为模型组和正常对照组各8只。模型组大鼠给予尾静脉注射阿霉素6周(3 mg/kg,每周1次),正常对照组给予同等体积的生理盐水。观察大鼠的一般状态,记录体质量及病死率。
1.2 试剂及仪器 盐酸阿霉素为浙江海正药业股份有限公司产品;生化试剂盒购买于南京建成生物工程研究所;BL-410生物机能信号处理及分析系统为成都泰盟科技有限公司产品。
1.3 血流动力学检测 于第7周终止模型制备,禁食水12 h后称体质量,腹腔注射25%乌拉坦(5 mg/kg)麻醉,大鼠置于仰卧位固定于手术操作台上,常规进行剪毛消毒,取颈部正中切口,暴露并钝性分离右颈总动脉,静脉注射肝素液以进行肝素化,将心导管逆行插入右颈总动脉,顺势将其送至左心室,将导管的另一端连接至压力传感器上,与生理记录仪(BL-410型,成都泰盟科技有限公司)相连接。当屏幕显示的波形图由血压波变成下沿达0 mmHg附近具有明显舒张期而封顶平坦的波形时,表明导管已通过主动脉瓣进入左心室腔内。平稳5 min后,记录左心室收缩压、左心室压最大上升速率、左心室压最大下降速率和左心室舒张末期压,用BL-410生物机能信号处理及分析系统软件进行数据分析。
1.4 计算心脏质量指数 血流动力学检测完成后,剪开胸腔,迅速摘取心脏,用4 ℃冰冷生理盐水冲洗,滤纸吸干,称取全心质量后,沿房室交界处减去心房和右心室,称取左心室质量,计算心脏质量指数(全心质量/体质量)和左心室质量指数(左心室质量/体质量)。
1.5 胶原含量检测 羟脯氨酸是代表胶原含量的指标,在氧化剂的作用下所产生的氧化产物与二甲氨基苯甲醛作用呈现紫红色。取左心室心肌组织100 mg用碱水解法,按照试剂盒说明在550 nm波长用分光光度法测定心肌组织羟脯氨酸含量,浓度用μg/mg(心肌组织质量)表示。
1.6 心肌损伤的病理学检查 心室样本用10%多聚甲醛固定,逐级乙醇脱水,常规石蜡包埋,与纵轴垂直切取4 μ厚切片数张,行HE染色,用光学显微镜观察心肌组织结构的变化。
1.7 心肌纤维化程度评估 为了进一步明确阿霉素对心肌间质胶原沉积程度的影响,行Masson胶原纤维特异性染色。结果判定:胶原纤维呈蓝色,细胞浆、肌纤维呈红色,胞核呈蓝色。
1.8 统计学方法 应用SPSS 13.0软件对实验数据进行统计学处理,计量资料以![]() ±s表示,组间比较采用独立样本的t检验。 P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本的t检验。 P<0.05为差异有统计学意义。
2.1 阿霉素对大鼠一般情况的影响 与正常对照组相比,模型组大鼠消瘦、喜蜷缩、进食水量减少。给药结束时,大鼠死亡3只(病死率37.5%)。
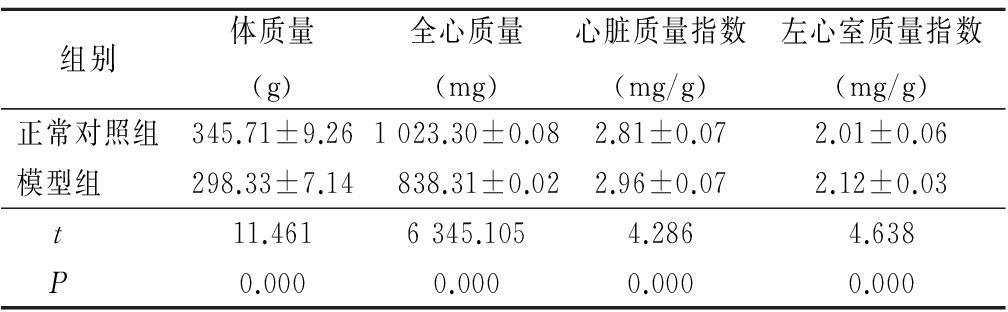
2.2 阿霉素对体质量和心脏质量指数的影响 与正常对照组相比,模型组大鼠的体质量及全心质量降低,而心脏质量指数及左心质量指数较正常对照组升高,差异有统计学意义(P<0.05),见表1。
表1 阿霉素对体质量和心脏质量指数的影响
Table 1 The effects of adriamycin on cardiac
mass indexes in rats
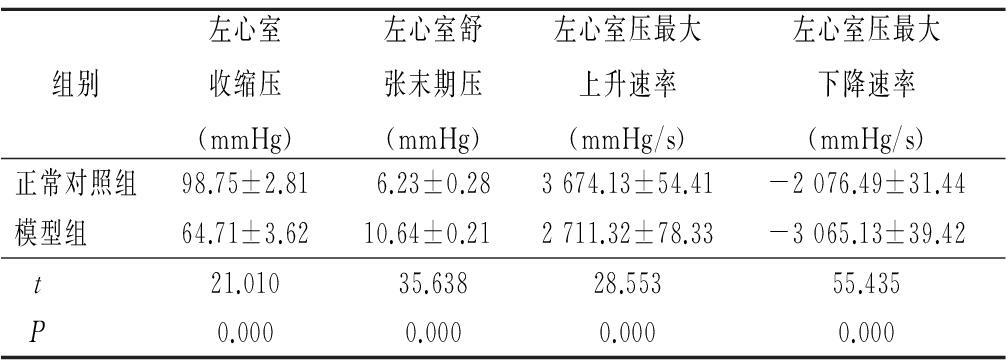
2.3 阿霉素对心功能的影响 与正常对照组相比,模型组左心室舒张末期压升高,左心收缩压、左心室压最大上升速率和最大下降速率降低,差异有统计学意义(P<0.05),见表2。
表2 阿霉素对心功能的影响
Table 2 The effects of adriamycin on
cardiac function in rats
2.4 阿霉素对胶原含量的影响 与正常对照组相比,模型组羟脯氨酸含量明显增加,差异有统计学意义(P<0.05)(图1)。
2.5 阿霉素对心肌组织病理学的影响 正常对照组心肌纤维排列整齐,间隙正常,胞浆丰富均匀,无心肌细胞坏死及炎症细胞浸润(图2A);模型组正常结构消失,心肌纤维变形肿胀,排列紊乱,横纹消失,肌浆凝聚、溶解,胞浆呈不同程度空泡化,细胞外间隙较对照组明显增宽,部分心肌组织可见炎性细胞浸润(图2B)。Masson胶原特异染色(正常心肌为红色,纤维化区域为蓝色)结果显示,与正常对照组(图3A)相比,模型组胶原蓄积,纤维化范围明显增加(图3B)。
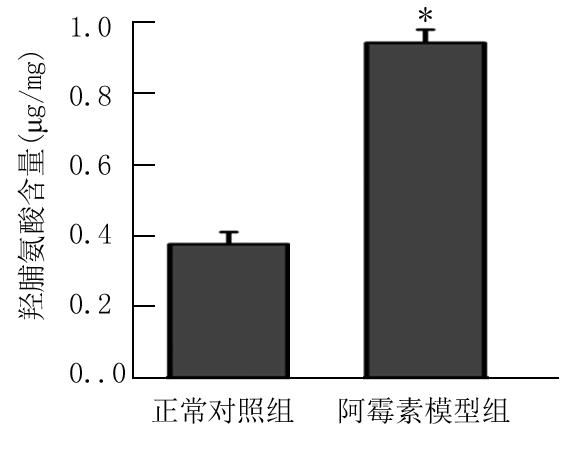
图1 阿霉素对胶原含量的影响
*P<0.05与正常对照组比较(t检验)
Figure 1 The effect of adriamycin on collagen content in rats

图2 阿霉素对心肌组织病理学的影响(HE染色×400)
A.正常对照组;B.阿霉素模型组
Figure 2 The effects of adriamycin on histopathologic changes in myocardium(HE staining ×400)

图3 阿霉素对心肌纤维化程度的影响(Masson染色×400)
A.正常对照组; B.阿霉素模型组
Figure 3 The effect of adriamycin on extent of myocardial fibrosis in rats(Masson staining ×400)
阿霉素作为一种广谱的蒽环类化疗药物已广泛应用于恶性肿瘤的临床治疗,但于用药早期即可出现一过性的急性心肌损伤,包括心律失常、低血压及各种心电图改变等,心肌毒性随剂量积累而增加,晚期表现为不可逆的慢性心力衰竭及心脏重塑[3],病死率较高。因此,研究阿霉素的慢性心脏毒性机制,以便使阿霉素更好地发挥抗肿瘤作用,从而提高患者的生存率,是目前国内外研究的热点问题。
研究发现,当体内阿霉素累积剂量达到450~500 mg/m2时会导致心力衰竭,发生率30%左右;累积剂量达600 mg/m2时,心力衰竭发生率高达70%。而通过反复给药,阿霉素诱导的大鼠慢性心力衰竭与临床相似[4]。本研究采用尾静脉注射阿霉素(3 mg/kg,每周1次,连续6周)模拟人类的临床化疗过程,发现阿霉素模型组大鼠的体质量及心脏质量下降,心质量指数及左心室质量指数升高,并出现较高的死亡发生率;HE染色显示阿霉素使心肌正常结构消失,心肌纤维变形肿胀,排列紊乱,横纹消失,肌浆凝聚、溶解,胞浆呈不同程度空泡化,细胞外间隙增宽,炎性细胞浸润。与文献报道一致[5],进一步证实给药结束时已达到阿霉素的心脏毒性累积剂量,严重时可导致心源性猝死。王翠英等[6]发现阿霉素还可以诱导患者出现ST-T段改变,T波低平、倒置,QRS低电压、QT间期延长等心电图改变,可能是由于阿霉素在体内诱导氧自由基的产生,引起脂质过氧化反应,损伤了细胞膜的完整性,使细胞膜电位发生改变[7]。心功能是反映心力衰竭程度最直接的指标。研究发现,阿霉素可导致心室功能障碍,从而诱导大鼠血浆脑钠肽(brain natriuretic peptide,BNP)的合成[8],而且心力衰竭患者的血浆脂褐素及BNP水平也与心功能级别呈线性相关[9]。本研究结果显示,阿霉素模型组左心室舒张末期压升高,左心室收缩压和左心室压最大上升速率降低。表明阿霉素使心脏收缩和舒张功能均明显受损[10]。更有意义的是,本研究显示阿霉素使心肌组织羟脯氨酸含量增加,胶原蓄积,出现严重的心肌纤维化。这是由于阿霉素诱导氧自由基等因素损伤心肌细胞导致慢性心力衰竭时,心肌细胞和细胞外基质的结构和功能发生改变,使胶原表达异常,从而触发了心肌纤维化的进程。本研究中阿霉素诱导的心功能改变与心肌组织病理学表现呈正相关,可能是由于心肌纤维化导致室壁僵硬度增加,顺应性降低,从而使心功能发生紊乱,这可能是阿霉素对心肌纤维化的影响机制之一。
综上所述,应用尾静脉注射阿霉素(3 mg/kg,每周1次)连续6周,累计剂量达18 mg/kg,可造成心肌纤维化并抑制大鼠的心功能。因此,血流动力学可作为阿霉素心肌损伤程度的指标之一。尽管其具体机制尚未完全阐明,但本研究结果已经为阿霉素心脏毒性的进一步研究提供了理论与实验基础。
[参考文献]
[1] Oliveira MS,Carvalho JL,Campos AC,et al. Doxorubicin has in vivo toxicological effects on ex vivo cultured mesenchymal stem cells[J]. Toxicol Lett,2014,224(3):380-386.
[2] Dirks-Naylor AJ. The role of autophagy in doxorubicin-induced cardiotoxicity[J]. Life Sci,2013,93(24):913-916.
[3] Alsaad AM,Zordoky BN,El-Sherbeni AA,et al. Chronic doxorubicin cardiotoxicity modulates cardiac cytochrome p450-mediated arachidonic acid metabolism in rats[J]. Drug Metab Dispos,2012,40(11):2126-2135.
[4] Chen ZC,Chen LJ,Cheng JT. Doxorubicin-induced cardiac toxicity is mediated by lowering of peroxisome proliferator-activated receptor delta expression in rats[J]. PPAR Res,2013,2(4):456-461.
[5] 魏征人,陈智嘉,张春璐,等.黄芪注射液对阿霉素所致心肌病理改变和超微结构的影响[J].中国应用生理学杂志,2013,29(5):404-405.
[6] 王翠英,宋春燕,沈凤梅.参麦注射液对阿霉素心脏毒性保护作用的研究[J].临床荟萃,2012,27(13):1169-1170.
[7] Lehmann K,Rickenbacher A,Jang JH,et al. New insight into hyperthermic intraperitoneal chemotherapy: induction of oxidative stress dramatically enhanced tumor killing in in vitro and in vivo models[J]. Ann Surg,2012,256(5):730-737.
[8] 曾海燕.莱菔硫烷对阿霉素诱导心肌毒性大鼠的保护作用[J].当代医学,2014,20(1):27-28.
[9] 徐公民.血浆脂联素和B型钠尿肽水平在慢性充血性心力衰竭患者心功能评价中的价值[J].河北医科大学学报,2013,34(3):259-262
[10] Li C,Gao Y,Tian J,et al. Long-term oral Asperosaponin Ⅵ attenuates cardiac dysfunction,myocardial fibrosis in a rat model of chronic myocardial infarction [J]. Food Chem Toxicol,2012,50(5):1432-1438.
(本文编辑:刘斯静)
BAO Yun-feng1, WANG Jing-jing2, ZHUGE Ming-ning3, ZHANG Hong-zhen2*
(1. Department of Radiology, Hebei General Hospital, Shijiazhuang 050051, China; 2.Department of Oncology Ⅴ, Hebei General Hospital, Shijiazhuang 050051, China; 3. Department of Emergency, Hebei General Hospital, Shijiazhuang 050051, China)
[Abstract] Objective To determine the effect of adriamycin on myocardial fibrosis and possible mechanisms in rats. Methods A rat myocardial fibrotic model was induced by intravenous injection of adriamycin(3 mg/kg, once a week) for six weeks. During the test, general condition and body weight were observed. At the seventh week, hemodynamic parameters and hydroxyproline concentration as well as morphological transformation of heart tissues were detected. Results Compared to those in control group, hydroxyproline content was markedly increased in adriamycin induced rats. Histopathological examination further confirmed the same alteration. Moreover, hemodynamics showed a significant decline in left-ventricular systolic pressure, maximum and minimum rate of developed left ventricular pressure, accompanied by an increment of left ventricular end-diastolic pressure(P<0.05). Conclusion These findings suggested that adriamycin could induce myocardial fibrosis and inhibit cardiac function.
[Key words] endomyocardial fibrosis; adriamycin; rats
[中图分类号] R542.23
[文献标志码] A
[文章编号] 1007-3205(2016)03-0252-04
*通讯作者
[作者简介]暴云锋(1974-),男,河北石家庄人,河北省人民医院主管技师,医学硕士,从事医学影像诊断研究。
[收稿日期]2015-02-06;[修回日期]2015-02-27