·论 著·
胡彩霞1,江绍乾1,张国强1,冯 佳2,田 菲3,高顺强1*(1.河北医科大学第四医院皮肤科,河北 石家庄 050011;2.中国人民解放军白求恩国际和平医院消化内科,河北 石家庄 050082;3.河北省邢台市人民医院皮肤科,河北 邢台 054000)
[摘要] 目的探讨2-甲氧基雌二醇(2-methoxyestradiol,2-ME)对恶性黑素瘤(malignant melanoma,MM)细胞在小鼠体内生长的抑制作用。方法应用噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]方法检测2-ME对黑素瘤B16细胞的抑制作用。构建BALB/c小鼠的恶性黑素瘤细胞种植性肿瘤模型,分为3组,每组6只。治疗组(2-ME组)每只小鼠尾静脉注射50 mg/ kg 2-ME,阳性药物组[环磷酰胺(cyclophosphamide,CTX)组]每只小鼠尾静脉注射20 mg/kg CTX,阴性对照组(Nacl组)注射相同体积的生理盐水, 2 d/次,共14 d,每3 d测量肿瘤体积,实验结束后称量肿瘤质量;免疫组织化学(immunohistochemistry,IHC)方法对肿瘤组织Gadd45b和C-myc蛋白的表达变化进行分析,HE染色对治疗组和阴性对照组小鼠的肿瘤组织、肺组织、肝组织和脾组织进行形态分析。结果2-ME对黑素瘤B16细胞具有明显的抑制作用,且对B16细胞的抑制作用呈时间和剂量依赖性。CTX组和2-ME组肿瘤体积和肿瘤质量均小于Nacl组(P<0.01),但CTX组与2-ME组之间肿瘤体积和肿瘤质量差异无统计学意义(P>0.05)。IHC实验结果表明,与对照组相比,2-ME组小鼠肿瘤组织中C-myc蛋白表达水平明显升高,Gadd45b蛋白表达水平明显降低。HE染色结果显示,2-ME组小鼠和对照组小鼠的肝及脾均无明显的组织形态改变,而3/6的对照组小鼠发生肺组织转移,2-ME组肺脏无明显改变。结论2-ME对黑素瘤B16荷瘤小鼠的肿瘤生长具有抑制作用,其机制可能与调节C-myc和Gadd45b基因表达有关。
[关键词] 痣和黑素瘤;雌二醇;小鼠
doi:10.3969/j.issn.1007-3205.2016.03.011
恶性黑素瘤(malignant melanoma,MM)恶性程度高,具备高侵袭性及增殖能力,肿瘤细胞易发生淋巴及血行转移且预后差。MM占全部肿瘤患者的2%左右,占皮肤恶性肿瘤的第3位,其发病年增长率为3%~5%[1]。李薇薇等[2]研究1983—2010年70例皮肤黑素瘤,近10年病例占87.1%,近5年占70%。可见在中国黑素瘤发病率呈增长趋势。2-甲氧基雌二醇(2-methoxyestradiol,2-ME)是一种甾体激素类化合物,为17β-雌二醇非极性的内源性代谢产物,本实验前期研究结果显示2-ME体外对恶性黑素瘤B16细胞具有明显的生长抑制作用,并且2-ME可诱导黑素瘤细胞发生凋亡[3]。为进一步研究2-ME在体内对黑素瘤细胞的作用,本研究选择2-ME行小鼠体内抑瘤实验,以期探索将2-ME作为黑素瘤治疗药物的可能。
1.1 实验动物 BALB/c型小鼠18只,5~6周龄,20~22 g,均为雌性,由北京维通利华实验动物技术有限公司提供[生产许可证编号:SCXK(京)2012-0001],在河北医科大学第四医院实验动物中心饲养(在无特异病原菌级条件下饲养)。本研究均经医院动物管理使用委员会和伦理委员会批准。
1.2 实验材料 2-ME产自美国Cayman公司(货号13021,批号0433445-9,纯度≥95%);胎牛血清产自杭州四季青生物工程材料有限公司;RPMI 1640和胰蛋白酶产自美国Gibco公司;二甲基亚砜(DMSO)产自天津市永大化学试剂开发中心;Gadd45b、C-myc抗体购自美国bioworld公司;噻唑蓝[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]产自美国Sigma公司; SP免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。
1.3 细胞培养 小鼠黑素瘤B16细胞购自中国科学院上海生命科学研究院细胞资源中心。用含10%小牛血清的RPMI 1640培养液(含青霉素100 U/mL,链霉素100 mg/L)于37 ℃、5%CO2培养箱中培养,以0.25%的胰蛋白酶消化细胞传代,取对数生长期细胞用于实验。
1.4 实验方法
1.4.1 细胞活力检测 应用MTT法测定2-ME对细胞增殖的抑制作用,设置阴性对照组(仅有单细胞悬液)和实验组,阴性对照组加入等体积的含有0.01%DMSO的培养基,实验组使2-ME终浓度分别为10、20、40 μmol/L并做标记,培养 24、48、72 h后用酶标仪于波长 570 nm 处测定吸光度(optical delnsity,OD)值,抑制率 CI(%)=(1-试验组OD值/对照组OD值)×100%。
1.4.2 小鼠种植性肿瘤模型的建立、干预及标本处理 于BALB/c型小鼠右肩胛皮下注射处于对数生长期的B16细胞0.2 mL(含2×105 细胞),当肿瘤体积增长到约0.1 cm3时,将小鼠随机分为3组,每组6只。治疗组(2-ME组)每只小鼠尾静脉注射2-ME(50 mg/kg),阳性药物组[环磷酰胺(cyclophosphamide,CTX)组]每只小鼠尾静脉注射CTX(20 mg/kg),阴性对照组(Nacl组)小鼠注射相同体积的生理盐水,2 d/次,共14 d。观察肿瘤的生长情况,按公式计算肿瘤体积=(1/2×长×宽2)。22 d后处死小鼠并称量瘤体质量。
1.4.3 免疫组织化学(immunohistochemistry,IHC)检测细胞蛋白 将2-ME组及0.9%生理盐水组小鼠肿瘤制成石蜡切片,按链霉菌抗生素蛋白过氧化物酶链接法(strptavidin-perosidase,SP)免疫组织化学试剂盒说明书所述方法检测C-myc、Gadd45b蛋白的表达情况。C-myc、Gadd45b抗体按 1∶100 稀释,生物素化山羊抗兔二抗和辣根过氧物酶标记的链酶卵白素(三抗)为试剂盒中的原液。二氨基联苯胺(diaminobenzidine,DAB)试剂显色后,终止显色,用苏木精染色,分化及中性树胶封片,光镜下观察结果。
1.4.4 HE染色检测细胞形态变化 将2-ME组及0.9%生理盐水组小鼠肿瘤组织、肝、肺和脾组织制成石蜡切片,封片后显微镜下观察细胞形态变化。
1.5 统计学方法 应用SPSS 13.0统计学软件分析数据。计量资料比较分别采用F检验、q检验和重复测量设计资料的方差分析。P<0.05为差异有统计学意义。
2.1 2-ME对恶性黑素瘤B16细胞增殖的抑制作用 以10、20、40 μmol/L浓度的2-ME处理 B16 细胞作为实验组,与阴性对照组在24、48、72 h的OD值进行比较。结果表明:不同浓度的2-ME对黑色素瘤B16细胞的增殖的抑制作用差异有统计学意义(F=920.783,P< 0.05);在培养24、48、72 h后2-ME对黑色素瘤B16细胞的增殖的抑制作用存在差异,具有统计学意义(F=6 245.727,P< 0.05);药物浓度和培养时间之间存在交互作用(F=1 199.587,P< 0.05)。
2.2 2-ME体内抑制肿瘤的形成 与Nacl组相比,2-ME能够明显抑制肿瘤细胞在体内的生长。肿瘤细胞接种7 d后,Nacl组小鼠的肿瘤体积开始增加,生长速度较快,而2-ME组及CTX组小鼠肿瘤体积增长缓慢。实验结束后,CTX组和2-ME组肿瘤体积和肿瘤质量均小于Nacl组(P<0.01),但CTX组与2-ME组之间肿瘤体积和肿瘤质量差异无统计学意义(P>0.05),见表1。
表1 3组肿瘤体积和肿瘤质量比较
Table 1 Comparisons of average volume and weight of
tumor tissue among three groups
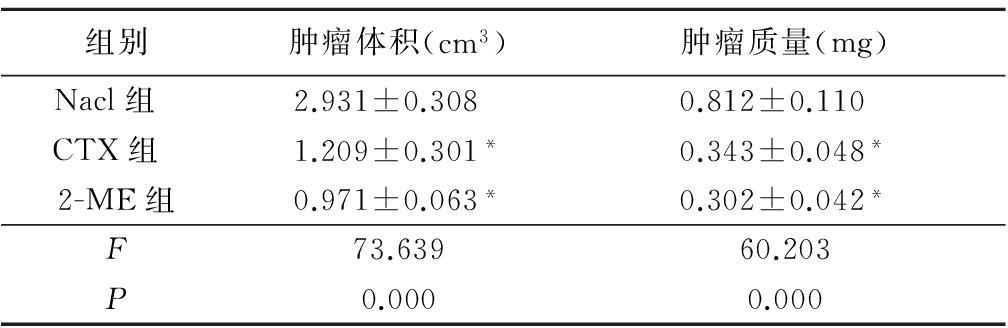
*P<0.05与Nacl组比较(q检验)
2.3 2-ME体内调控Gadd45b和C-myc蛋白的表达 对2-ME组和Nacl组荷瘤小鼠肿瘤组织进行免疫组织化学染色。C-myc蛋白阳性染色定位于细胞核,呈棕黄色颗粒状分布。Gadd45b蛋白阳性染色定位于细胞浆,呈棕黄色颗粒分布。Nacl组Gadd45b在肿瘤细胞中无或微量表达,2-ME组Gadd45b在肿瘤细胞中大量表达,Nacl组C-myc在肿瘤细胞大量表达,部分呈弥漫性强染色,2-ME组C-myc在肿瘤细胞中微量表达。与Nacl组相比,2-ME有降低 C-myc蛋白表达水平,升高 Gadd45b蛋白表达水平的趋势。见图1。
2.4 2-ME对小鼠肝、肺、脾及肿瘤组织形态的影响 对2-ME组和Nacl组荷瘤小鼠的肝、肺、脾组织及肿瘤组织进行HE染色。结果显示:2-ME组肿瘤组织的瘤细胞密度较稀,间质较多,可见坏死、凋亡的细胞,含色素颗粒细胞较Nacl组明显增多,小鼠肝、肺及脾组织结构清晰,染色均一;与2-ME组相比,Nacl组可见数量多且排列紧密体积较大的瘤细胞,细胞核异型性明显,部分肿瘤细胞呈巢状排列,小鼠的肝及脾组织未见明显的组织病理学改变,而Nacl组3/6肺组织中出现少量转移灶。表明2-ME对小鼠可能没有潜在的毒性,且能抑制黑素瘤的转移。见图2。
2-ME是一种甾体激素类化合物,为17β-雌二醇非极性的内源性代谢产物。后者是存在人类体内的天然雌激素,在细胞色素p450酶的作用下,17β-雌二醇被羟基化成为2-脱氢雌二醇,进一步被儿茶酚胺氧位甲基转移酶甲基化形成 2-ME。大量的体内外实验结果显示2-ME具有多种生物学功能[4-5]。目前的研究结果显示,其抗肿瘤的作用机制包括:①调控低氧诱导因子1和抑制血管生成,2-ME的抗血管新生机制除直接作用于内皮细胞诱导其凋亡、抑制其增殖外, 还与其对肿瘤细胞分泌的促血管新生因子的影响有关;②抑制微管蛋白聚合;③抑制有丝分裂和诱导凋亡;④可以减少超氧化物歧化酶活性,发挥抗肿瘤作用。并且2-ME在多种荷瘤动物模型实验中表现出显著的抑制肿瘤生长的作用,其中包括 Meth-A 肉瘤、非雌激素依赖的( MDA-MB-435)乳腺癌、宫颈癌多发性骨髓瘤和HCT-116裸鼠的移植瘤模型[6] 。在小鼠的乳腺癌动物模型中,2-ME体内抗肿瘤活性被加以评估,用2-ME每天100 mg/kg联合环磷酰胺腹膜途径给药,持续21 d,结果抑瘤率达82%[7]。但迄今为止,国内外2-ME对MM体内外抑瘤效果的研究报道很少。
本研究结果显示:在2-ME药物治疗组的小鼠MM瘤体的平均质量和体积较Nacl组瘤体明显减小,差异均有统计学意义,表明2-ME能够抑制小鼠黑色素移植瘤的生长;2-ME处理组小鼠肝、脾、肺组织结构清晰,染色均一,而Nacl组3/6出现了肺组织的转移,这说明2-M对小鼠可能不存在潜在的毒性作用,且可抑制MM的转移。
人类C-myc为原癌基因,定位于第8染色体q24上,其结构包括3个外显子和2个内含子,该基因表达的蛋白定位于细胞核内,是细胞增殖、分化和凋亡的重要调节因子[8]。由于C-myc具有促进细胞增殖和抑制分化的作用,C-myc的异常表达有促使细胞恶性转化的潜能。既往的研究中发现,C-myc蛋白在多种人类癌症细胞中都存在过度的表达,与肿瘤的发生发展有关[9]。本研究结果显示,与Nacl组相比,2-ME处理组的蛋白表达水平明显下降。提示2-ME能够通过降低C-myc的表达水平达到抑制肿瘤细胞的增殖的目的。具体的调控机制仍不明确,需进一步实验研究验证。
Gadd45b属于生长阻滞和DNA损伤诱生蛋白45基因家族,该基因家族是在研究肿瘤发生、发展以及转归过程中新发现的基因家族,属于抑癌基因p53和BRCA1的下游靶基因。其基因编码的蛋白是抑制细胞生长和细胞凋亡过程中的重要介导者, 具有调控细胞的增生、监测细胞周期、诱导细胞凋亡、调节控制细胞的负性生长等DNA损伤修复途径相关的功能[10]。Gadd45b表达或功能异常导致p53介导的DNA损伤修复途径异常或阻断,而既往研究表明p53蛋白分布与黑素瘤病理学类型、病理分级和分期、淋巴结转移以及预后相关[11],而且Gadd45b参与了NF-κB和C-Jun氨基末端激酶之间的通路, 它通过抑制JNK通路抑制细胞凋亡[12]。 本研究结果发现Gadd45b表达水平在应用2-ME后较Nacl组有明显升高,进而使Gadd45b发挥其抑制细胞增殖的作用,促使癌细胞凋亡。
综上所述,2-ME对小鼠黑素瘤种植性肿瘤的治疗有效,并且Gadd45b及C-myc基因在肿瘤形成的过程中发挥了重要作用,但其具体作用机制尚不明确,需要进一步探讨,以便尽早为MM的治疗提供新的治疗思路和方法。(本文图见封三)
[参考文献]
[1] Okwan-Duodu D,Pollack BP,Lawson D,et al. Role of radiation therapy as immune activator in the era of modern immunotherapy for metastatic malignant melanoma[J]. Am J Clin Oncol,2015,38(1):119-125.
[2] 李薇薇,涂平,汪吻,等.皮肤黑素瘤70例临床与病理特征分析[J].中国皮肤性病学杂志,2012,26(4): 312-314.
[3] 胡彩霞,赵连梅,张国强,等.2-甲氧基雌二醇对恶性黑素瘤B16细胞株增殖与凋亡的影响[J].中华皮肤科杂志,2015,48(3):166-170.
[4] Visagie MH,Joubert AM. 2-Methoxyestradiol-bis-sulphamate refrains from inducing apoptosis and autophagy in a non-tumorigenic breast cell line[J]. Cancer Cell Int,2012,12(1):37.
[5] Kuo KL,Lin WC,Ho IL,et al. 2-methoxyestradiol induces mitotic arrest,apoptosis,and synergistic cytotoxicity with arsenic trioxide in human urothelial carcinoma cells[J]. PLoS One,2013,8(8):e68703.
[6] Ehteda A,Galettis P,Pillai K,et al. Combination of albendazole and 2-methoxyestradiol significantly improves the survival of HCT-116 tumor-bearing nude mice[J]. BMC Cancer,2013,13:86.
[7] 刘红光,赵茂勋,康颖,等.2-甲氧基雌二醇联合环磷酰胺对小鼠晚期乳腺癌模型的抑瘤作用[J].中国医院用药评价与分析,2014,14(5):390-393.
[8] 石栋梁,杜涛,习国平.应用流式细胞术检测EphA2及其调节基因HoxA1、C-myc在喉癌组织中的表达及相互关系[J].河北医科大学学报,2013,34(3):294-297.
[9] Li FL,Deng H,Wang HW,et al. Effects of external application of Chinese medicine on diabetic ulcers and the expressions of β-catenin,c-myc and K6[J]. Chin J Integr Med,2011,17(4):261-266 .
[10] Tamura RE,de Vasconcellos JF,Sarkar D,et al. GADD45 proteins: central players in tumorigenesis[J]. Curr Mol Med,2012,12(5):634-651.
[11] 吴斌,彭春.突变型P53蛋白在皮肤黑素瘤中的检测及临床意义[J].中国皮肤性病学杂志,2012,26(9):779-781.
[12] Salerno DM,Tront JS,Hoffman B,et al. Gadd45a and Gadd45b modulate innate immune functions of granulocytes and macrophages by differential regulation of p38 and JNK signaling[J]. J Cell Physiol,2012,227(11):3613-3620.
(本文编辑:刘斯静)
HU Cai-xia1, JIANG Shao-qian1, ZHANG Guo-qiang1,FENG Jia2, TIAN Fei3, GAO Shun-qiang1*
(1.Department of Dermatology, the Forth Hospital of Hebei Medical University, Shijiazhuang050011, China; 2.Department of Gastroenterology, the Bethune International Peace Hospital,Shijiazhuang 050082, China;3.Department of Dermatology, the People,s Hospital of Xingtai City, Hebei Province, Xingtai 054000, China)
[Abstract] Objective To study the inhibition effects of 2-methoxyestradiol(2-ME) on malignant melanoma(MM) cells in BALB/c mice xenograft tumor.Methods The inhibition effects of 2-ME on MM cells were measured by 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT). Building BALB/c mice xenograft tumor model, BALB/c mice were divided into three groups with six mice in each group. Treatment group and negative control group were treated with 2-ME(50 mg/kg) and equally volume normal saline respectively every two days, for a 14-days duration and calculated the average volume every three days. Positive drug group were treated with CTX(20 mg/kg). After experiment ended, the tumor weight were calculated. The expression levels of C-myc and Gadd45b in tumor were detected by immunohistochemical. Morphological changes of tumor tissue, lung, liver and spleen tissues were observed by HE staining. Results 2-ME had obvious inhibitory effect on melanoma cells and the inhibitory effect in a dose-time dependent manner. Compared with the Nacl group, the volume and weight of tumor tissues in CTX group and 2-ME group were reduced remarkably(P<0.01), but there was no statistical signifieance between the CTX group and the 2-ME group(P>0.05). Comparing to control group, the expression levels of C-myc were decreased, while Gadd45b were increased. No obvious morphological changes were found in liver and spleen tissues in treatment group and in control group, but there were lung metastasis in 3 of 6 mice. Conclusion 2-ME had inhibitory effect on BALB/c mice xenograft tumor, and the mechanism may be related to modulating gadd45b and C-myc genes expression.
[Key words] nevi and melanomas; estradiol; mice
[中图分类号] R739.5
[文献标志码] A
[文章编号] 1007-3205(2016)03-0289-05
[作者简介]河北省医学科学研究重点课题(20130252) 胡彩霞(1982-),女,河北衡水人,河北医科大学第四医院主治医师,医学硕士,从事黑素瘤诊治及激光美容研究。*通讯作者。E-mail:gshunqiang@medmail.com.cn
[收稿日期]2015-07-02;[修回日期]2015-09-25