·论 著·
贾 蓓1,刘建宁2*,张 岁1,马文波1,柳立平1
(1.河北医科大学第一医院肝病中心,河北 石家庄 050031;2. 河北医科大学第三医院骨科,河北 石家庄 050051)
[摘要] 目的观察树突状细胞-细胞因子诱导杀伤细胞(dendritic cell-cytokine induced killer cell,DC-CIK) 治疗对原发性肝癌患者体内免疫平衡的影响及临床疗效。方法选取原发性肝癌患者30例为观察组,在采用常规保肝治疗的同时联合DC-CIK免疫治疗方法;另选择健康志愿者26例为对照组。比较2组T细胞亚群、Th1/Th2细胞因子水平。比较观察组治疗前后肝、肾功能及甲胎蛋白的水平变化,并评价其生活质量。结果治疗后观察组外周血CD3+、CD4+、CD3+CD56+细胞比率显著高于治疗前(P<0.05),CD8+、CD4+/CD8+比值与治疗前差异无统计学意义(P>0.05);治疗后观察组外周血CD3+、CD4+、CD8+、CD3+CD56+、CD4+/CD8+与对照组差异均无统计学意义(P>0.05)。治疗后观察组外周血中白细胞介素2(interleukin,IL-2)、γ干扰素高于治疗前,但低于对照组,IL-4低于治疗前,但高于对照组(P<0.05);治疗前后2组IL-10差异均无统计学意义(P>0.05)。观察组肝、肾功能指标治疗前后差异无统计学意义(P>0.05),治疗后甲胎蛋白水平较治疗前明显降低(P<0.05)。评估观察组生活质量,其中提高19例,稳定6例,下降5例,总提高率为63.3%(19/30)。结论DC-CIK免疫治疗可以有效提高临床疗效,改善机体的免疫平衡状态,增强机体的免疫功能,提高患者的带瘤生存率,值得临床推广应用。
[关键词] 肝肿瘤;细胞因子诱导杀伤细胞;免疫功能
doi:10.3969/j.issn.1007-3205.2016.04.017
近年来随着细胞免疫学和分子生物学的发展,恶性肿瘤的免疫治疗已经在临床上广泛应用,并取得了一定疗效。生物免疫治疗是在肿瘤免疫学科和生物工程技术迅猛发展下催生的一种全新的肿瘤治疗方法,其从体外补充、诱导、活化机体的免疫调节系统,调动细胞活性因子,调整各种免疫性杀伤反应,主要通过调动宿主的天然防御机制或给予机体某种物质来取得抗肿瘤效应,即通过使用一些生物反应调节剂来增强机体抵抗力,从而达到杀灭和抑制肿瘤生长的目的。机体免疫功能低下或免疫耐受状态、或抗原递呈细胞的功能降低等多因素,使肿瘤细胞逃避机体的免疫系统攻击,是目前肿瘤形成的重要机制。应用单一的手术治疗方法仅能消除肉眼可见的瘤体,而大量进入血液循环的肿瘤细胞才是肿瘤早期转移以及肿瘤复发的关键因素,因此单一手术治疗效果并不理想。树突状细胞-细胞因子诱导杀伤细胞(dendritic cell-cytokine induced killer cell,DC-CIK)是目前临床上应用的高效活化肿瘤特异性T细胞,能有效攻击肿瘤细胞[1]。原发性肝癌属于临床常见病,具有较高的临床发病率,可严重影响患者的健康状态[1-3],是严重威胁人类健康的主要疾病之一,也是癌症死亡的主要原因[4]。本研究应用DC-CIK治疗中晚期原发性肝癌患者,取得了较好的疗效,现报告如下。
1.1 一般资料 选取2013年1月—2015年1月河北医科大学第一医院经病理及临床检查确诊为原发性肝癌患者30例(观察组),其中男性24例,女性6例,年龄35~74岁,平均(62.35±3.53)岁;结节型肝癌13例,块状型肝癌11例,弥漫型肝癌4例,小肝癌2例;单发病灶18例,多发病灶12例;肿瘤直径4~13 cm,平均(7.75±1.22) cm。纳入标准:①年龄>18岁,肝功能Child-Pugh分级A或B级;②无手术指征的肝癌患者或肝癌术后需要辅助介入治疗的患者;③预计生存期超过半年,并且签署DC-CIK治疗知情同意书;④外周血白细胞计数>3.0×109/L。排除标准:①过敏体质者或有严重的过敏史;②全身衰竭、生命体征不正常以及不能配合检查者;③全身感染或者局部严重感染需要进行抗感染治疗者;④合并多器官功能障碍者(心、脑、肺、肾、肝等);⑤传染性疾病(如艾滋病、梅毒、活动性结核等);⑥严重自身免疫性疾病患者;⑦严重凝血机制障碍。选取门诊健康志愿者26例为对照组,男性19例,女性7例,年龄28~71岁,平均(60.52±4.43)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
所有肝癌患者均采用常规性治疗措施(保肝等对症支持治疗),同时给予DC-CIK免疫治疗。
本研究经过医院伦理委员会批准,患者或其授权家属均签署DC-CIK免疫治疗知情同意书。
1.2 DC-CIK制备
1.2.1 外周血单个核细胞分离 将原发性肝癌患者抗凝外周全血100 mL经淋巴细胞分离液梯度离心处理(500 g×10 min)后,取界面层单个核细胞(peripheral blood mononuclear cell,PBMC),经离心洗涤后其细胞数为(1~3)×107,留取备用。
1.2.2 CIK培养 用AIM-V无血清培养基调整细胞浓度为(4~6)×106/mL,置于37 ℃、5%的CO2中培养2 h。收集非贴壁细胞,用含AIM-V培养基调整细胞浓度约为(2~3)×106/mL,加入γ干扰素(interferon-γ,IFN-γ)1 000 U/mL,24 h后加入重组白细胞介素2(interleukin,IL-2) 1 000 U/mL,CD3McAb 50 μg/L,IL-1 100 U/mL,观察细胞的生长情况、计数并补充培养基。
1.2.3 CD细胞培养 在CIK制备过程中收获的贴壁PBMC中加入AIM-V培养基含粒细胞-巨噬细胞集落刺激因子 (granulocyte-macrophage colony-stimulating factor,GM-CSF)1 000 U/mL和重组IL-4 1 000 U/mL,置于37 ℃、5% 的CO2中培养,第3天半量补充含上述浓度细胞因子的AIM-V培养基;第5天加入肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)1 000 U/mL促进细胞成熟。
1.2.4 成熟DC、CIK共培养 将培养得到的成熟DC按1∶10的比例加入CIK培养液中,共培养7~9 d。隔天换液1次,同时补充细胞因子。
1.3 细胞回输 在细胞培养结束前取样进行无菌实验检测,细菌、真菌和支原体检测合格后,再收集细胞,锥虫蓝染色检测细胞活力应在80%以上,同时进行流式细胞分析。在患者回输细胞前留取培养液用丫啶橙染色或革兰染色,再追加1次污染检测。此外还要对每一批细胞最终制剂留样检测。DC-CIK分2~4次进行外周静脉连续回输,输注1次/d,细胞总数均>109。每3次为1个疗程,根据病情进行3~6个疗程。回输后2~3 h内密切观察患者有无发烧、过敏反应等不良反应。
1.4 外周血T细胞亚群检测 患者治疗前和治疗后4个疗程后采外周抗凝血,应用流式细胞仪检测T细胞亚群,CD3+、CD4+、CD8+、CD3+CD56+ 、CD4+/CD8+及Th1/Th2细胞因子水平,评价患者的免疫功能。
1.5 安全性评价
1.5.1 临床疗效 随访患者治疗后3个月甲胎蛋白及肝功能指标(丙氨酸转氨酶、天冬氨酸转氨酶)变化。
1.5.2 不良反应观察 静脉回输过程中及回输后24 h内密切观察患者的各种反应,包括精神状态变化,食欲及睡眠状况改变,是否出现发热、恶心、呕吐、腹痛、皮疹、乏力、肌肉酸痛等不良反应。
1.5.3 生活质量评估 参考卡氏功能状态评分及疼痛程度、食欲等的改变来评估生活质量的改善。治疗后卡氏功能状态评分比治疗前提高>10分为改善,提高或下降在10分以内为稳定,下降>10分为恶化;总提高率=(改善+稳定)/总例数×100%。
1.5.4 肿瘤进展和生存观察 评估3个月、6个月、1年的生存率。
1.6 统计学方法 应用SPSS 18.0统计学软件进行数据处理。计量资料以![]() ±s表示,多组间比较采用单因素方差分析,两两比较采用q检验,治疗前后比较采用配对t检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,两两比较采用q检验,治疗前后比较采用配对t检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2.1 2组治疗前后T细胞亚群水平比较 治疗前观察组外周血CD3+、CD4+、CD3+CD56+、CD4+/CD8+均低于对照组(P<0.05),CD8+与对照组比较差异无统计学意义(P>0.05)。治疗后观察组外周血CD3+、CD4+、CD3+CD56+细胞比率均显著高于治疗前(P<0.05),CD8+、CD4+/CD8+与治疗前差异均无统计学意义(P>0.05);治疗后观察组外周血CD3+、CD4+、CD8+、CD3+CD56+、CD4+/CD8+与对照组差异均无统计学意义(P>0.05)。见表1。
表1 2组治疗前后T细胞亚群水平比较
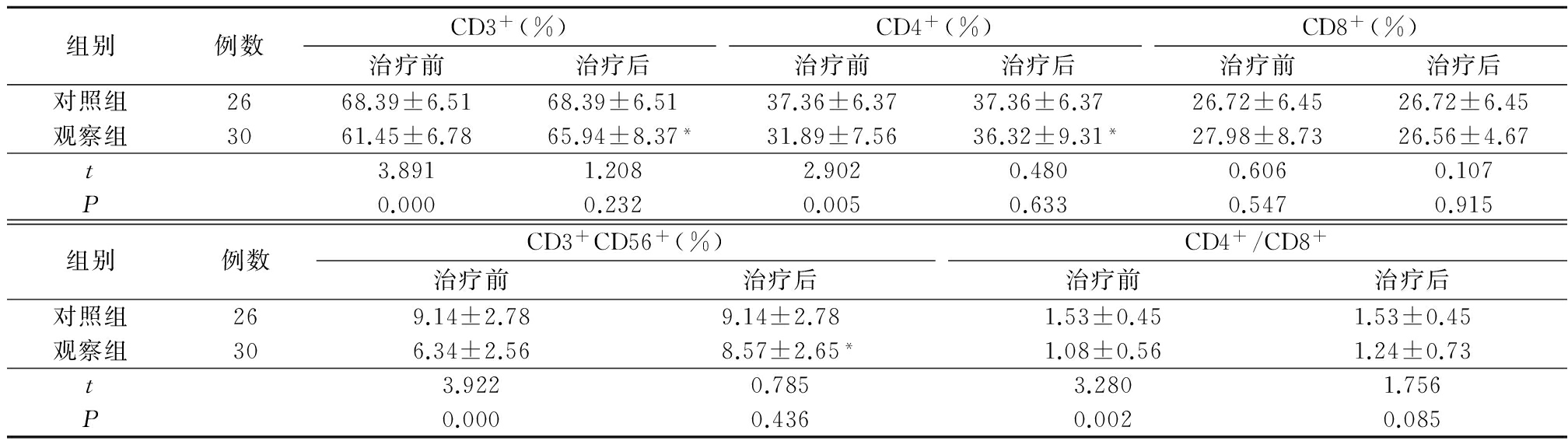
*P<0.05与治疗前比较(配对t检验)
2.2 2组治疗前后细胞因子水平比较 治疗前观察组外周血中IL-2、IFN-γ低于对照组,IL-4高于对照组,差异有统计学意义(P<0.05)。治疗后观察组外周血中IL-2、IFN-γ高于治疗前,但低于对照组,IL-4低于治疗前,但高于对照组,差异有统计学意义(P<0.05);治疗前后2组IL-10差异均无统计学意义(P>0.05)。见表2。
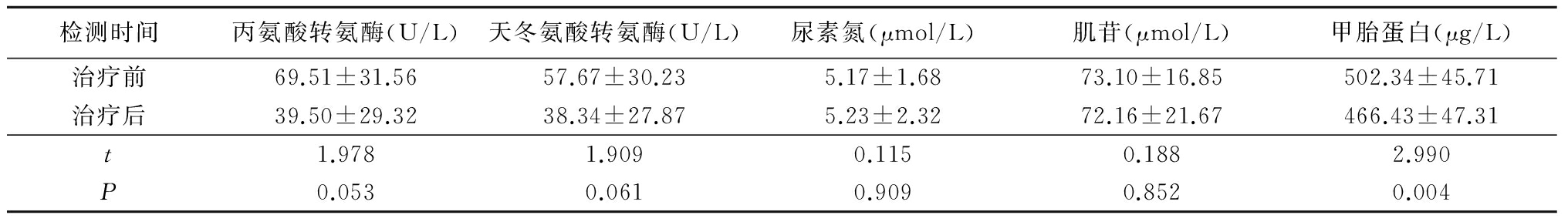
2.3 观察组治疗前后肝、肾功能及甲胎蛋白水平比较 观察组肝、肾功能指标治疗前后差异无统计学意义(P>0.05);甲胎蛋白水平较治疗前明显降低,差异有统计学意义(P<0.05)。见表3。
表2 2组治疗前后细胞因子水平比较
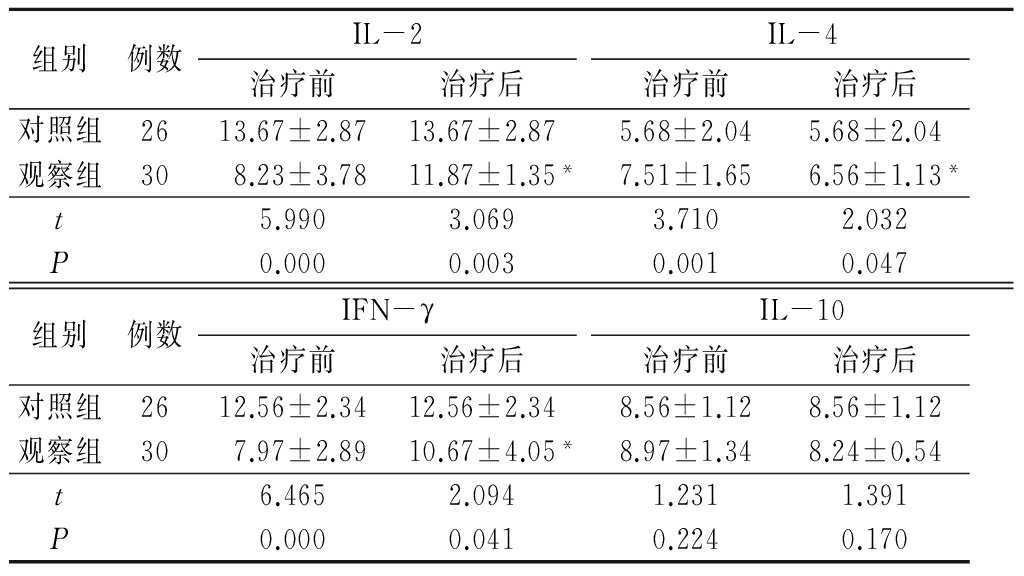
*P<0.05与治疗前比较(配对t检验)
表3 观察组治疗前后肝、肾功能及甲胎蛋白水平比较
2.4 不良反应观察 多数患者安全无不良反应,3例患者细胞回输后6 h内出现体温升高,但均未超过38 ℃,无明显寒战、恶心、呕吐等不适,给予临床观察,适量饮水休息后体温逐渐恢复正常。1例体温超过38 ℃,给予退热药物治疗后体温恢复正常。余患者均未出现严重不良反应。
2.5 生活质量评价 生活质量提高者19例,稳定者6例,下降者5例,总提高率为63.3%(19/30);患者乏力、食欲不振、周身不适、精神状态等临床症状明显改善;疼痛评分无明显改善,治疗前有6例患者出现轻-中度疼痛(疼痛评分3~5分),治疗后仍未见明显缓解。
2.6 生存期和肿瘤进展 3个月、6个月随访无1例患者死亡。1年随访时有1例患者因消化道出血死亡。1例患者出现肝外转移,3例患者出现肝内转移,其中3例因并发肝肾综合征及肝衰竭死亡,目前1例尚生存。共4例患者死亡。1年生存率为86.7%(26/30)。
原发性肝癌发病隐匿,一旦临床诊断,多处于中晚期,因此有效安全的综合治疗是延缓疾病进展、延长患者生存期的重要策略[5]。生物免疫治疗现已成为肿瘤治疗的一种主要手段,近几年开展的生物免疫治疗已经广泛用于肿瘤术后以及与放化疗结合,对于减少肿瘤的术后复发、提高患者的免疫功能均已显示出其独特作用。DC、DIK共同培养后繁殖速度明显增快,细胞活性强大,具有明显的协同抗肿瘤作用,杀瘤谱广,可选择性地杀伤肿瘤细胞,并且对正常细胞没有毒性作用,临床应用时细胞毒性较小及不良反应轻微,仅发现有发热、乏力等类似流感样的不良反应,机体免疫力明显提高,激活机体全身性抗癌效应,对原发性肿瘤、转移性肿瘤均有一定疗效。DC其未成熟时迁徙能力强大,成熟后可以激活T淋巴细胞,为目前机体内最强大的抗原递呈细胞,可以有效地摄取、加工、递呈抗原,参与机体免疫应答过程。CIK抗肿瘤作用机制如下:①自然杀伤作用,CIK的胞质颗粒可以直接穿透肿瘤细胞膜,裂解其肿瘤细胞;②CIK可以增强T淋巴细胞的功能,进而进一步激活机体的免疫功能[6];③CIK还可以活化白细胞介素等多种抗肿瘤细胞的因子[7]。CIK具有非限制性细胞毒性作用,可以强而有效地分解肿瘤细胞。近年来随着医疗技术的发展,肝癌患者总体治疗效果有了显著性提高,但术后复发与合并失代偿性肝硬化等问题仍严重影响着患者的预后[8]。研究证明抗肿瘤免疫与患者预后关系密切[9]。加强全身抗肿瘤免疫反应可降低肝癌治疗后肿瘤复发,改善患者的预后[10]。
肝癌患者大多自身免疫系统严重失衡,存在细胞免疫抑制现象,主要表现为CD3+ 、CD4+、CD4+/CD8+细胞水平降低,CD8+细胞水平升高,符合肿瘤的免疫逃避机制[11]。本研究结果与之相符,说明肿瘤细胞本身可以分泌免疫抑制物质,降低机体对其的应答效应,从而有利于肿瘤细胞生长和迁移。CIK是患者外周血单个核细胞体外经过多种细胞因子的共同诱导而获取的一群以CD3+ 、CD8+和CD3+、CD56+为主的异质细胞群,其具有T淋巴细胞的强大抗瘤活性以及自然杀伤细胞非限制性杀瘤作用,在体内外繁殖能力强,是一种杀瘤活性和杀瘤谱更强大的新型抗肿瘤效应细胞。DC、CIK共培养后,CIK中CD3+、CD8+、CD3+/CD56+比例明显增高,说明大量成熟DC促进CIK的成熟。本研究进一步分析其对T细胞亚群的影响,结果发现治疗后患者外周血CD3+、CD4+、CD3+CD56+细胞比率显著高于治疗前(P<0.05),CD4+/CD8+比值(有升高趋势)、CD8+与治疗前比较差异无统计学意义(P>0.05)。可见DC-CIK免疫治疗后,患者自身的免疫功能具有一定的升高趋势,但其免疫状态仍然处于低水平。DC-CIK免疫治疗在有效抵抗肿瘤的同时,能有效地刺激T细胞亚群的繁殖,加强机体的免疫功能,更加有效发挥CIK的杀瘤作用。
近几年研究表明,IFN-γ、IL-2属于Th1类细胞,特点是增强机体本身细胞免疫功能,IL-4、IL-10属于Th2类细胞,特点是参与机体的体液免疫[12]。Th1类细胞有较强的肿瘤杀伤作用[13],而Th2类细胞在大多数恶性肿瘤患者体内比例明显升高,免疫失衡状态较为严重。Th1/Th2免疫失衡与肿瘤免疫的关系密切相关[14],正常情况下Th1/Th2处于相对平衡状态,当Th2类细胞因子高表达、Th1类细胞因子低表达时,促进肿瘤进展。本研究结果显示,治疗后患者IFN-γ水平较治疗前上升,而IL-4水平下降(P<0.05)。表明DC-CIK治疗可以纠正Th1/Th2免疫失衡,提高患者免疫功能,提示机体免疫功能向Th1方向发展,有利于更好地发挥抗肿瘤作用。
DC-CIK免疫治疗取得了良好的临床疗效,与治疗有关的严重不良反应未见报道,但一些轻微的不良反应却时有报道,需引起重视。本研究中有4例患者出现不同程度发热,但体温一般不会超过38 ℃,持续2~6 h,休息、饮水后体温可自行恢复正常。可能与大量细胞进入体内,刺激分泌大量细胞因子,机体免疫状态失衡有关,需要一段时间才能重新恢复平衡,过程中可能会出现发热、乏力等的现象,均为正常反应。
综上所述,DC-CIK免疫疗法,作为恶性肿瘤的一种辅助治疗方法,其不良反应较轻微,患者治疗过程中的耐受性好,大大提高了患者“带瘤生存”的生活质量,改善其临床症状。但是目前CIK的抗肿瘤作用机制、影响DC-CIK增殖的因素、体内分布情况及确切临床疗效的评价等问题仍有待于进一步研究。如何解决肿瘤患者体内免疫抑制的状态,使DC-CIK发挥更好的抗肿瘤作用也需要临床工作者深入探讨。
[参考文献]
[1]Shen A,Zhang H,Tang C,et al. Systematic review of radiofrequency ablation versus percutaneous ethanol injection for small hepatocellular carcinoma up to 3 cm[J]. J Gastroenterol Hepatol,2013,28(5):793-800.
[2]孟娟,彭大为,王美清,等.自体DC-CIK联合肝动脉栓塞治疗中晚期原发性肝癌的疗效观察[J].浙江临床医学,2013,15(8):1146-1148.
[3]尤振宇,苏晓辉,刘洋.DC-CIK生物治疗联合肝动脉灌注化疗治疗肝癌的短期临床观察[J].河北医药,2013,35(11):1626-1628.
[4]Siegel R,Ma J,Zou Z,et al. Cancer statistics,2014[J]. CA Cancer J Clin,2014,64(1):9-29.
[5]杜静华,张艳,任伟光,等.斑蝥酸钠维生素B6联合经皮肝动脉化疗栓塞对原发性肝癌患者血清sFasL/sFas的影响[J].临床荟萃,2012,27(3):213-216.
[6]Shi SB,Ma TH,Li CH,Tang XY. Effect of maintenance therapy with dendritic cells:cytokine-induced killer cells in patients with advanced non-small cell lung cancer[J]. Tumori,2012,98(3):314-319.
[7]Lin G,Wang J,Lao X,et al. Interleukin-6 inhibits regulatory T cells and improves the proliferation and cytotoxic activity of cytokine-induced killer cells [J]. J Immunother,2012,35(4):337-343.
[8]Abouaf L,Girard N,Lefort T,et al.Standard-fractionated radiotherapy for optic nerve sheath meningioma:visual outcome is predicted by mean eye dose[J]. Int J Radiat Oncol Biol Phys,2012,82(3):1268-1277.
[9]邓武坚,陈锦武,罗颖嘉,等.微创治疗联合自体CIK细胞输注对肝癌的疗效及安全性研究[J].岭南现代临床外科,2013,13(1):29-31.
[10]Lauvau G,Chorro L,Spaulding E,et al.Inflammatory monocyte effector mechanisms[J]. Cell Immunol,2014,291(1/2):32-40.
[11]陈派强.外周血T细胞亚群检测在恶性肿瘤中的价值[J].医药论坛杂志,2012,33(4):118-119.
[12]赵学涛,杨从容,任晓亮,等.红细胞输注对肝癌患者CD4+T辅助细胞免疫功能的影响[J].河北医科大学学报,2015,36(7):803-806.
[13]张付杰,姜德清.白细胞介素18在原发性肝癌的临床研究价值[J].中华全科医学,2012,10(6):938-940.
[14]Talaat RM,Mohamed SF,Bassyouni IH,et al.Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus(SLE) patients:correlation with disease activity[J]. Cytokine,2015,72(2):146-153.
(本文编辑:赵丽洁)
[收稿日期]2015-12-04;[修回日期]2015-12-28
[基金项目]河北省医学科学研究重点课题(ZD20140346)
[作者简介]贾蓓(1980-),女,河北石家庄人,河北医科大学第一医院主治医师,医学硕士,从事肝脏疾病诊治研究。
[中图分类号] R735.7
[文献标志码] B
[文章编号] 1007-3205(2016)04-0440-05
*通讯作者。E-mail:ljn790527@126.com