·论 著·
薛 锋,薛明明*,张 琪,辛 雪
(内蒙古医科大学基础医学院生理学教研室,内蒙古 呼和浩特 010059)
[中图分类号] R363.1
[文献标志码] A
[文章编号] 1007-3205(2016)07-0749-05
XUE Feng, XUE Ming-ming*, ZHANG Qi, XIN Xue
(Department of Physiology, Basic Medical College, Inner Mongolia Medical university, Hohhot 010059, China)
[Abstract]Objective To explore the effect of celecoxib on the relationship between tumor necrosis factor-α(TNF-α) and apoptosis in pressure overload induced myocardial hypertrophy in rat. Methods Male Wister rats were divided into sham 2 weeks group, sham 4 weeks group, model 2 weeks group, model 4 weeks group, model plus celecoxib 2 weeks group and model plus celecoxib 4 weeks group in randomized order. The animal model was established by constriction of abdominal aorta. Left ventricular tissue sections were observed under light microscope. The contents of inflammatory cytokines TNF-α in plasma and tissue were examined by ELISA. TUNEL method was performed to detect the apoptosis of left ventricular myocardial cells. Results ①Left ventricle HE staining showed that the myocardial cell hypertrophy and shape were irregular, myocardial hypertrophy was significantly heavier in model group, compared with control group. Celecoxib can gradually reduce myocardial hypertrophy. ②TNF-α levels in plasma were no significant differences between 2 weeks and 4 weeks groups(P>0.05). In the myocardial tissue, the content of TNF-α in model 2 weeks group were significantly increased(P<0.05). Celecoxib can reduce the the content of TNF-α levels (P<0.05). At 4 weeks, the differences were not statistically significant(P>0.05). ③Compared with the control group, the apoptosis rate of myocardial cells in model group and celecoxib group were significantly increased(P<0.05), and celecoxib treatment can significantly decrease the apoptosis of myocardial hypertrophy in rats(P<0.05). Conclusion Celecoxib in the treatment of myocardial hypertrophy in rats may be related to the TNF-αand apoptosis of myocardial cells.
[Key words] cardiac hypertrophy; celecoxib; tumor necrosis factor-alpha
[摘要] 目的探讨塞来昔布对压力超负荷性心肌肥厚大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)与心肌细胞凋亡之间的关系。方法将雄性Wister大鼠随机分为假手术2周组、假手术4周组、模型2周组、模型4周组、模型+塞来昔布2周组及模型+塞来昔布4周组。模型组进行腹主动脉缩窄手术,光镜下观察左心室组织切片、ELISA法检测血浆及心肌组织中的TNF-α、TUNEL法检测左心室心肌细胞的凋亡情况。结果①左心室HE染色结果显示,模型组与假手术组相比,心肌细胞发生肥大且形态不规则,心肌肥厚程度明显加重,塞来昔布用药后可以逐渐缓解心肌肥厚。②在血浆中,各组大鼠2周和4周TNF-α含量差异无统计学意义(P>0.05);在心肌组织中,模型2周组大鼠的TNF-α含量显著升高(P<0.05),塞来昔布用药后可以降低TNF-α含量(P<0.05);4周时差异均无统计学意义(P>0.05)。③与假手术组比,模型组和塞来昔布组心肌细胞凋亡率显著升高(P<0.05),而塞来昔布用药后可以使心肌肥厚大鼠的凋亡率显著下降(P<0.05)。结论塞来昔布治疗心肌肥厚大鼠可能与炎症因子TNF-α和心肌细胞凋亡有关。
[关键词] 心肌肥厚;塞来昔布;肿瘤坏死因子α
doi:10.3969/j.issn.1007-3205.2016.07.002
心肌肥厚是多种化学因素、机械牵张(压力负荷、容量负荷等)的初始因素诱导下,由各种神经体液因素参与,血流动力学改变引起的心室结构及功能的改变[1]。研究表明,特异性环氧化酶2(cyclooxygenase 2,COX-2)抑制剂不仅可以缓解压力超负荷诱导的左心室肥大、降低动物病死率,还能缓解收缩功能障碍[2-3]。非甾体抗炎药是一类具有抗炎与镇痛作用的非处方药,特异性COX-2抑制剂塞来昔布是其中的一种。本研究分析心肌肥厚中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)与心肌细胞凋亡的关系,旨在探讨塞来昔布对心肌肥厚大鼠影响的可能机制,报告如下。
1.1 实验动物与主要试剂 清洁级健康10周龄雄性Wister大鼠60只,体质量(230±20) g,由内蒙古大学实验动物中心提供。 将60只Wister大鼠适应性饲养1周后,按体质量大小随机分为假手术组20只和实验组40只,实验组行腹主动脉缩窄术造成压力超负荷型心肌肥厚大鼠模型,术后4周确定造模成功后,将实验组随机分为模型组和模型+塞来昔布组(以下简称塞来昔布组)。以上3组均按时间随机分为2周组和4周组。
戊巴比妥钠(上海哈灵生物),塞来昔布胶囊(美国辉瑞公司),苏木精、伊红、TNF-α ELISA试剂盒(北京宝盈同汇有限公司),DeadEnd Colorimetric TUNEL System(Promega公司)。
1.2 方法 按照Anverson[4]方法制造压力超负荷性心肌肥厚大鼠模型,术后4周确定造模成功后开始灌胃给药:模型组生理盐水安慰剂灌胃20 mL·kg-1·d-1每只,2周组持续灌胃2周,4周组灌胃4周;塞来昔布组塞来昔布灌胃20 mL·kg-1·d-1每只,2周组持续灌胃2周,4周组灌胃4周。10%中性福尔马林固定24 h,将固定后的左心室修成5 mm×5 mm×3 mm的小块,脱水透明包埋修蜡切片,将石蜡切片依次放入二甲苯进行脱蜡,梯度酒精水化,苏木精染缸中染色3 min。1%盐酸乙醇分化10 s,1%伊红染缸中染色5 s,自来水冲洗2 s后梯度脱水,中性树胶封片,通过普通光学显微镜观察各组大鼠心肌组织的形态结构变化。
1.3 ELISA法检测TNF-α的含量 组织匀浆后将TNF-α标准品的稀释浓度分别为240、160、80、40、20 ng/L,检测心肌组织中各组大鼠不同时间点血浆及心肌组织中TNF-α含量。
1.4 TUNEL法检测心肌细胞凋亡 大鼠采血后断头处死,快速开胸摘出心脏,预冷生理盐水清洗,滤纸吸干,尽量避免挤压心脏,称质量。去除心房,沿室间隔减去右心室,预冷生理盐水清洗后滤纸吸干,沿左心室长轴取一半心肌组织,10%中性福尔马林固定后制成石蜡切片,TUNEL法检测左心室心肌细胞凋亡情况。
1.5 统计学方法 应用SPSS13.0统计软件进行数据分析,计量资料比较分别采用F检验和SNK-q检验。P<0.05为差异有统计学意义。
2.1 HE染色结果 光镜下观察,假手术2周组大鼠心室肌细胞排列整齐,间隙较小,细胞大小均匀,边缘清楚,胞浆染色均匀,胞核大小均一;模型2周组大鼠心肌细胞排列紊乱,间隙明显变大,心肌细胞发生肥大,形态不规则,单位面积视野下心肌细胞数量显著变少,胞浆出现深染,胞核偶见增大;塞来昔布2周组较模型2周组比,心肌细胞明显变小,间隙明显变窄,细胞形态稍见规则(图1)。模型4周组心肌肥厚程度更加明显,心肌细胞不断肥大,形态更加不规则,胞浆与胞核比例显著增大,胞核偶见增大;塞来昔布用药后4周,心肌细胞排列较规则,细胞明显变小,边缘较清晰(图2)。
2.2 大鼠炎症因子TNF-α的变化 各组大鼠2周和4周时血浆中TNF-α含量差异无统计学意义(P>0.05)。心肌组织中2周时模型组和塞来昔布组TNF-α含量显著高于假手术组,而塞来昔布组低于模型组心肌组织中的TNF-α含量,差异有统计学意义(P<0.05);4周时差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠不同时间点血浆及心肌组织中TNF-α含量比较
Table 1 Changes of TNF- α in plasma and myocardium of rats at different time points![]()
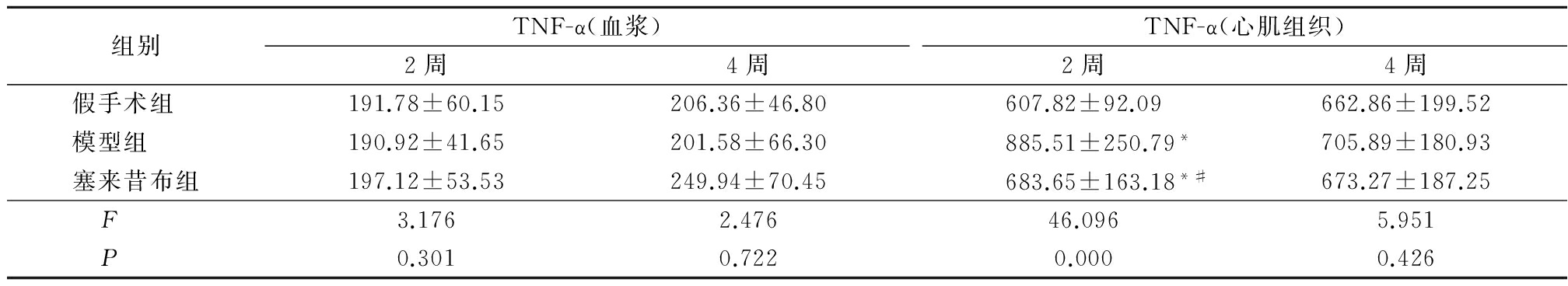
*P<0.05与假手术组比较 #P<0.05与模型组比较(SNK-q检验)
2.3 大鼠心肌细胞凋亡率比较 与假手术组比,模型组和塞来昔布组心肌细胞凋亡率显著升高(P<0.05),而且塞来昔布用药后可以使心肌肥厚大鼠的凋亡率显著下降(P<0.05),见表2。
2周与4周各组大鼠心肌细胞凋亡情况,见图3,4。
表2 各组大鼠不同时间点心肌细胞凋亡率比较
Table 2 Apoptosis rate of rat myocardial cell at different time points between groups![]()
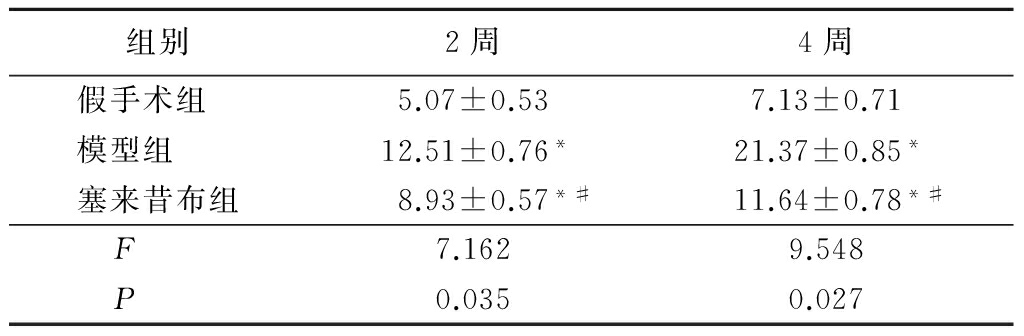
*P<0.05与假手术组比较 #P<0.05与模型组比较(SNK-q检验)
3.1 心肌肥厚大鼠造膜成功以及塞来昔布对心肌组织病理形态的影响 心肌肥厚是心脏对压力、容量等超负荷的异常应激反应,属于心脏的一种慢性代偿机制。心肌肥厚是由体内多种神经体液因素介导、多条细胞信号传导途径参与、基因表达调控的一个复杂的病理生理过程[5]。Anderson建立的心肌肥厚模型,是通过腹主动脉缩窄,使外周循环阻力增加,从而导致压力超负荷性的心肌肥厚模型,此法建立的模型是研究心肌肥厚病理生理学过程、分子生物学机制以及心血管药理较为理想的动物模型[6]。本研究结果显示,随着不断应用塞来昔布,可以逐渐缓解心肌肥厚心室结构的变化,在心肌肥厚发生早期得以改善。
3.2 塞来昔布对心肌肥厚大鼠血浆及心肌组织中炎症因子TNF-α的影响 研究证明,大量炎症因子参与了心肌肥厚的形成过程(包括心室重构、纤维化和细胞凋亡等),其中包括TNF-ɑ,TNF-α可以诱导心肌细胞发生凋亡,引起心肌细胞肥大,还可双向调节胶原纤维的生成和降解。TNF-α在正常心肌细胞中表达较少,但在病理情况下(如心肌肥厚)出现高表达。TNF-α影响心肌肥厚的可能机制有[7]:①TNF-α与细胞膜上TNF-α受体结合,激活丝裂原活化蛋白激酶信号转导通路,使心肌细胞肥大;②TNF-α一则可以通过影响心肌兴奋-收缩偶联过程中Ca2+的活动,二则通过降低心肌细胞对儿茶酚胺的反应性2个途径来影响心肌的收缩力;③金属蛋白酶参与胶原的变性和降解,促进合成新的纤维组织,TNF-α可通过金属蛋白酶使心肌肥厚过程中的胶原含量增加,从而诱导心肌间质纤维化;④TNF-α可以促进心肌细胞发生凋亡,因心肌细胞是终末细胞,心肌细胞不断凋亡导致心肌细胞数目逐渐减少,纤维组织不断增生,心肌日益增厚。
本研究中,造模后2周各组大鼠血浆中TNF-α含量没有明显差异;而模型组大鼠心肌组织中TNF-α含量显著增加,塞来昔布可以显著降低心肌肥厚大鼠心肌组织中TNF-α的含量;造模后4周各组大鼠不管是血浆中还是心肌组织中,TNF-α含量均没有明显变化。提示在心肌肥厚发生早期,心肌组织本身TNF-α含量会出现明显增加,此时血浆中TNF-α含量并未出现显著变化;而在心肌肥厚不断发展过程中,可能是由于炎症因子之间的相互作用,不管是心肌组织本身还是外周血中,均未检测到TNF-α含量的变化。这与Stamm等[8]随着左心室肥厚的不断发展, 心肌组织内TNF-α的表达出现进行性增加,但直到心脏发生心力衰竭后才在血清中检测到TNF-α的实验结果相似。TNF-α可能是在心肌内合成,局部参与心肌肥厚的进程。而在心肌肥厚发生2周时,塞来昔布可以显著降低心肌肥厚大鼠心肌组织中的TNF-α含量,这可能与塞来昔布早期改善心肌肥厚大鼠的整体心功能及心室结构的变化有关。
3.3 塞来昔布对心肌肥厚大鼠心肌细胞凋亡的影响 细胞凋亡是指为了维持内环境的稳定,由基因控制的细胞自主而有序的死亡过程。近年来研究表明,细胞凋亡在许多心血管疾病如高血压、心肌肥厚、动脉粥样硬化等中具有重要作用[9]。压力超负荷早期,心肌细胞发生凋亡可能是心脏对后负荷增大做出的短暂性反应,但这却对心脏功能产生了严重的影响。心肌细胞是终末分化细胞,为了适应压力超负荷的血流动力学改变,从而维持心脏的收缩功能,心肌细胞开始增生肥大,成纤维细胞增殖、间质胶原合成增多。在早期阶段,心肌细胞肥大是一种有效的代偿方式,但当压力超负荷持续存在时,心脏由代偿发展为失代偿则最终导致心力衰竭的发生[10]。生理条件下,细胞凋亡与细胞增殖肥大共同调节细胞生长与消亡,是一种维持细胞平衡的重要手段。病理条件下,心肌细胞肥大与细胞凋亡共同参与多种心血管疾病发生发展的过程。在心肌肥厚发展过程中,心肌细胞凋亡扮演着重要角色,一方面是一种自我保护机制,另一方面使机体陷入不断地损伤循环中。
本研究中,造模后2周和4周模型组和塞来昔布组心肌细胞凋亡率显著升高,但塞来昔布组较模型组凋亡率显著下降;随着造模时间的延长,模型组大鼠心肌细胞凋亡率显著升高。根据结果可以推测:心肌细胞凋亡严重影响着心肌肥厚的发展进程,心肌肥厚初期,压力超负荷的刺激下,心肌细胞发生代偿性细胞肥大,由于肥大信号的刺激,为了维持心肌结构及功能的稳定,心肌启动自杀性模式,诱导心肌细胞凋亡;但随着时间的延长,压力超负荷的刺激持续存在,可能导致心肌肥厚向失代偿转变,从而使心肌细胞凋亡率更加增高。而在这个过程中,塞来昔布可以不同程度减少心肌细胞凋亡率,延缓心肌肥厚发展,提高心室功能。
3.4 塞来昔布对心肌肥厚大鼠心肌细胞凋亡与TNF-α关系的影响 目前认为TNF-α诱发细胞凋亡的途径有以下几种:①使诱导细胞凋亡的原癌基因表达增强;②通过与TNF-α受体结合,激活c-Jun氨基末端激酶路径,从而诱导心肌细胞发生凋亡;③通过鞘氨醇依赖机制;④诱导心肌组织一氧化氮的产生。
总之,心肌组织产生的TNF-α可以通过诱导心肌细胞凋亡最终影响心脏的功能。本研究中,模型组2周心肌组织中TNF-α明显增高,在慢性压力超负荷下,TNF-α诱导心肌细胞的凋亡率在4周显著升高,印证了这一说法。TNF-α与其受体肿瘤坏死因子受体1结合,通过Fas相关死亡域与Caspase-8 相互激活,通过级联放大反应激活Caspases通路,从而介导细胞凋亡。还有研究发现,除了通过Caspases通路,TNF-α还可通过神经酰胺途径诱导心肌细胞发生凋亡[11-12]。本研究结果提示塞来昔布可以显著降低心肌组织产生的TNF-α含量。因此,可以猜测塞来昔布可能是通过降低心肌组织中TNF-α含量抑制心肌凋亡通路中死亡受体途径来降低心肌细胞凋亡率的,从而缓解心肌肥厚,改善心室功能。(本文图见封三)
[参考文献]
[1] 杨冬,王切,米立国,等. TNNI3K基因表达与大鼠心肌肥厚形态学变化相关性研究[J].河北医科大学学报,2014,35(11):1241-1245.
[2] 司明明,辛雪,范晓梅,等.环氧化酶2抑制剂在心肌肥厚中的作用[J].内蒙古医科大学学报,2014,36(3):288-292.
[3] 戴海霞,张晓燕,徐开俊.非甾体抗炎药研究的最新进展[J].药物生物技术,2012,19(1):90-94.
[4] 赵祎镭,李丹露.心肌肥厚模型建立方法的研究进展[J].中国药房,2014,25(5):473-475.
[5] 熊肇军,董吁钢.心肌肥厚的研究进展[J].中国医学前沿杂志,2013,54(4):17-22.
[6] Ihori H,Nozawa T,Sobajima M,et al. Waon therapy attenuates cardiac hypertrophy and promotes myocardial capillary growth in hypertensive rats: a comparative study with fluvastatin[J]. Heart Vessels,2015 [Epub ahead of print].
[7] Al-Rasheed NM,Al-Rasheed NM,Bassiouni YA,et al. Vitamin D attenuates pro-inflammatory TNF-α cytokine expression by inhibiting NF-кB/p65 signaling in hypertrophied rat hearts[J]. J Physiol Biochem,2015,71(2):289-299.
[8] Stamm C,Friehs I,Cowan DB,et al. Inhibition of tumor necrosis factor-alpha improves postischemic recovery of hypertrophied hearts[J]. Circulation,2001,18,104(12 Suppl 1):1350-1355.
[9] Zhang C,Wang F,Zhang Y,et al. Celecoxib prevents pressure overload-induced cardiac hypertrophy and dysfunction by inhibiting inflammation,apoptosis and oxidative stress[J]. J Cell Mol Med,2015,20(1):116-127.
[10] Liersch PN,Schwarz A,Sachweh J,et al. Gene expression of cytokines,growth factors and apoptosis regulators in a neonatal model of pulmonarystenosis[J].Future Cardiol,2015,11(3):297-307.
[11] 徐勒,高珊,赵瑞历,等.Livin和Caspase-3与恶性肿瘤的研究进展[J].临床荟萃,2012,27(11): 997-1001.
[12] Zhao M,Qin Y,Lu L,et al. Preliminary study of necroptosis in cardiac hypertrophy induced by pressure overload[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2015,32(3):618-623.
(本文编辑:刘斯静)
[收稿日期]2015-12-31;[修回日期]2016-03-15
[作者简介]薛锋(1990-),男,内蒙古商都人,内蒙古医科大学基础医学院医学硕士研究生,从事生理学基础研究。
*通讯作者