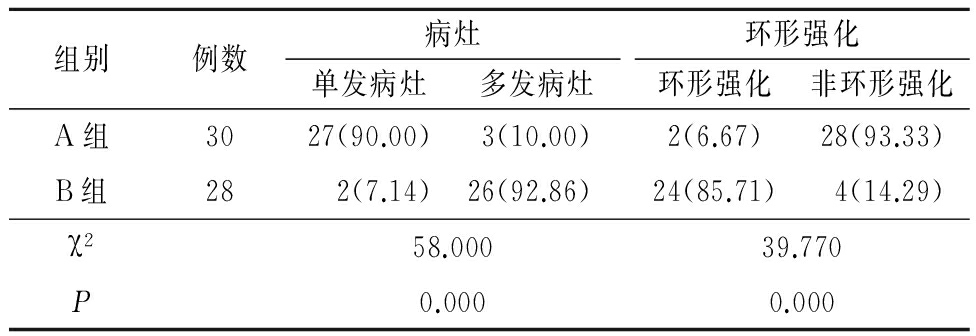
表1 2组CT扫描肝脏多发病灶数及环形强化病灶数比较
Table 1 Comparation of the number of multiple lesions in the liver and the number of ring enhanced lesions in the liver in the two groups (例数,%)
·论 著·
史 博,平 勇,王永中,李智岗*
(河北医科大学第四医院放射科,河北 石家庄 050011)
[摘要]目的将VX2瘤株接种于兔不同部位(肝脏及脾脏),观察是否能够成功建立兔肝脏肿瘤模型,通过观察其CT增强扫描及数字减影血管造影(digital subtraction angiography,DSA)检查的影像学特点,探讨2种模型的差异。方法将60只实验兔随机分为2组各30只。A组将VX2细胞悬液1 mL(1×107/mL)种植于兔肝脏。B组将VX2细胞悬液1 mL(1×107/mL)种植于兔脾脏。分别于种植后第14天及第15天行CT增强扫描及DSA检查。结果A组中30只实验兔全部建模成功并完成实验,B组中有28只建模成功并完成实验。A组CT扫描及DSA检查肝脏多发病灶数、肝脏环形强化病灶数与B组比较差异有统计学意义(P<0.05)。结论①经肝脏及脾脏种植VX2细胞悬液均能成功建立兔肝脏肿瘤模型。②通过肝脏接种VX2瘤株建立的模型,CT扫描及DSA表现更接近人类原发性肝癌;通过脾脏接种VX2瘤株建立的模型,CT扫描及DSA表现更接近于人类肝转移瘤。
[关键词]肝肿瘤;血管造影术;动物,实验
doi:10.3969/j.issn.1007-3205.2016.08.018
近年来我国肝脏恶性肿瘤发病率逐年增高,其中肝癌是危害人们健康的主要恶性肿瘤之一,居癌症死亡原因的第3位,每年由于肝癌死亡的病例约50%发生在中国,患者就诊时大多在中晚期[1-2]。因此,关于肝脏恶性肿瘤诊治的研究,越来越为广大医务工作者所重视。制备适合的动物肝脏肿瘤模型进行研究,可以为临床肝脏恶性肿瘤的诊治提供有利的数据和依据。将VX2瘤株种植于兔相应的器官,建立兔肝脏肿瘤模型是目前常用的方法[3-8],主要是将VX2瘤株(可以是VX2细胞悬液,也可以是VX2组织块)直接种植于兔肝脏。VX2瘤株起源于Shope病毒诱发的兔乳头状瘤,为鳞状细胞癌瘤株,由此建立的兔肝脏肿瘤模型是原发性肝癌还是肝脏转移瘤存在争议。将VX2瘤株种植于兔脾脏,随之发生肝脏转移,由此建立兔肝脏肿瘤模型的方法,国内外罕有报道。将VX2瘤株种植于兔脾脏的方法能否成功建立兔肝脏肿瘤模型,2种方法建立的兔肝脏肿瘤模型有什么不同,尚无明确结论。寻找更好的建立兔肝脏肿瘤模型方法以及建立适合研究的模型,对临床肝脏肿瘤的研究及诊治具有重要的意义。现将研究结果报告如下。
1.1 实验动物 新西兰大白兔60只,雌雄不限,体质量2.5~3.0 kg/只,随机分为2组,每组30只。A组:于兔耳缘静脉注射1%戊巴比妥钠(3 mL/kg)麻醉后,仰卧固定于实验台上,剑突下腹部皮肤剪毛、消毒后,于正中纵行逐层切开腹壁约3 cm,暴露并牵拉出肝脏左叶,直视下缓慢注入VX2细胞悬液(浓度1×107/mL)1 mL,无菌干纱布压迫5 min,观察无细胞悬液外流后还纳肝脏,逐层关闭腹壁,连续7 d于耳缘静脉注射头孢曲松钠20 mg·kg-1·d-1预防感染。B组:将实验兔麻醉后,仰卧固定,左侧肋弓下缘剪毛、消毒,沿左侧肋缘逐层切开腹壁约3 cm,暴露并牵拉出脾脏,缓慢注入VX2细胞悬液(浓度1×107/mL)1 mL,无菌干纱布压迫5 min,观察无细胞悬液外流后还纳脾脏,逐层关闭腹壁,连续7 d于耳缘静脉注射头孢曲松钠20 mg·kg-1·d-1预防感染。分别于种植后第14天及第15天行CT增强扫描及数字减影血管造影(digital subtraction angiography,DSA)检查,观察统计CT扫描、DSA检查兔肝脏多发病变例数以及环形强化和染色例数。
1.2 CT扫描 80 kV,200 mA,层厚2.5 mm,延时5 s,造影剂(碘佛醇注射液350)注射速度为1 mL/s,造影剂注射总量为4 mL。
1.3 DSA 麻醉好的兔仰卧位固定,于右侧腹股沟区逐层切开皮肤及皮下,暴露并游离右侧股动脉,结扎股动脉远端,使近端充盈明显,直视下使用5F套管针(日本泰尔茂公司)穿刺右侧股动脉并置入Stride微导管(日本朝日公司,2.2 F),在透视监视下将Stride微导管分别选入腹主动脉(造影速率2 mL/s,总量4 mL)、腹腔干(造影速率1.5 mL/s,总量4 mL)及肝固有动脉(造影速率0.5 mL/s,总量2 mL)造影。结束后拔出导管及套管,结扎右侧股动脉,逐层缝合,连续7 d于耳缘静脉注射头孢曲松钠20 mg/kg/d预防感染。
1.4 统计学方法 应用PEMS 3.1统计软件进行数据分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2.1 模型情况对比 A组(经肝种植VX2细胞悬液)30只兔全部成功建模,成功率为100.00%,并全部完成实验。B组(经脾种植VX2细胞悬液)30只兔中,2只在接种VX2细胞悬液后10 d死亡,死亡后解剖发现这2只均出现腹膜种植,有大量腹腔积液,肝脏均未见转移病灶;有28只建立模型成功,成功率为93.33%,28只兔完成实验。
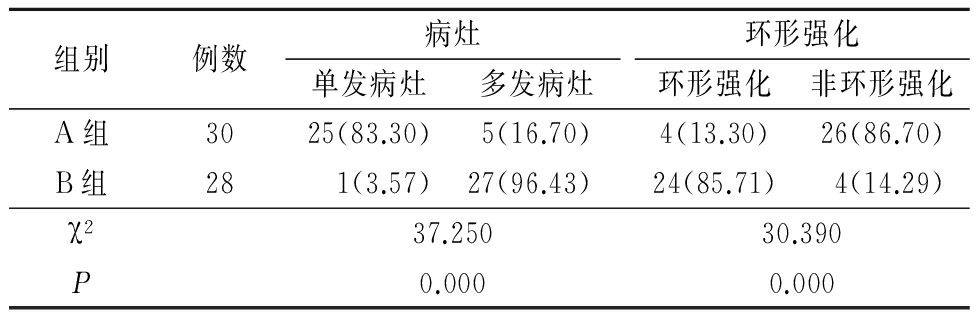
2.2 CT扫描与DSA A组CT扫描及DSA检查肝脏多发病灶数及环形强化病灶数与B组差异均有统计学意义(P<0.05)。见表1,2。
表1 2组CT扫描肝脏多发病灶数及环形强化病灶数比较
Table 1 Comparation of the number of multiple lesions in the liver and the number of ring enhanced lesions in the liver in the two groups (例数,%)

表2 2组DSA检查肝脏多发病灶数及环形强化数比较
Table 2 Comparation of DSA examination of multiple lesions of the liver and the number of ring reinforcement
in the two groups (例数,%)
肝脏是最常见的恶性肿瘤转移靶器官,在西方国家肝脏恶性肿瘤以肝脏转移瘤居多,在我国肝脏转移瘤与原发性肝癌的发病率大致相当,但随着乙型肝炎防治的进行,肝转移瘤的发病有增多趋势,因此肝脏恶性肿瘤的治疗越来越为临床医师重视。经肝动脉化疗栓塞是治疗肝脏恶性肿瘤常用的技术,可以显著延长肝癌患者的生存期[9],也是不能手术的肝癌或肝转移瘤的首选治疗方法[10-12]。制备适合介入诊疗研究的动物肝脏肿瘤模型为临床研究肝脏恶性肿瘤的诊治奠定了基础。于兔相应器官种植VX2瘤株建立的兔肿瘤模型是绝大多数学者认为最合适的供介入放射学研究的动物模型,并且模型建立的成功率均在50%以上[13-14]。
本研究中A组模型建立成功率为100.00%,B组成功率为93.33%,B组中有2只兔子在接种后10 d死亡,经解剖发现腹腔内广泛转移,肝脏并未发现转移病灶,原因可能是脾脏接种瘤株后,局部压迫时间不足,还纳脾脏后细胞悬液流出,造成广泛的腹膜种植。本研究结果显示通过肝脏和脾脏种植VX2瘤株均能成功建立兔肝脏肿瘤模型。
兔VX2肝脏肿瘤模型的肝脏病变强化或染色明显,为富血供肿瘤,但也有学者报道兔VX2肝脏肿瘤CT强化不明显,为乏血供肿瘤[15]。兔VX2肝脏肿瘤血供差异与建模方法不同是否有关,研究报道很少。肝动脉化疗栓塞治疗肝脏肿瘤的疗效与肿瘤血供的丰富程度相关,肝脏肿瘤的血供是否丰富对介入栓塞治疗中栓塞剂的选择至关重要。经肝脏种植瘤株,瘤株直接在肝脏生长,这种模型是否可以被认为是原发肝癌?经脾脏种植瘤株,瘤细胞在脾脏增殖,进而随血液转移至肝脏,这种模型是否可以认为是肝转移瘤?人原发性肝癌多表现为单发、整个病灶强化或染色明显[16],为富血供肿瘤;而肝转移瘤多表现为多发、病灶边缘环形强化,为乏血供肿瘤。本研究建立的兔VX2肝脏肿瘤模型作为原发性肝癌研究还是作为肝转移瘤研究,众多学者尚无共识。对不同方法建立的兔肝脏肿瘤模型进行比较,找出存在的差异,才能为临床肝脏恶性肿瘤诊疗的研究提供更可靠的依据。
本研究中CT扫描发现A组30只实验兔中肝脏出现多发病变例数及肝脏肿瘤表现为边缘环形强化的例数均较少,分别占10.00%和6.67%,而B组28只实验兔中多发病变例数及肝脏肿瘤表现为边缘环形强化的例数均较多,分别占92.86%和85.71%,2组差异均有统计学意义。表明经脾脏种植瘤株建立的模型中肝脏肿瘤CT表现特点为多发、边缘环形强化,这与人肝转移瘤相一致;相反,经肝脏种植瘤株建立的模型中肝脏肿瘤的CT表现特点更接近于人原发性肝癌。
本研究中DSA检查结果与CT扫描结果相一致,2组差异亦均有统计学意义。DSA检查也进一步证实经脾种植瘤株建立的模型中肝脏肿瘤与人类肝转移瘤的特点接近,而经肝脏种植瘤株建立的模型更接近人原发性肝癌。
总之,经肝脏及经脾脏种植VX2细胞悬液均能成功建立兔肝脏肿瘤模型。通过兔肝脏种植VX2瘤株建立的肝脏肿瘤模型CT及DSA表现更接近人类原发性肝癌;通过兔脾脏种植VX2瘤株建立的肝脏肿瘤模型CT及DSA表现更接近于人类肝转移瘤。
[参考文献]
[1] 童敏,陈柱.以改良方法建立兔VX2肝癌模型[J].中国组织工程研究,2015,19(27):4361-4364.
[2] 吴发宗,纪建松,涂建飞.兔VX2肝癌模型肝动脉化疗栓塞后微环境中CD3+、CD4+T细胞的表达[J].健康研究,2014,34(6):622-624.
[3] 李博,李智岗,艾宁,等.2种方法建立兔VX2肝种植癌模型的对比及介入技术应用[J].河北医科大学学报,2011,32(4):429-432.
[4] Parvinian A,Casadaban LC,Daba RC. Development,growth,propagation,and angiographic,utilization of rabbit VX2 model of liver cancer:a pictorial primer and “how to” guide[J]. Diagn Interv Radiol,2014,20:335-340.
[5] 唐胜利,袁玉峰,钱群,等.康派特医用胶改良兔VX2肝癌模型的种植方法及其生长特性[J].中华实验外科杂志,2015,32(11):2884-2886.
[6] Duran R,Sharma K,Dreher MR,et al. A Novel Inherently Radiopaque Bead for Transarterial Embolization to Treat Liver Cancer-A Pre-clinical Study[J]. Theranostics,2016,6(1):28-39.
[7] Gholamrezanezhad A, Mirpour S, Geschwind JH,et al. Evaluation of 70-150-μm doxorubicin-eluting beads for transcatheter arterial chemoembolization in the rabbit liver VX2 tumour model[J]. Eur Radiol,2016[Epub ahead of print].
[8] 秦汉林,王伟昱,朱先海,等.CT引导下不同方法建立兔VX2肝癌模型的比较[J].中华实验外科杂志,2015,32(10):2602-2604.
[9] Song do S,Nam SW,Bae SH,et al. Outcome of transarterial chemoembolization-based multi-model treatment in patients with unresectable hepatocellular carcinoma[J]. World J Gastroenterol,2015,21(8):2395-404.
[10] 范晴敏,陆正华.肝转移癌的微创治疗[J/CD].中华临床医师杂志:电子版,2013,7(6):2635-2637.
[11] 叶颖江,申占龙,王杉.转移性肝癌的治疗理念和策略[J/CD].中华普外科手术学杂志:电子版,2014,8(1):26-29.
[12] 王红光,武中林,郭庆军,等.DSA变速采集在肝癌介入治疗中的应用[J].河北医科大学学报,2012,33(10):1200-1203.
[13] 卢陈英,惠俊国,夏水伟,等.64排CT及血管成像在兔VX2肝癌移植瘤诊断中的应用[J].中华医学杂志,2015,95(7):541-543.
[14] Namur J,Pascale F,Maeda N,et al. Safety and efficacy compared between irinotecan-loaded microspheres HepaSphere and DC bead in a model of VX2 liver metastases in the rabbit[J]. J Vasc Interv Radiol,2015,26(7):1067-1075.
[15] 武中林,吴勇超,谷铁树,等.肝转移瘤血液供应来源分析[J].河北医科大学学报,2015,36(4):428-432.
[16] 王善军.多排螺旋CT重建技术在小肝癌早期诊断中的价值[J].河北医科大学学报,2012,33(11):1334-1336.
(本文编辑:刘斯静)
SHI Bo,PING Yong, WANG Yong-zhong, LI Zhi-gang*
(Department of Radiology, the Forth Hospital of Hebei Medical University, Shijiazhuang 050011, China)
[Abstract]Objective To observe whether the rabbit liver tumor models can be successfully established and to explore the difference between the 2 models. VX2 tumor strains were inoculated in different parts of the rabbit(liver and spleen). Imaging features were examined by using CT enhanced scan and digital subtraction angiography(DSA). Methods Sixty rabbits were divided into two groups randomly(30 rabbits in each group). In group A, the tumor cell suspension in a volume of 1 mL was injected into liver. In group B, the suspension was injected into spleen. The rabbits were examined by CT perfusion scan and DSA at 14 and 15 days after implantation. The CT manifestation(the number and enhancement characteristics of hepatic lesions), the manifestation of DSA(the number and stain of the lesions) and the parameters of CT perfusion scan were observed. Results Thrity rabbits models in group A were all successfully established and the experiments were completed. Twenty-eight rabbits models in group B were all successfully established and the experiments were completed. There were significant differences in the CT scan, DSA examination of multiple focal liver lesions and number of ring enhanced lesions in liver between group A and group B(P<0.05). Conclusion The rabbit liver tumor model was successfully established by VX2 cell suspension culture in liver and spleen. The model established by liver inoculated with VX2 tumor strain was found to be more close to human primary liver cancer by using the CT scan and DSA. The model established by spleen inoculated with VX2 tumor strain was found to be more close to human primary liver metastasis by using the CT scan and DSA.
[Key words]liver neoplasms; angiography; animals, laboratory
[收稿日期]2016-03-29;
[修回日期]2016-04-13
[作者简介]史博(1980-),男,辽宁沈阳人,河北医科大学第四
*通讯作者:。E-mail:FSKL1ZH1GANG2013@163.com
[中图分类号]R753.5
[文献标志码]A
[文章编号]1007-3205(2016)08-0940-04
医院主治医师,医学硕士,从事肿瘤介入治疗研究。