·论 著·
王建新1,武中林2*,苏金娜1,王伟娜1,谢艳丽1,王建平1
(1.河北医科大学第四医院乳腺中心,河北 石家庄 050011;2.河北医科大学第四医院放射科,河北 石家庄 050011)
[摘要]目的探讨植入式静脉输液港(静脉港)体内导管纤维蛋白鞘形成的诊断及处理方法。方法静脉港导管功能障碍患者131例,采用数字减影血管造影(digital subtraction angiography,DSA)技术,经静脉港蝶翼针外接口,手推造影剂行体内导管造影,分析DSA表现;对诊断明确患者给予尿激酶溶鞘治疗,观察处理效果。结果 DSA发现静脉港体内导管纤维蛋白鞘形成51例,占静脉港导管功能障碍的38.9%(51/131),其中体内导管末端局部纤维蛋白鞘形成43例,体内导管弥漫性纤维蛋白鞘形成5例,体内导管广泛性纤维蛋白鞘形成3例。特异影像学表现为DSA下可见沿体内导管外壁走形的线样、柱状或不规则状高密度影包裹体内导管,被包裹的导管管径明显增粗,造影剂可向上反流进入腔静脉、静脉港植入侧或输液座周围皮下软组织内。51例患者给予尿激酶溶鞘治疗后,48例静脉港继续使用,3例静脉港提前摘除。体内导管局部、弥漫性及广泛性纤维蛋白鞘形成尿激酶溶鞘治疗成功率分别为100.0%(43/43)、100.0%(5/5)和0.0%(0/3)。结论DSA可有效评估静脉港体内导管纤维蛋白鞘形成,纤维蛋白鞘形成是造成静脉港导管功能障碍的主要原因之一,尿激酶对静脉港体内导管末端局部纤维蛋白鞘形成具有良好的治疗效果。
[关键词]输注,静脉内;纤维蛋白鞘;血管造影术,数字减影
doi:10.3969/j.issn.1007-3205.2016.09.014
植入式静脉输液港(central verlous port access system,CVPAS)简称静脉港,长期留置于体内并发症较多,体内导管纤维蛋白鞘形成是最常见的远期并发症之一,也是造成导管功能障碍的主要原因[1-3],导致静脉港无法正常使用,部分患者不得不提前摘除静脉港[4-5]。静脉港在我国临床应用时间较短,目前对静脉港体内导管纤维蛋白鞘形成的诊断及处理尚未见相关报道,现将静脉港体内导管纤维蛋白鞘形成的诊断及处理方法作简要分析和总结,报告如下。
1.1 一般资料 选择2009年1月—2014年12月河北医科大学第四医院排除由于蝶翼针穿刺不当及输液座翻转因素造成的导管功能障碍患者131例,所有患者均签署静脉港数字减影血管造影(digital subtraction angiography, DSA)知情同意书。其中男性4例,女性127例,年龄26~70岁,平均(52.0±3.6)岁。经颈内静脉穿刺植入静脉港83例,经锁骨下静脉穿刺植入静脉港48例。20 mL注射器生理盐水脉冲式冲管(生理盐水冲管)表现为:注射生理盐水顺利,回抽不顺利或无回血77例;注射生理盐水不顺利,回抽不顺利或无回血13例;注射生理盐水及回抽均不顺利或困难或不能41例。
1.2 静脉港DSA 根据静脉港说明书要求,采用20 mL注射器手工注射造影,造影全程严格遵循无菌操作原则。患者仰卧于DSA检查床上,先采集一张注射造影剂前的对比片,观察静脉港输液座和体内导管的位置、走形、完整性及导管末端位置;20 mL注射器抽取造影剂15~20 mL,接蝶翼针外接口,手持注射器,按下DSA机连续采集键后,操作人员同时向静脉港内持续注射造影剂,先慢后快,全程动态观察造影表现,实时调整注射速度及终止造影,由1名主任医师、1名副主任医师及1名主治医师对DSA图像进行分析,造影结束用3~5 mL肝素盐水正压封管。
1.3 治疗 诊断明确患者复查血常规及凝血功能,对无溶鞘治疗禁忌患者,告知患者家属使用尿激酶可能发生的并发症,签署知情同意书后给予尿激酶溶鞘治疗,治疗过程中密切观察患者有无皮肤、黏膜岀血征象及随时复查凝血功能。经静脉港蝶翼针外接口,5 000 U/mL尿激酶生理盐水3~5 mL缓慢注射,连续2次,20 min/次,1 000 U/mL尿激酶生理盐水3~5 mL缓慢注射,1次/d,连续3 d,3 d后如注射生理盐水和回抽均顺利则溶鞘治疗成功。如局部溶鞘治疗效果较差,改为尿激酶10万U溶解于100 mL生理盐水中缓慢静脉滴注,1次/d,连续3 d,3 d后如注射生理盐水和回抽均顺利则溶鞘治疗成功。如上述治疗无效,与患者家属协商更换其他纤溶类药物或摘除静脉港。对注射生理盐水困难或不能的患者,可在DSA透视下,采用5 mL小注射器瞬间加压法冲破纤维蛋白鞘薄弱区,形成液路后再采用上述方法进行溶鞘治疗。
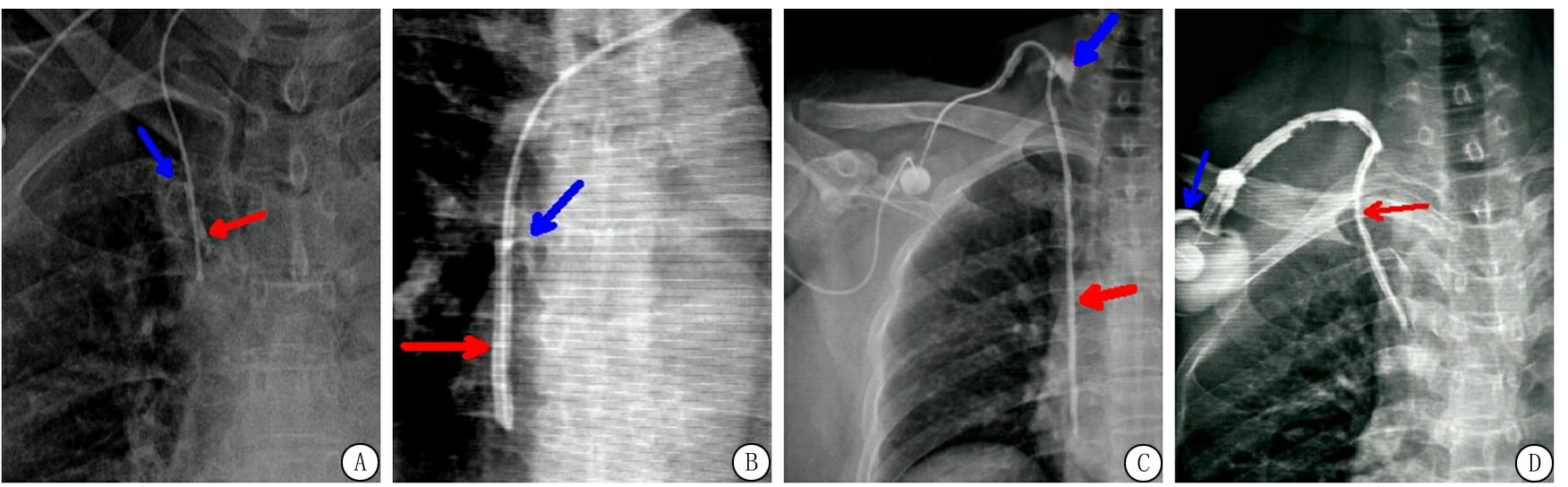
DSA下可见沿体内导管外壁走形的线样、柱状或不规则状高密度影包裹体内导管,被包裹的导管管径明显增粗,造影剂可向上反流进入腔静脉、静脉港植入侧或输液座周围皮下软组织内(图1)。
发现静脉港体内导管纤维蛋白鞘形成51例,占静脉港导管功能障碍的38.9%(51/131),其中体内导管末端局部纤维蛋白鞘形成43例(84.3%),体内导管弥漫性纤维蛋白鞘形成5例(9.8%),体内导管广泛性纤维蛋白鞘形成3例(5.9%)。
51例患者给予尿激酶溶鞘治疗后,48例(94.1%)成功,静脉港继续使用,3例静脉港提前摘除。体内导管局部、弥漫性及广泛性纤维蛋白鞘形成尿激酶溶鞘治疗成功率分别为100.0%(43/43)、100.0%(5/5)和0.0%(0/3),无溶鞘治疗相关并发症发生。

图1 植入式静脉输液港体内导管纤维蛋白鞘形成DSA表现
A.红色箭头示导管末端及侧孔被不规则状纤维蛋白鞘包裹,蓝色箭头示造影剂向上反流进入腔静脉;B.红色箭头示导管末端及侧孔被柱状纤维蛋白鞘包裹,蓝色箭头示造影剂向上反流进入腔静脉;C.红色箭头示位于血管内的体内导管被不规则状纤维蛋白鞘包裹,蓝色箭头示造影剂向上反流进入静脉港植入侧皮下软组织内;D.红色箭头示整个导管被不规则状纤维蛋白鞘包裹,蓝色箭头示造影剂向上反流进入输液座周围皮下软组织内
Figure 1 DSA manifestations of the fibrin sheath of the catheter in the implanted venous port
静脉港完全植入体内,由供穿刺的输液座和体内导管2部分组成,输液座是一个可以储存液体的空间,体内导管通过一个导管锁与输液座相连,体内导管纤维蛋白鞘形成后导管会出现阀门式表现,即静脉滴注或注射液体时纤维蛋白鞘被冲开,液体可以进入血管但不顺利或不能,回抽时导管被纤维蛋白鞘封闭造成回抽困难。纤维蛋白鞘是包裹于中心静脉导管表面,由细胞成分和非细胞成分组成的膜状物,该膜状物形成后不仅影响导管功能,而且还可继发感染、血栓形成、肺栓塞等严重并发症[6-7],大大缩短了静脉港的自然使用寿命。研究显示,纤维蛋白鞘可发生于所有类型的中心静脉导管表面,发生率为38%~100%,是造成中心静脉导管功能障碍的主要原因[7]。
静脉港在每次使用前均应回抽血,如回抽不顺利或无回血意味着导管功能的下降,需要及时处理[8]。本研究结果显示,对131例静脉港导管功能障碍患者行DSA发现,静脉港体内导管纤维蛋白鞘形成51例(38.9%)。静脉港在我国临床应用时间较短,目前大家对静脉港体内导管纤维蛋白鞘形成的DSA表现及造成导管功能障碍的临床表现尚缺乏认识。笔者结合DSA及生理盐水冲管表现,对静脉港体内导管纤维蛋白鞘形成进行分析:体内导管末端局部纤维蛋白鞘形成,DSA下可见沿体内导管外壁走形的线样、柱状或不规则状高密度影,包裹体内导管末端及侧孔,造影剂向上反流进入腔静脉,生理盐水冲管表现为注射生理盐水顺利或稍有阻力,回抽困难或无血;体内导管弥漫性纤维蛋白鞘形成,DSA下可见沿体内导管外壁走形的不规则状高密度影,包裹大部分位于血管内的体内导管,即局限于血管内的纤维蛋白鞘,造影剂向上反流进入腔静脉,生理盐水冲管表现为注射生理盐水困难,回抽无血;体内导管广泛性纤维蛋白鞘形成,DSA下可见沿体内导管外壁走形的不规则状高密度影,包裹整个或大部分体内导管,造影剂向上反流可进入静脉港植入侧皮下软组织或输液座周围皮下软组织内,生理盐水冲管表现为注射生理盐水困难(注射后患者即刻出现静脉港植入侧不适、疼痛或胀痛)或不能,回抽无血。静脉港在每次使用前必须进行回抽血及冲管,当遇见注射后患者即刻出现输液座周围疼痛和不适的,应高度怀疑纤维蛋白鞘形成的可能。本研究结果显示,当推入造影剂时,由于压力较大使纤维蛋白鞘离开体内导管外壁,造影剂通过导管末端侧孔后沿纤维蛋白鞘与体内导管外壁间的潜在腔隙向上进入腔静脉,即出现注射生理盐水顺利或稍有阻力,如纤维蛋白鞘延伸到皮下软组织内,造影剂可通过潜在腔隙进入皮下软组织,即出现注射生理盐水困难或不能,回抽时由于负压较大使纤维蛋白鞘紧紧贴在体内导管外壁上,封堵了导管末端侧孔,即出现回抽无血或困难。笔者发现静脉港体内导管末端局部纤维蛋白鞘形成者较多为84.3%(43/51),说明纤维蛋白鞘的发生始于导管末端与血管内膜接触的部位,由导管末端逐渐向远心端生长。研究显示,导管末端可随心跳及机体活动而运动,摩擦会导致局部血管内皮损伤,继而激活附壁血栓形成[9]。
目前关于纤维蛋白鞘形成的治疗至今没有共识和指南,文献报道可分为纤溶类药物治疗和纤维蛋白鞘剥离术。经导管溶鞘治疗是最常用方法,尿激酶、链激酶、重组组织型纤维蛋白酶原激活剂(recombinant tissue plasminogen activator,rt-PA)、替奈普酶、瑞替普酶等药物均有一定应用价值。Zajko等[10]用链激酶治疗13例纤维蛋白鞘形成患者,溶鞘治疗成功率为92%。Gray等[11]应用纤维蛋白鞘剥除术和尿激酶溶鞘治疗纤维蛋白鞘,2种方法比较差异无统计学意义,尿激酶溶鞘治疗成功率为96.55%。经皮股静脉纤维蛋白鞘剥脱术是一种有创手术,虽然有效率在95%以上,但纤维蛋白鞘剥除后有进入肺动脉造成肺栓塞的可能[12]。经导管溶鞘治疗是最经济、简便的方法,由于链激酶具有发热及抗原性特征,且其他纤溶类药物价格昂贵,所以临床上最常用的是尿激酶。
静脉港体内导管末端局部纤维蛋白鞘形成,由于可以向体内导管注射液体,可先给予尿激酶局部溶鞘治疗,直至注射生理盐水和回抽均顺利,本研究43例患者均首次溶鞘成功;静脉港体内导管弥漫性或广泛性纤维蛋白鞘形成由于注射生理盐水困难或不能,可先在DSA透视下采用5 mL小注射器瞬间加压冲破纤维蛋白鞘薄弱区,注意不宜持续用力注射,以免人为造成体内管破裂,DSA透视下证实已冲破纤维蛋白鞘薄弱区形成液路后再给予治疗,8例患者局部溶鞘治疗均失败,后改为尿激酶10万U溶解于100 mL生理盐水中缓慢静脉滴注,5例患者溶鞘成功,另3例患者其中1例更换rt-PA治疗效果也较差,摘除静脉港。尿激酶在治疗纤维蛋白鞘形成中的具体剂量目前尚无明确规定,本研究溶鞘治疗成功率为94.1%(48/51),但笔者使用的尿激酶用量低于文献报道[13]。笔者体会,体内导管末端局部纤维蛋白鞘形成溶鞘治疗效果明显好于弥漫性或广泛性纤维蛋白鞘形成患者,对于广泛性纤维蛋白鞘形成患者应考虑直接摘除静脉港,避免因溶鞘治疗增加岀血风险。
目前关于纤维蛋白鞘的形成时间、起始部位、生长方式、组织病理学还没有定论,需要进一步探索。关于形成时间目前公认的是从植入人体的那一刻起即开始形成[2]。研究显示,超声及CT对颈段血管及导管的纤维蛋白鞘形成具有一定诊断价值[14-15],由于受骨骼和肺的干扰超声及CT不能诊断体内导管末端局部纤维蛋白鞘形成,本研究DSA发现,84.3%(43/51)患者为体内导管末端局部纤维蛋白鞘形成。静脉港价格昂贵,笔者认为要从根本上解决静脉港体内导管纤维蛋白鞘形成带来的困扰,重在预防,从静脉港植入当天即开始使用预防纤维蛋白鞘形成的特异性药物[16]。本研究结果发现,纤维蛋白鞘形成是造成静脉港导管功能障碍的主要原因,DSA可有效评估静脉港体内导管纤维蛋白鞘形成,尿激酶对体内导管末端局部纤维蛋白鞘形成具有良好的治疗效果,值得临床推广应用。
[参考文献]
[1] 孙玉巧,周涛,李云涛,等.完全植入式静脉输液港的临床应用[J].中华外科杂志,2014,52(8):608-611.
[2] 武中林,刘亮,李杰,等.植入式静脉输液港导管功能障碍DSA造影表现[J].第三军医大学学报,2015,37(12):1294-1296.
[3] 赵丽萍,王文丽,夏春芳,等.中心静脉导管相关性纤维蛋白鞘预防和治疗进展[J].中国现代医学杂志,2012,22(18):62-65.
[4] 王建新,苏金娜,王伟娜,等.植入式静脉输液港非计划性拔管原因分析及护理[J].河北医药,2014,36(10):1594-1596.
[5] 黄景香,李顺宗,李智岗,等.静脉输液港断裂导管取出经验总结[J].河北医科大学学报,2011,32(9):996,1003,1006.
[6] Besarab A,Pandey R. Catheter management in hemodialysis patients: delivering adequate flow[J]. Clin J Am Soc Nephrol,2011,6(1):227-234.
[7] Ni N,Mojibian H,Pollak J,et al. Association between disruption of fibrin sheaths using percutaneous transluminal angioplasty balloons and late onset of central venous stenosis[J]. Cardiovasc Intervent Radiol,2011,34(1):114-119.
[8] 焦俊琴,唐甜甜,孙玉巧,等.静脉输液港再通障碍41例原因分析[J].山东医药,2014,54(23):98-99.
[9] Kohler TR,Kirkman TR. Central venous catheter failure is induced by injury and can be prevented by stabilizing the catheter tip[J]. J Vasc Surg,1998,28(1):59-65.
[10] Zajko AB,Reilly JJ Jr,Bron KM,et al.Low-dose streptokinase for occluded hickman catheters [J]. AJR Am J Roentgenol,1983,141(6):1311-1312.
[11] Gray RJ,Levitin A,Buck D,et al. Percutaneous fibrin sheath stripping versus transcatheter urokinase infusion for malfunctioning well-positionedtunneled central venous dialysis catheters: a prospective,randomized trial[J]. J Vasc Interv Radiol,2000,11(9):1121-1129.
[12] Brady PS,Spence LD,Levitin A,et al. Efficacy of percutaneous fibrin sheath stripping in restoring patency of tunnelled hemodialysis catheters[J]. AJR AM J Roentgenol,1999,173(4):1023-1027.
[13] 杨萍,张云霞,王丽敏,等.大频率尿激酶治疗透析导管形成纤维蛋白鞘的护理干预[J].护理实践与研究,2012,9(3):28-29.
[14] 段青青,张丽红,张文云,等.彩色多普勒超声观察深静脉导管纤维蛋白鞘28例分析[J].中国血液净化,2012,11(4):198-201.
[15] 崔天蕾,李真林,曾筱茜,等.CT静脉血管成像在中心静脉导管功能障碍中的应用[J].中国血液净化,2012,11(2):85-87.
[16] 李小庭,刘丁,王亚彬,等.早期应用尿激酶预防及治疗长期透析导管纤维蛋白鞘[J].南方医科大学学报,2014,34(11):1668-1671.
(本文编辑:赵丽洁)
WANG Jan-xin1, WU Zhong-lin2*, SUN Jin-na1,WANG Wei-Na1, XIE Yan-li1, WANG Jian-Ping1
(1.Department of Breast Center, the Fourth Hospital of Hebei Medical University,Shijazhuang 050011, China;2.Department of Radiology, the Fourth Hospital of Hebei Medical University, Shijazhuang 050011, China)
[Abstract]Objective To analyze the diagnosis and treatment of fibrin shell formation of central verlous port access system(CVPAS). Methods There were 131 cases of catheter dysfunction of CVPAS. By using the digital subtraction angiography(DSA) and the external interface of the butterfly wing needle in the portal vein, the contrast agent was performed in vivo, and the DSA expression was analyzed, and the treatment effect was observed. Results Fifty-one cases of fibrin shell formation were found by DSA, which accounted for 38.9% of the venous port catheter dysfunction(51/131). Among those, 43 cases were localized in the end of the catheter, 5 cases of diffuse fibrous protein in the body, and 3 cases of extensive fibrous sheath formation. DSA specific imaging shows the line, columnar and irregular high density along outer wall of body catheter and parcel body catheter. The diameter of parcel catheter is obvious thickening,The contrast agent reflux into the vena cava,the implantation side of CVPAS and the infusion seat peripheral subcutaneous sofe tissue. Fifty one patients are given urokinase treatment,48 cases CVPAs continue to use, 3 cases CVPAS anticipate extirpation.The treatment success rates of local,diffuse and extensive fibrin shell formation given urokinase treatment are respectively 100.0%(43/43),100.0%(5/5)vs0.0%(0/3). Conclusion The causes of catheter diffuse fibrin shell formation of CVPAS can be evaluated accurately by means of the DSA. The main cause of catheter dysfunction is fibrin shell formation. Urokinase has good therapeutic effect on local fibrin shell formation.
[Key words]infusions, intravenous; fibrin shell formation; angiography, digital subtraction
[收稿日期]2015-11-02;
[修回日期]2016-03-05
[基金项目]河北省医学科学研究重点课题(ZD20140250)
[作者简介]王建新(1976-),女,河北景县人,河北医科大学第
*通讯作者:。E-mail:1065561615@qq.com
[中图分类号]R452
[文献标志码]A
[文章编号]1007-3205(2016)09-1047-04
四医院副主任护师,医学学士,从事临床护理学研究。