[摘要] 目的以恶性畸胎瘤PA-1细胞作为恶性生殖细胞肿瘤的代表,探讨银杏黄酮、氨磷汀及亮丙瑞林对顺铂抗肿瘤作用的影响。方法用细胞计数工具8(cell counting Kit-8,CCK-8)中方法检测PA-1细胞增殖抑制率,免疫印迹法检测胞浆细胞色素C(cytochrome c,Cyt-C)及凋亡蛋白酶活化因子1(apoptotic protease activating-1,Apaf-1)含量,实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)法检测Cyt-C及Apaf-1信使核糖核酸 (message ribonucleic acid,mRNA)表达水平。结果各组PA-1细胞抑制率,Cyt-C、Apaf-1蛋白水平及mRNA水平比较,B、C、D、E均高于A组,C、D、E组高于B组,E组低于D组,差异有统计学意义(P<0.05);E、D组PA-1细胞增殖抑制率、Cyt-C蛋白及Cyt-C mRNA、Apaf-1 mRNA高于C组,E组Apaf-1蛋白低于C组,差异有统计学意义(P<0.05)。结论在体外培养实验中,顺铂对PA-1细胞存在明显抑制效应,以其半抑制浓度(half maximal inhibitory concentration,IC50)所对应的银杏黄酮、氨磷汀及亮丙瑞林剂量与其联合应用,可增强顺铂对PA-1细胞的抑制作用,上调Cyt-C和Apaf-1 mRNA的表达水平,提高胞浆内Cyt-C和Apaf-1蛋白含量。三者比较以氨磷汀作用最强。
[关键词] 畸胎瘤;顺铂;氨磷汀;亮丙瑞林 doi:10.3969/j.issn.1007-3205.2016.10.024
银杏黄酮作用于恶性畸胎瘤PA-1细胞,与顺铂的抑瘤作用有协同作用[1]。氨磷汀在肿瘤组织及正常组织中的作用有差别[2-3]。亮丙瑞林在化疗过程中对生殖细胞肿瘤有抑制作用。前期研究显示,银杏黄酮、氨磷汀及亮丙瑞林对顺铂所致卵巢损伤有一定的保护作用[4],拟作为有生育要求的恶性畸胎瘤患者化疗的辅助用药,但3种药物对顺铂抑制肿瘤细胞作用的影响无相关报道。本研究以PA-1细胞为研究对象,测定其细胞抑制率、胞浆细胞色素C(cytochrome c,Cyt-C)和凋亡蛋白酶活化因子1(apoptotic protease activating-1,Apaf-1)蛋白含量以及Cyt-C和Apaf-1mRNA含量,旨在探讨银杏黄酮、氨磷汀及亮丙瑞林在顺铂对PA-1抑制过程中的影响[5]。
1.1 细胞来源 PA-1细胞(编号ATCCCRL-1572,购自协和医科大学细胞中心)。细胞培养条件:使用1640培养基,置于含5%CO2、饱和湿度、37 ℃恒温培养箱中培养,每1~2 d传代1次。
1.2 细胞增殖抑制率的测定 顺铂半抑制浓度 (half maximal inhibitory concentration,IC50)的确定:以不同浓度的顺铂作用于PA-1细胞,使用细胞计数工具8(cell counting Kit-8,CCK-8)法检测细胞增殖抑制率,确定顺铂的作用时间和浓度。使用下列公式计算细胞增殖率及细胞增殖抑制率:细胞增殖率=[受试孔光密度(optical density,OD)值-本底对照孔OD值]/(对照细胞OD-本底对照OD值)×100%;细胞增殖抑制率=(1-细胞增殖率)×100%。
1.3 细胞分组及用药 按照实验要求,选取对数生长期细胞,按照每孔1×105个细胞的浓度铺96孔板,加入培养液至每孔体积100 μL,培养24 h后分成5组,每组测10组数据,A组为生理盐水组,B组为顺铂组,C组为银杏黄酮+顺铂组,D组为氨磷汀+顺铂组,E组为亮丙瑞林+顺铂组,每组数据设3个复孔及本底对照孔(仅加培养基,无细胞)。根据表1测定结果,顺铂作用于PA-1细胞24 h ,其IC50为35.02 mg/L。根据人体临床用药剂量比例,确定银杏黄酮、氨磷汀及亮丙瑞林的相应给药浓度,分别为银杏黄酮26.25 g/L、氨磷汀5.25 g/L及亮丙瑞林17.5 mg/L。
1.4 检测指标 检测各组细胞生长抑制率,评价药物对顺铂作用的影响;免疫印迹法检测胞浆Cyt-C及Apaf-1蛋白含量;实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)法检测Cyt-C及Apaf-1 mRNA表达水平[6]。
表1 顺铂对PA-1细胞的抑制作用![]()
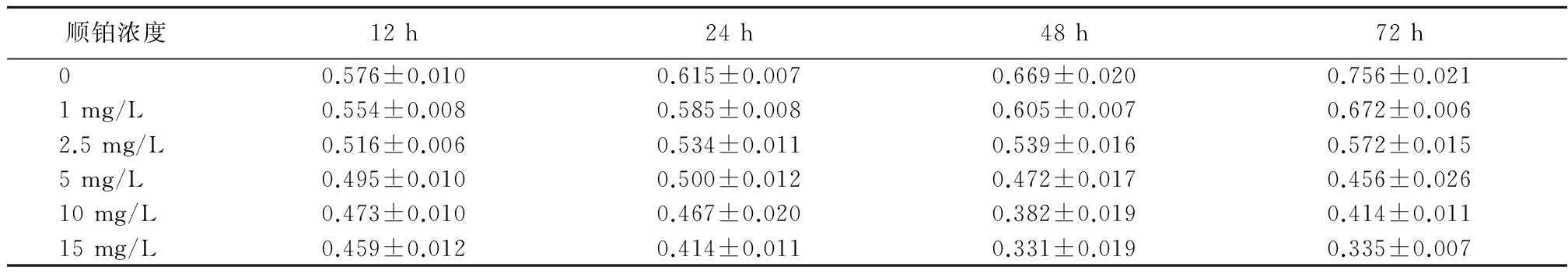
顺铂浓度12h24h48h72h00.576±0.0100.615±0.0070.669±0.0200.756±0.0211mg/L0.554±0.0080.585±0.0080.605±0.0070.672±0.0062.5mg/L0.516±0.0060.534±0.0110.539±0.0160.572±0.0155mg/L0.495±0.0100.500±0.0120.472±0.0170.456±0.02610mg/L0.473±0.0100.467±0.0200.382±0.0190.414±0.01115mg/L0.459±0.0120.414±0.0110.331±0.0190.335±0.007
1.5 统计学方法 应用SPSS 18.0软件包进行统计学分析。计量资料比较分别采用单因素方差分析和SNK-q检验。 P<0.05为差异有统计学意义。
各组PA-1细胞增殖抑制率,Cyt-C、Apaf-1蛋白水平及mRNA水平比较:B、C、D、E均高于A组,C、D、E组高于B组, E组低于D组,差异有统计学意义(P<0.05);E、D组PA-1细胞增殖抑制率、Cyt-C蛋白及Cyt-C mRNA、Apaf-1 mRNA高于C组,E组Apaf-1蛋白低于C组,差异有统计学意义(P<0.05)。见表2。
表2 各组PA-1细胞抑制率,Cyt-C、Apaf-1蛋白及mRNA水平比较![]()
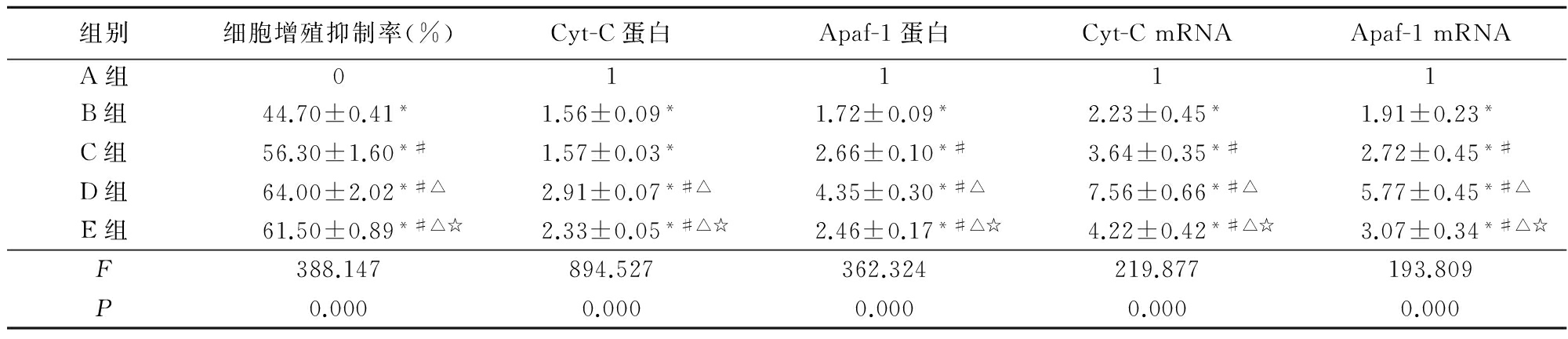
组别细胞增殖抑制率(%)Cyt-C蛋白Apaf-1蛋白Cyt-CmRNAApaf-1mRNAA组01111B组44.70±0.41*1.56±0.09*1.72±0.09*2.23±0.45*1.91±0.23*C组56.30±1.60*#1.57±0.03*2.66±0.10*#3.64±0.35*#2.72±0.45*#D组64.00±2.02*#△2.91±0.07*#△4.35±0.30*#△7.56±0.66*#△5.77±0.45*#△E组61.50±0.89*#△☆2.33±0.05*#△☆2.46±0.17*#△☆4.22±0.42*#△☆3.07±0.34*#△☆F388.147894.527362.324219.877193.809P0.0000.0000.0000.0000.000
*P<0.05与A组比较 #P<0.05与B组比较 △P<0.05与C组比较 ☆P<0.05与D组比较(q检验)
临床多种抗肿瘤药物,均通过各种方式诱导肿瘤细胞凋亡而发挥其抗肿瘤作用,而一些肿瘤产生耐药也与细胞凋亡过程密切相关[7]。人类卵巢恶性畸胎瘤细胞株PA-1由转移性卵巢癌患者的腹水细胞中获得,是生殖细胞肿瘤的一种,顺铂是一种临床常用的抗肿瘤药物,对多种肿瘤具有良好的抑制作用,对生殖细胞肿瘤也有良好的抑制效果。其主要机制就是通过氧化损伤诱导肿瘤细胞凋亡。本研究结果显示,在体外培养过程中,给予顺铂后,PA-1细胞胞浆Cyt-C及Apaf-1 mRNA的表达水平上调,胞浆Cyt-C及Apaf-1蛋白含量增加,细胞凋亡增加,细胞增殖受到抑制,24 h抑制率为44.70%。
本研究结果显示,银杏黄酮+顺铂组的抑制率高于顺铂组,提示银杏黄酮与顺铂联合应用,不仅可以发挥对卵巢功能的保护作用,同时可以加强顺铂的抗肿瘤作用。目前研究者对于黄酮类化合物的抗肿瘤作用的认识逐渐加深,临床研究显示黄酮类化合物通过抑制肿瘤细胞增殖及诱导肿瘤细胞凋亡2个方面而发挥抗肿瘤作用。在人类神经母细胞瘤、乳腺癌、结肠癌、前列腺癌及子宫内膜癌等肿瘤的研究中,黄酮类化合物都发挥了这一作用[8-9]。有研究显示,银杏黄酮对于小鼠淋巴瘤YAC-1细胞的增殖在体外及体内实验中均有抑制作用,对于宫颈癌Hela细胞,可降低Bcl-2 mRNA的表达,诱导Hela细胞凋亡,对于肝癌HepG细胞可发挥抑制增殖和诱导凋亡作用。银杏黄酮的抗肿瘤作用机制复杂而广泛,其可通过调节多种凋亡相关蛋白的表达而起作用。本研究结果中,银杏黄酮+顺铂组与顺铂组比较,Cyt-C及Apaf-1 mRNA表达水平均增高,胞浆中Apaf-1蛋白含量也增高,但Cyt-C蛋白含量差异无统计学意义,提示Cyt-C在合成及释放过程中受到了调节,与mRNA的表达水平不协调,其具体机制尚需进一步研究。
本研究将氨磷汀与顺铂联用,可加强顺铂对PA-1的抑制作用,其细胞增殖抑制率可高达64.00%,高于单纯顺铂组及银杏黄酮+顺铂组,同时上调了Cyt-C及Apaf-1 mRNA的表达水平,提高了胞浆内Cyt-C及Apaf-1蛋白含量,加强了顺铂的诱导凋亡作用。氨磷汀在以往的多项研究中显示了广泛细胞保护作用,在多种恶性肿瘤的治疗中,用于减轻放疗及化疗所致的骨髓抑制、肾功能损害、神经系统功能损害等。氨磷汀需经过体内代谢后发挥作用,氨磷汀经碱性磷酸酶水解后形成带有自由巯基的代谢产物,正常组织对其摄取能力较肿瘤组织高达100倍,同时碱性磷酸酶的活性与pH有关,肿瘤组织pH值较低,该酶活性较低。由于在正常组织及肿瘤组织中的不同分布,氨磷汀可发挥对正常组织的保护作用而不影响肿瘤组织对放化疗的敏感性[10-11]。在离体实验中,氨磷汀可以诱导DNA损伤的细胞发生凋亡,而且其诱导凋亡的作用在正常细胞与肿瘤细胞中存在差别。这一作用在体内实验中是否能够出现,有待进一步研究。
本研究将亮丙瑞林与顺铂联合应用,对于PA-1细胞显示了一定的抑制作用,在给予顺铂前给予亮丙瑞林作用24 h,使PA-1细胞的增殖抑制率提高至61.50%,较单用顺铂组抑制效果更明显,同时可以上调Cyt-C和Apaf-1 mRNA的表达水平及提高胞浆内Cyt-C和Apaf-1蛋白含量。表明在保护卵巢功能的同时,亮丙瑞林还发挥了对肿瘤细胞的抑制作用,并未影响顺铂的化疗效果,且这一效果与线粒体途径相关。亮丙瑞林是一种促性腺激素释放激素 (gonadotropin-releasing hormone,GnRH)激动剂,临床应用广泛,主要应用于性激素依赖性疾病如乳腺癌、前列腺癌、子宫内膜异位症及性早熟等[12-13]。其作用是抑制垂体及卵巢功能,减少促性腺激素及雌孕激素的分泌,对化疗所致卵巢功能损伤有确切的保护作用,其主要机制是抑制卵泡发育,使卵泡停滞于对化疗损伤敏感性较低的原始卵泡阶段[14],以减轻化疗损伤。而GnRH激动剂通过抑制垂体功能,下调促性腺激素的分泌,对于卵巢肿瘤也有一定的治疗作用。
银杏黄酮、氨磷汀及亮丙瑞林均显示了对PA-1细胞的抑制作用,且均显示与线粒体途径相关,比较三者的作用效果,氨磷汀对PA-1的抑制作用最强,但由于线粒体途径包含的步骤很多,且存在众多调节因子,因此3种药物对PA-1细胞的抑制作用机制仍需进一步探讨,本实验观察到的现象为今后的研究指出了一个方向。
总之,在体外培养实验中,顺铂对PA-1细胞存在明显抑制效应,以其IC50所对应的银杏黄酮、氨磷汀及亮丙瑞林剂量与其联合应用,可增强顺铂对PA-1细胞的抑制作用,上调Cyt-C和Apaf-1 mRNA的表达水平及提高胞浆内Cyt-C和Apaf-1蛋白含量。三者比较以氨磷汀作用最强。
[参考文献]
[1] Dragojeviĉ-Simiĉ V,Dobriĉ S,Jaĉeviĉ V,et al. Efficacy of amifostine in protection against doxorubicin-induced acute cardiotoxic effects in rats[J]. Vojnosanit Pregl,2013,70(1):38-45.
[2] Nicolatou-Galitis O,Sarri T,Bowen J,et al. Systematic review of amifostine for the management of oral mucositis in cancer patients[J]. Supportive Care in Cancer,2013,21(1):357-364.
[3] Nicolatou-Galitis O,Sarri T,Bowen J,et al. Systematic review of amifostine for the management of oral mucositis in cancer patients[J]. Supportive Care in Cancer,2013,21(1):357-364.
[4] Chang Z,Wang HL,Du H. Protectiveeffect of Ginkgo flavonoids,amifostine and leuprorelin againstplatinum-induced ovarian impairment in rats [J]. Geneticsand Molecular Research,2014,13(3):5276-5284.
[5] Ahmad ST,Arjumand W,Seth A,et al. Methylation of the APAF-1 and DAPK-1 promoter region correlates with progression of renal cell carcinoma in North Indian population[J]. Tumour Biol,2012,33(2):395-402.
[6] 田志辉,王丹,曹彦坤,等.DIAPH-3蛋白在浸润性乳腺癌组织中的表达及预后的研究[J].河北医科大学学报,2015,36(7):792-795.
[7] 申薇,梁冰峰,李秀荣,等.卵巢癌耐药细胞株SKOV3/DDP的建立及其与凋亡途径蛋白的关系[J].河北医科大学学报,2014,35(10):1135-1139.
[8] Iriti M,Varoni EM. Chemopreventive potential of flavonoids in oral squamous cell carcinoma in human studies[J]. Nutrients,2013,5(7):2564-2576.
[9] You OH,Kim SH,Kim B,et al. Ginkgetin induces apoptosis via activation of caspase and inhibition of survival genes in PC-3 prostate cancer cells[J]. Bioorg Med Chem Lett,2013,23(9):2692-2695.
[10] Panteliadou M,Giatromanolaki A,Touloupidis S,et al. Treatment of invasive bladder cancer with conformal hypofractionated accelerated radiotherapy and amifostine (HypoARC) [J]. Urol Oncol,2012,30(6):813-820.
[11] 邓子亮,张刘珍,丛悦,等.氨磷汀对急性放射病小鼠早期骨髓造血功能的防护作用[J].中国实验血液学杂志,2014,22(3):791-796.
[12] Morelli M,Rocca ML,Venturella R,et al. Improvement in chronic pelvic pain after gonadotropin releasing hormone analogue(GnRH-a) administration in premenopausal women suffering from adenomyosis or endometriosis:a retrospective study[J]. Gynecol Endocrinol,2013,29(4):305-308.
[13] Hill JW,Alreja M,Elias CF. From precocious puberty to infertility:metabolic control of the reproductive function[J]. Front Endocrinol (Lausanne),2013,4:43.
[14] Li X,Kang X,Deng Q,et al. Combination of a GnRH agonist with an antagonist prevents flare-up effects and protects primordial ovarian follicles in the rat ovary from cisplatin-induced toxicity:a controlled experimental animal study[J]. Reprod Biol Endocrinol,2013,11(1):16-23.
(本文编辑:刘斯静)
·论 著·
[中图分类号] R730.269
[文献标志码]B
[文章编号]1007-3205(2016)10-1208-04
[收稿日期] 2015-08-07;
[修回日期]2016-01-08