表1 pAMPK和pACC在PTC和结节性甲状腺肿组织中的表达
Table 1 Expression of pAMPK and pACC in PTC and nodular goiter (例数)
·论 著·
严 丽1,李清怀1,冀 宏1,申 伟1,郭 浩1,王长全2
(1.河北医科大学第二医院甲状腺乳腺外科,河北 石家庄 050000;2.河北省安国市医院普通外科,河北 安国 071200)
[摘要]目的观察磷酸化腺苷酸活化蛋白激酶(phosphorylated AMP-activated protein kinase,pAMPK)和磷酸化乙酰辅酶A羧化酶(phosphorylated acetyl-CoA carboxylase,pACC)在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)组织中的表达情况,探讨AMPK-ACC信号通路在PTC中的表达及意义。方法采用免疫组织化学法和Western blot法分别检测60例PTC和20例结节性甲状腺肿组织中pAMPK和pACC的表达情况,分析其与性别、年龄、肿瘤大小、双侧癌、多灶、包膜侵犯、中央区淋巴结转移和侧颈部淋巴结转移等临床病理因素的关系。结果pAMPK和pACC在PTC和结节性甲状腺肿组织中均有表达,pAMPK和pACC在PTC组织中阳性表达率均显著高于结节性甲状腺肿(P<0.05)。pAMPK和pACC在PTC中央区淋巴结转移组中的阳性表达率均显著高于PTC中央区淋巴结未转移组(P<0.05)。pAMPK和pACC在PTC侧颈部淋巴结转移组中的阳性表达率均显著高于PTC侧颈部淋巴结未转移组(P<0.05)。pAMPK和pACC的表达程度与PTC患者的性别、年龄、肿瘤大小、双侧癌、多灶和包膜侵犯等差异均无统计学意义(P>0.05)。Western blot法检测显示PTC组织中pAMPK和pACC的表达均显著高于结节性甲状腺肿组(P<0.05)。结论pAMPK和pACC在PTC组织中表达增强,并与颈部淋巴结转移密切相关;AMPK-ACC信号通路的激活在PTC发生和转移中可能发挥了促进作用。
[关键词]甲状腺肿瘤;淋巴结;基因表达调控,酶学
甲状腺癌是最常见的头颈部恶性肿瘤,其中以甲状腺乳头状癌(papillary thyroid carcinoma, PTC)最为常见,占80%~90%。相对于其他恶性肿瘤,PTC具有恶性度低、预后好的特点,但是颈部淋巴结转移和远处转移仍是造成患者生存质量下降和复发率升高的重要因素。能量代谢与肿瘤的发生发展密切相关,肿瘤细胞的无限增殖要有相应的能量代谢支撑,通过调节肿瘤细胞的能量代谢进而抑制肿瘤生长将是肿瘤治疗的一个新靶点。腺苷酸活化蛋白激酶[adenosine 5′-monophosphate(AMP)-actired protein kinase,AMPK]是细胞内的“能量调节器”,通过感受细胞内AMP/ATP比例的变化发挥调节作用。AMP升高或ATP降低均可激活AMPK,AMPK激活后可诱导分解代谢,抑制合成代谢,进而抑制细胞增殖,发挥潜在的肿瘤抑制作用。ACC是一种存在于细胞质中的生物素依赖的变构羧化酶,是脂肪酸代谢的限速酶。ACC是AMPK的下游直接底物,当细胞接受刺激或能量消耗增加时,细胞内AMPK含量增加,AMPK使ACC磷酸化形成磷酸化乙酰辅酶A羧化酶(phosphorylated acetyl-CoA carboxylase,pACC)增多,ACC活性降低。检测细胞内pAMPK 和pACC水平的变化可反映AMPK的活性。本研究分别通过免疫组织化学法和Western blot法检测PTC组织中pAMPK和pACC的表达情况,分析AMPK-ACC信号通路在PTC发生、发展和转移中的作用;同时分析PTC组织中pAMPK和pACC的表达与患者年龄、性别、肿瘤大小、双侧癌、多灶、包膜侵犯、中央区淋巴结转移和侧颈部淋巴结转移等临床病理参数之间的关系,旨在为PTC的诊断和治疗提供一个新的靶点。
1.1 一般资料 选取2014年6月—2015年5月河北医科大学第二医院甲状腺乳腺外科收治的PTC患者60例,术后均经病理证实为甲状腺乳头状癌,男性10例,女性50例,年龄20~65岁,平均(44.68±11.11)岁,其中左叶22例,右叶28例,双叶10例。手术方式:甲状腺腺叶、峡部切除+患侧中央区(VI区)淋巴结清扫术24例,甲状腺全切+患侧中央区淋巴结清扫术20例(其中3例同时行患侧Ⅱ~Ⅴ区淋巴结清扫术),甲状腺全切+双侧中央区淋巴结清扫术16例(其中2例同时行单侧Ⅱ~Ⅴ区淋巴结清扫术,4例同时行双侧Ⅱ~Ⅴ区淋巴结清扫术)。所有患者均为首次手术,术前均未行任何抗肿瘤治疗。另取结节性甲状腺肿20例作为对照组,男性3例,女性17例,年龄19~68岁,平均(54.75±11.37)岁。2组性别、年龄差异无统计学意义,具有可比性(P<0.05)。
本研究已经河北医科大学第二医院伦理委员会批准。
1.2 主要试剂 兔抗人pAMPK单克隆抗体和兔抗人pACC单克隆抗体(ABGENT公司),辣根酶标记羊抗兔IgG(Proteintech 公司),二步法通用型免疫组织化学试剂盒(上海基因公司),ECL增强化学发光试剂盒(Millipore 公司)。
1.3 免疫组织化学染色 所有标本经4%多聚甲醛固定48 h,常规石蜡包埋方法制作组织蜡块,连续切片3~5 μm厚。石蜡切片脱蜡至水,抗原修复20 min;3%H2O2室温孵育5 min;滴加10%山羊血清室温封闭15 min;分别加入相应一抗:兔抗人pAMPK(1∶200)和兔抗人pACC(1∶200)4 ℃过夜;次日室温平衡30 min,加入生物素标记的二抗(1:100)室温孵育45 min;应用DAB显色试剂盒进行显色,苏木精复染,梯度酒精脱水、二甲苯透明、封片;光学显微镜下观察并拍摄图片。空白对照以PBS代替一抗。应用Image-Pro 软件进行图像分析。
1.4 Western blot检测 取经液氮冻存的新鲜组织100 mg,加入1 mL组织裂解液,充分匀浆后4 ℃离心12 000 r/min,离心15 min,上清即为组织总蛋白。取100 μg蛋白样品经10%SDS-PAGE 分离并转膜后,用5%牛血清白蛋白(BSA)室温封闭1 h。依次加入一抗:兔抗人pAMPK(1∶500)、兔抗人pACC(1∶500)和兔抗人β-actin(1∶2 000)4 ℃过夜,次日加入山羊抗兔IgG(1∶5 000)室温孵育2 h,滴加ECL发光液,应用奥德赛化学发光成像仪进行检测,以β-actin作为内对照,应用Quantity one软件进行图像分析。
1.5 统计学方法 应用SPSS 19.0软件进行统计。计量资料比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
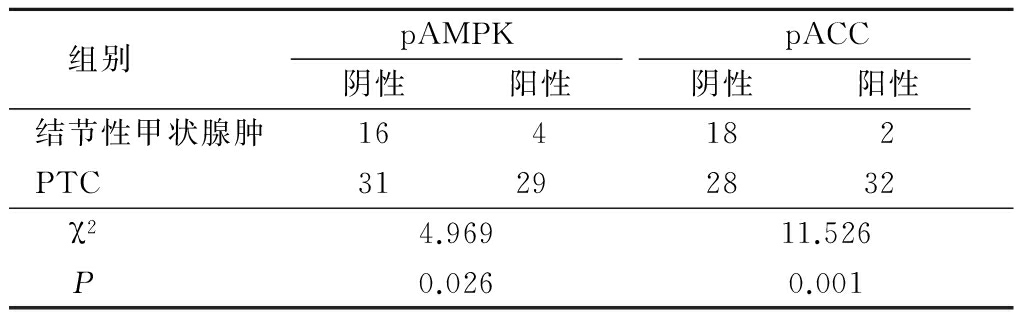
2.1 免疫组织化学法检测 pAMPK和pACC主要表达于细胞质中,结节性甲状腺肿和PTC组织中均有表达。pAMPK在PTC组织中的阳性表达率高于结节性甲状腺肿组(P<0.05);pACC在PTC组织中的阳性表达率高于结节性甲状腺肿组(P<0.05)。见表1,图1,2。
2.2 Western blot法检测 pAMPK蛋白在PTC组织中表达强于结节性甲状腺肿(0.78±0.05vs0.65±0.09),差异有统计学意义(t=6.499,P<0.05)。pACC蛋白在PTC组织中表达强于结节性甲状腺肿(0.73±0.19vs0.44±0.03),差异有统计学意义(t=25.802,P<0.05)(图3)。
2.3 PTC组织中pAMPK和pACC表达与临床病理因素的关系 pAMPK在中央区淋巴结转移组中阳性表达率显著高于淋巴结未转移组(P<0.05);pAMPK在侧颈部淋巴结转移组中阳性表达率显著高于淋巴结未转移组(P<0.05);pACC在中央区淋巴结转移组中阳性表达率显著高于淋巴结未转移组(P<0.05);pACC在侧颈部淋巴结转移组中阳性表达率显著高于淋巴结未转移组(P<0.05);pAMPK和pACC在PTC患者性别、年龄、肿瘤大小、双侧癌、多灶和侵犯包膜中的阳性表达率差异均无统计学意义(P>0.05)。见表2。
表1 pAMPK和pACC在PTC和结节性甲状腺肿组织中的表达
Table 1 Expression of pAMPK and pACC in PTC and nodular goiter (例数)

表2 PTC组织中pAMPK和pACC表达与临床病理因素的关系
Table 2 Relationship between expression of pAMPK and pACC in PTC and clinical pathological factors (例数)
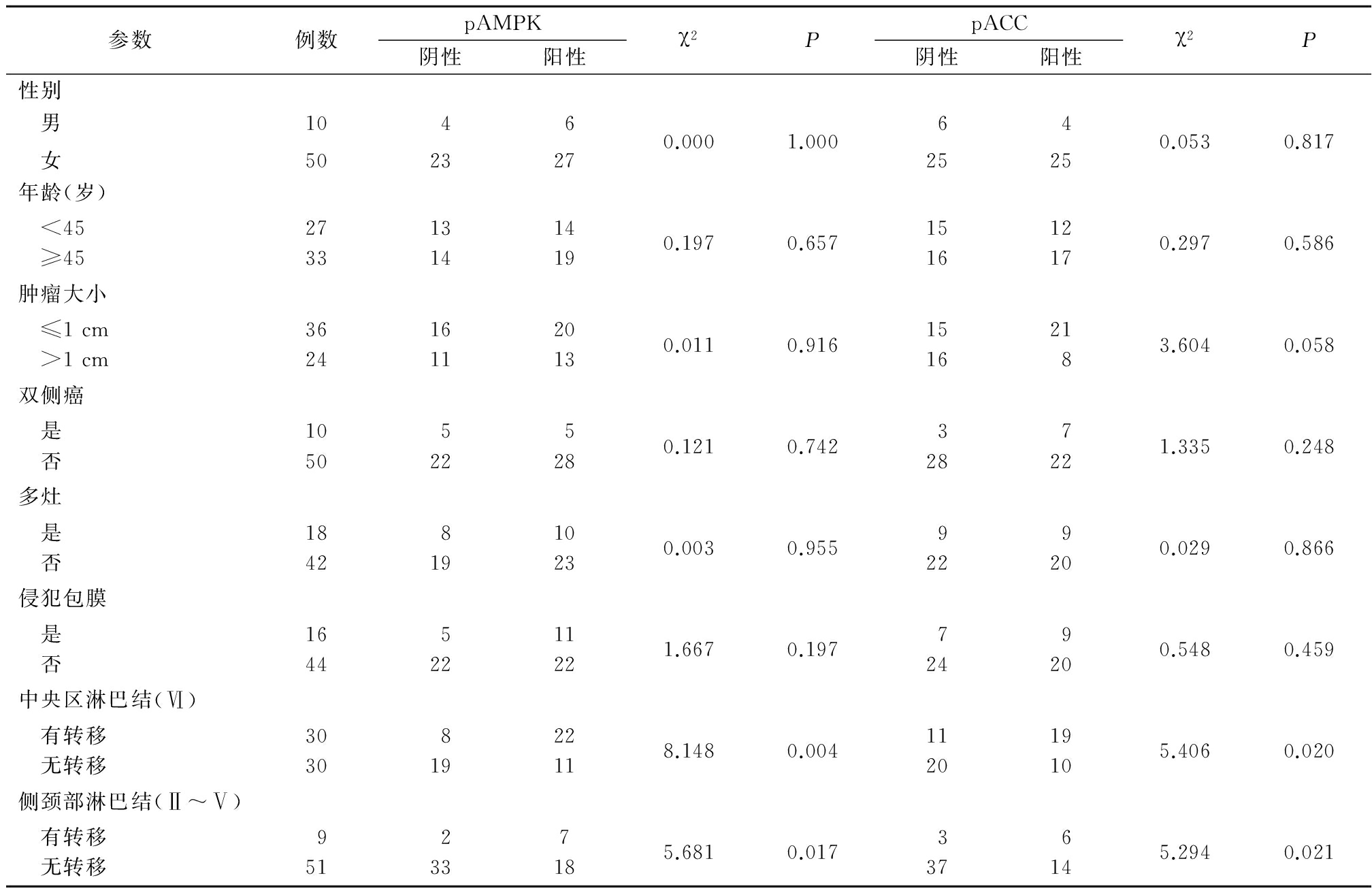
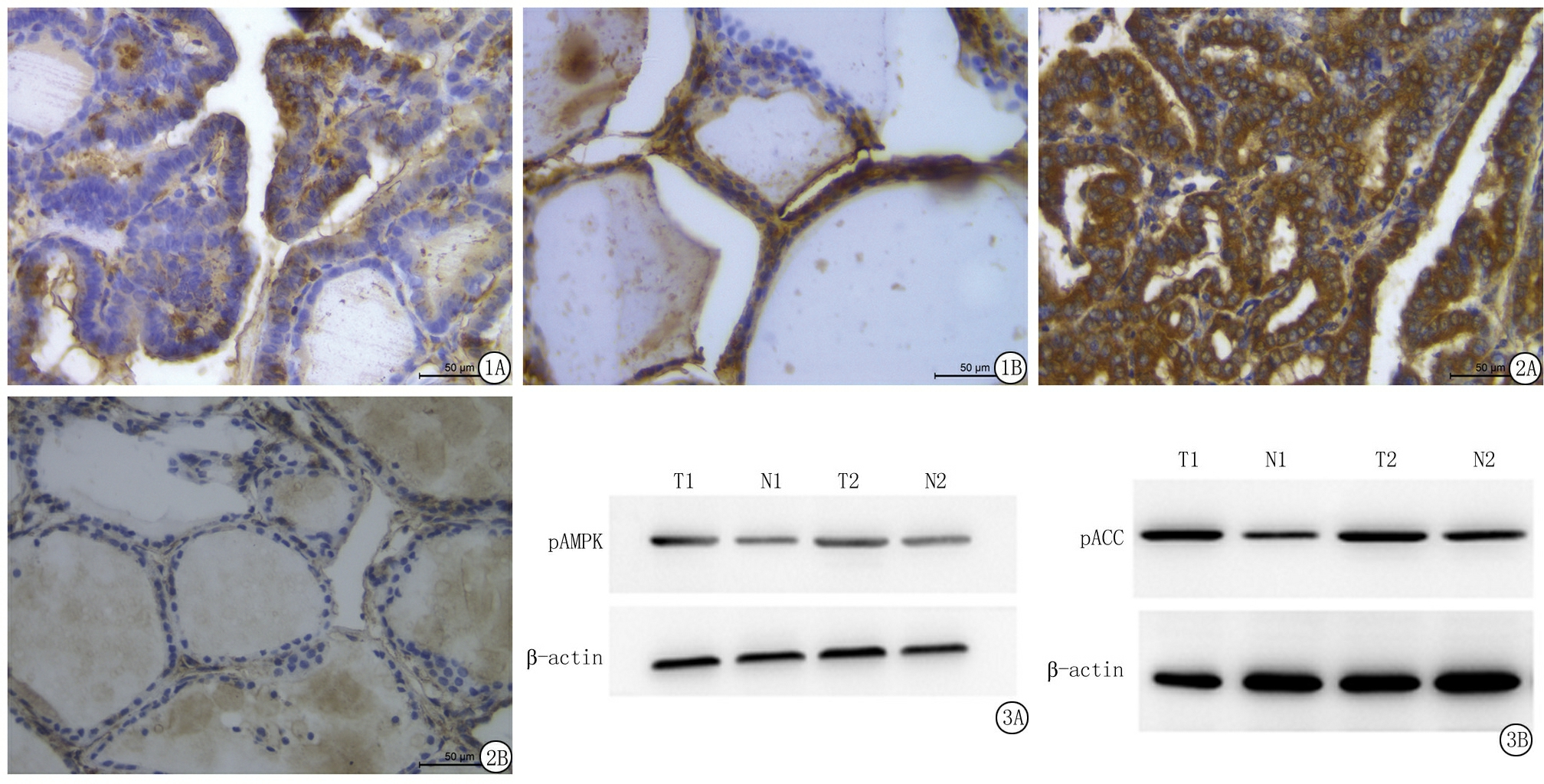
图1 pAMPK在结节性甲状腺肿和PTC组织中的表达(免疫组织化学染色 ×40)
A.结节性甲状腺肿组;B.PTC组
Figure 1 Expression of pAMPK in nodular goiter and PTC(immunohistochemical staining ×40)
图2 pACC在结节性甲状腺肿和PTC组织中的表达(免疫组织化学染色 ×40)
A.结节性甲状腺肿组;B.PTC组
Figure 2 Expression of pACC in nodular goiter and PTC(immunohistochemical staining ×40)
图3 Western blot检测 PTC和结节性甲状腺肿组织中pAMPK、pACC表达
A.结节性甲状腺肿;B.PTC
Figure 3 The expression of pAMPK and pACC in PTC and nodular goiter were test by western blot
AMPK是一种丝氨酸/苏氨酸蛋白酶,由α、β和γ 3个亚单位组成,每个亚单位又分为不同的亚型,分别为α1、α2、β1、β2、γ1、γ2和γ3,不同亚单位可以自由排列组合形成不同的异源三聚体。AMPK是细胞和机体能量代谢的主要调节器,其活性受细胞内AMP/ATP比值的调节,当细胞内AMP水平升高或AMP/ATP的比例上升,AMP通过与γ亚基结合,促进α亚基上的第172位苏氨酸残基磷酸化后形成AMPK的活化形式pAMPK,抑制合成代谢,促进分解代谢。ACC是一种存在于细胞质中的生物素依赖的变构羧化酶,是脂肪酸代谢的限速酶。当细胞受到刺激或能量消耗增加时,细胞内AMPK含量增加,使ACC磷酸化形成pACC增加而活性降低,减少脂肪合成。AMPK及其下游靶点ACC构成的AMPK-ACC信号通路在机体的多种代谢性疾病中发挥重要作用。
肿瘤细胞在过度增殖过程中,其周围微环境出现能量消耗增加、缺血、缺氧等改变,肿瘤细胞为抵抗这些影响,会通过多种机制调节局部的能量代谢以适应其生长。AMPK及其家族成员在肿瘤局部的能量代谢中发挥了重要作用,可通过多种机制调节肿瘤细胞的生长和转移[1-3]。二甲双胍的抗肿瘤机制就是通过激活抑癌基因LKB1,进而激活AMPK使其磷酸化,导致细胞周期停滞于G1期,发挥抗肿瘤细胞增殖的作用[4-8]。AMPK激活剂5-氨基4-酰胺咪唑核糖核苷酸(5-Aminoimidazole-4-carboxamide1-β-D-ribofuranoside,AICAR)可通过抑制EGFR/pAKT/ERK通路和细胞周期蛋白Cyclin D1的表达,使细胞周期阻滞于G0/G1,减少细胞的有丝分裂,抑制肿瘤细胞增殖[9]。AMPK激活后还可上调肿瘤缺氧微环境中缺氧诱导因子1和血管内皮细胞生长因子的表达,促进肿瘤局部侵袭和淋巴结转移;缺氧还可直接激活AMPK,抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)促进肿瘤细胞生长PTC[10-12]。
AMPK可表达于正常甲状腺滤泡细胞中,在调节甲状腺功能方面发挥一定作用。研究表明,AMPK和促甲状腺激素(thyroid stimulating hormone,TSH)2种信号通路相互作用共同调节甲状腺滤泡细胞的碘摄取,影响甲状腺激素的合成。在正常甲状腺滤泡细胞中AMPK对碘摄入的抑制作用与TSH的促进作用达到平衡;应用AICAR和下调TSH均可促进AMPK磷酸化,抑制甲状腺滤泡细胞的碘摄取和钠/碘转运体(sodium iodide symporter,NIS)蛋白的表达[13-14]。Abdulrahman等[15]分别在FRTL-5细胞和C57B16/J小鼠中检测 AMPK变化对碘摄取和NIS 蛋白的影响,发现二甲双胍激活AMPK导致碘摄取和NIS蛋白水平显著下降;AMPK抑制剂Compound C则抑制AMPK导致碘摄取和NIS蛋白水平增强;二甲双胍和Compound C是通过调节NIS启动子中的CRE因子的活性进而调节AMPK发挥作用的,并认为AMPK 调节化合物不但可调节甲状腺滤泡细胞的碘摄取能力,而且对于分化型甲状腺癌术后的放射碘治疗也可发挥一定的临床调控作用。
AMPK在甲状腺癌中的作用尚未完全明确。Vidal等[16]应用免疫组织化学方法,检测tAMPK、pAMPK和pACC在正常甲状腺和PTC组织中均有表达,但在PTC中表达更强,认为AMPK激活在PTC发生中发挥了促进作用。还有研究认为,AMPK在甲状腺癌中具有抗增殖和促进细胞凋亡的作用;AICAR通过激活AMPK可抑制甲状腺乳头状癌细胞TPC-1和BCPAP的增殖、迁移,诱导凋亡,逆转TPC-1细胞的上皮间质转化;二甲双胍通过激活AMPK,可以抑制甲状腺未分化癌细胞的生长,促进其凋亡[17-18]。Klubo-Gwiezdzinska等[19]发现,二甲双胍通过抑制mTOR/p70S6K/pS6信号途径进而抑制甲状腺髓样癌细胞的生长,降低Cyclin D1和pERK的表达;但应用AMPK抑制剂或沉默AMPK后并不能阻止二甲双胍的作用。说明二甲双胍是通过多种机制来调节其抗肿瘤作用的。
本研究结果显示,pAMPK和pACC在PTC和结节性甲状腺肿中均有表达,且主要表达于细胞质中,PTC组织中表达更强,显著高于结节性甲状腺肿;Western blot法检测pAMPK和pACC蛋白在PTC组织中表达均显著高于结节性甲状腺肿组织(P<0.05);中央区淋巴结转移组和侧颈部淋巴结转移组中pAMPK和pACC的阳性表达率明显高于淋巴结未转移组(P<0.05);pAMPK和pACC在不同性别、年龄、肿瘤大小、双侧癌、多灶和侵犯包膜的阳性表达率差异无统计学意义(P>0.05)。这说明AMPK-ACC信号通路可能参与并促进了PTC的发生和淋巴结转移。在PTC的发生和发展的过程中,局部微环境出现能量缺失、缺氧,导致AMPK激活,抑制合成代谢促进分解代谢,为肿瘤细胞的生长提供了适宜的环境。同时,PTC发生中AMPK的激活多伴随碘摄取能力下降,进一步影响术后放射碘治疗的效果。
综上所述,AMPK在甲状腺癌不同发展阶段中的作用可能是双向的,在肿瘤的不同时期可能扮演了不同的角色,AMPK诱导的能量代谢在PTC中的作用还有待于更深入的研究。合理应用一些AMPK的调节化合物,不仅有助于减缓肿瘤的发展和转移,还会增强PTC术后放射碘治疗的效果。
[参考文献]
[1] 赵颂媛,马洪升.AMPK在肿瘤研究中的新进展[J].国际消化病杂志,2013,33(2):101-108.
[2] Andrade BM,Carvalho DP. Perspectives of adenosine monophosphate activated kinase(AMPK) signaling pathway in thyroid cancer[J]. Biosci Rep,2014,34(2):181-187.
[3] 徐彦楠,周晨明,姚胜杰,等.PI3K/AKT信号转导通路与肿瘤细胞增殖[J].河北医科大学学报,2015,36(1):107-109.
[4] Dandapani M,Hardie DG. AMPK:opposing the metabolic changes in both tumor cells and inflammatory cells?[J]. Biochem Soc Trans,2013,41(2):687-693.
[5] Lin CC,Yeh HH,Huang WL,et al. Metformin enhances cisplatin cytotoxicity by suppressing signal transducer and activator of transcription-3 activity independently of the liver kinase B1-AMP-activated protein kinase pathway[J]. Am J Respir Cell Mol Biol,2013,49(2):241-250.
[6] Vallianou NG,Evangelopoulos A,Kazazis C. Metformin and cancer[J]. Rev Diabet Stud,2013,10(4):228-235.
[7] Hou G,Zhang S,Zhang X,et al. Clinical pathological characteristics and prognostic analysis of 1,013 breast cancer patients with diabetes[J]. Breast Cancer Res Treat,2013,137(3):807-816.
[8] Snima KS,Pillai P,Cherian AM,et al. Anti-diabetic drug metformin:challenges and perspectives for cancer therapy[J]. Curr Cancer Drug Target,2014,14(8):727-736.
[9] 吴春丽,蔡峰,孙成英.AICAR对三阴性乳腺癌体外抑制作用及其机制的探讨[J].中华肿瘤防治杂志,2013,20(17):1310-1314.
[10] Sorokin DV,Scherbakov AM,Yakushina IA,et al. The mechanism of adaptation of breast cancer cells to hypoxia:role of AMPK/mTOR signaling pathway[J]. Bull Exp Biol Med,2016,160(4):555-559.
[11] Koperek O,Akin E,Asari R,et al. Expression of hypoxia-inducible factor 1 alpha in papillary thyroid carcinoma is associated with desmoplastic stromal reaction and lymph node metastasis[J]. Virchows Arch,2013,463(6):795-802.
[12] Wang N,Dong CR,Jiang R,et al. Overexpression of HIF-1α,metallothionein and SLUG is associated with high TNM stage and lymph node metastasis in papillary thyroid carcinoma[J]. Int J Clin Exp Pathol,2013,7(1):322-330.[13] Cazarin JM,Andrade BM,Carvalho DP. AMP-activated protein kinase activation leads to lysome-mediated NA(+)/(-)-symporter protein degradation in rat thyroid cells[J]. Horm Metab Res,2014,46(5):313-317.
[14] Andrade BM,Cazarin J,Zancan P,et al. AMP-activated protein kinase upregulates glucose uptake in thyroid PCCL3 cells independent of thyrotropin[J]. Thyroid,2012,22(10):1063-1068.
[15] Abdulrahman RM,Boon MR,Sips HC,et al. Impact of Metformin and compound C on NIS expression and iodine uptake in vitro and in vivo:a role for CRE in AMPK modulation of thyroid function[J]. Thyroid,2014,24(1):78-87.
[16] Vidal AP, Andrade BM,Valsman F,et al. AMP-activated protein kinase signaling is upregulated in papillary thyroid cancer[J]. Eur J Endocrinol,2013,169(4):521-528.
[17] Cazarin JM,Coelho RG,Hecht F,et al. 5'-AMP-activated protein kinase(AMPK) regulates papillary(TPC-1 and BCPAP) thyroid cancer cell survival,migration,invasion and epithelial-to-mesenchymal transition[J]. Thyroid,2016,26(7):933-942.
[18] Chen G,Nicula D,Renko K,et al. Synergistic anti-proliferative effect of metformin and sorafenib on growth of anaplastic thyroid cancer cells and their stem cells[J]. Oncol Rep,2015,33(4):1994-2000.
[19] Klubo-Gwiezdzinska J,Jensen K,Costello J,et al. Metformin inhibits growth and decreases resistance to anoikis in medullary thyroid cancer cells[J]. Endocr Relat Cancer,2012,19(3):447-456.
(本文编辑:刘斯静)
YAN Li1, LI Qing-huai1, JI Hong1, SHEN Wei1, GUO Hao1, WANG Chang-quan2
(1.Department of Thyroid and Breast Surgery, the Second Hospital of to Hebei Medical University, Shijiazhuang 050000, China; 2.Department of General Surgery, Anguo City Hospital, Hebei Province, Anguo 071200, China)
Abstract:Objective To investigate the expression and significance of AMPK-ACC signaling pathway in papillary thyroid cancer(PTC) by studying the expression of phosphorylated AMP-activated protein kinase(pAMPK) and phosphorylated acetyl-CoA carboxylase(pACC) in tissues of PTC and their relations to the clinicopathological features. Methods The expression of pAMPK and pACC in tissues of 60 cases of PTC and 20 cases of nodular goiter were detected by immunohistochemical and western blot, and the relationship with age, gender, tumor size, bilateral, multifocal, capsular invasion, lymph node metastasis was analyzed. Results The expression of pAMPK and pACC in tissues of PTC was significantly higher than that in nodular goiter tissues(P<0.05). The expression of pAMPK and pACC in central lymphatic metastases of PTC was significantly higher than that in PTC without central lymphatic metastases(P<0.05). The expression of pAMPK and pACC in lateral lymphatic metastases of PTC was significantly higher than that in PTC without lateral lymphatic metastases(P<0.05). Age, gender, tumor size, bilateral carcinoma, multifocal and capsular invasion were not related to the expression of pAMPK and pACC in PTC(P>0.05). Western blot detection showed pAMPK and pACC expressions in PTC tissue were significantly higher than in nodular goiter(P<0.05). Conclusion pAMPK and pACC are significantly up-regulated in PTC, and the increased degree was closely related to neck lymph node metastasis. The activation of AMPK-ACC signaling pathway may play a role in promoting the occurrence of PTC.
[Key words]thyroid neoplasms; lymph nodes; gene expression regulation, enzymologic
[收稿日期]2016-07-07;
[修回日期]2016-11-08
[基金项目]河北省医学科学研究重点课题(20150228)
[作者简介]严丽(1977-),女,河北石家庄人,河北医科大学第
[中图分类号]R736.1
[文献标志码]A
[文章编号]1007-3205(2016)11-1270-06
doi:10.3969/j.issn.1007-3205.2016.11.008
二医院副主任医师,医学博士,从事甲状腺疾病诊治研究。