·论 著·
张素欣1,李 丹2,陈 中1,张雨温1*,张晋弘3,许彦枝1
(1.河北医科大学第四医院口腔科,河北 石家庄 050011;2.河北医科大学第一医院耳鼻喉科,河北 石家庄 050031;3.河北医科大学第一医院口腔科,河北 石家庄 050031)
[摘要]目的探讨复发性口腔溃疡(recurrent aphthous ulceration,RAU)患者唾液中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素6 (interleukin-6, IL-6)含量变化及临床意义。方法选取RAU患者30例,其中溃疡期组18例,间歇期组12例; 30例健康志愿者为正常对照组。采用酶联免疫吸附测定法检测3组唾液中的TNF-α及IL-6含量。结果3组TNF-α含量差异有统计学意义,溃疡期组和间歇期组高于对照组,而间歇期组高于溃疡期组(P<0.05)。3组IL-6差异无统计学意义(P>0.05)。RAU患者唾液中TNF-α与IL-6含量变化无相关性(r=-0.090,P=0.638)。结论唾液中TNF-α含量升高可能是RAU的主要发病因素之一。
[关键词]口腔溃疡;唾液;白细胞介素6; 肿瘤坏死因子α
复发性口腔溃疡(recurrent aphthous ulceration,RAU)是一种常见的口腔黏膜病,多发生于角化差的黏膜上,以表浅的、疼痛的、复发性、有自愈性的溃疡为特点,发病率为20%~50%,其中70%~87%的患者为轻型阿弗他溃疡,即口腔黏膜上长有1~5个直径在3~10 mm之间的散在溃疡,溃疡发作时没有特殊的全身症状,但局部明显的反复发作的疼痛,严重影响着患者的饮食、发音、吞咽及情绪[1]。虽然学者们在不断地进行研究,但RAU的发病机制仍然不甚明了,临床上为减轻患者痛苦往往依赖于激素类药物[2]。从已知的RAU发展过程来看,它的产生可能是外源性或内源性抗原刺激角质形成细胞,分泌T细胞活化因子,进而破坏口腔上皮并使其裂解的结果,但究竟是哪些细胞因子在RAU的发病过程中起着决定性的作用,又是什么原因导致了这些细胞因子的改变,目前尚无定论。本研究测定RAU患者唾液中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素6 (interleukin-6, IL-6)的含量,探讨RAU的发病机制,旨在为临床治疗提供思路。
1.1 一般资料 选取2012年4—10月河北医科大学第四医院口腔门诊就诊的RAU患者30例,其中溃疡期组18例,间歇期组12例。溃疡期组男性7例,女性11例,年龄10~35岁,平均(23.5±5.8)岁;间歇期组男性5例,女性7例,年龄18~32岁,平均(24.2±4.1)岁。同时选取30例健康志愿者为正常对照组,男性10例,女性20例,年龄19~33岁,平均(23.3±3.2)岁。纳入标准: 所有患者均为在过去1年内每月至少发病1次,发作时溃疡有“红、黄、凹、痛”特征,无系统性疾病或炎症性疾病,无其他口腔黏膜病,无牙周病,无头颈部放疗史,近1个月内未服用过任何药物。受试者均无吸烟史。
本研究获得医院伦理委员会批准和受试者知情同意。
1.2 试剂及仪器 人TNF-α试剂盒、人IL-6试剂盒(美国RD公司),ELX-800酶标仪(美国宝特公司)。
1.3 方法
1.3.1 样本采集 在上午8:00~11:00采集受试者非刺激性唾液3 mL,3 000 r/min,离心30 min后取上清,-80 ℃保存。
1.3.2 酶联免疫吸附测定法检测唾液中TNF-α及IL-6含量 所有操作步骤按美国RD公司提供的人TNF-α试剂盒、人IL-6试剂盒说明书进行。采用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中人TNF-α及 IL-6的浓度。
1.4 统计学方法 应用SPSS 13.0统计软件进行数据处理。计量资料比较分别采用单因素方差分析和SNK-q检验;相关性采用Pearson直线相关分析。P<0.05为差异有统计学意义。
3组TNF-α的含量差异有统计学意义,溃疡期组和间歇期组高于对照组,而间歇期组高于溃疡期组(P<0.05);3组IL-6含量差异无统计学意义(P>0.05)。见表1。
Pearson直线相关分析结果显示,RAU患者唾液中TNF-α与IL-6含量变化无相关性(r=-0.090,P=0.638)。
表1 3组唾液中 TNF-α和IL-6含量比较
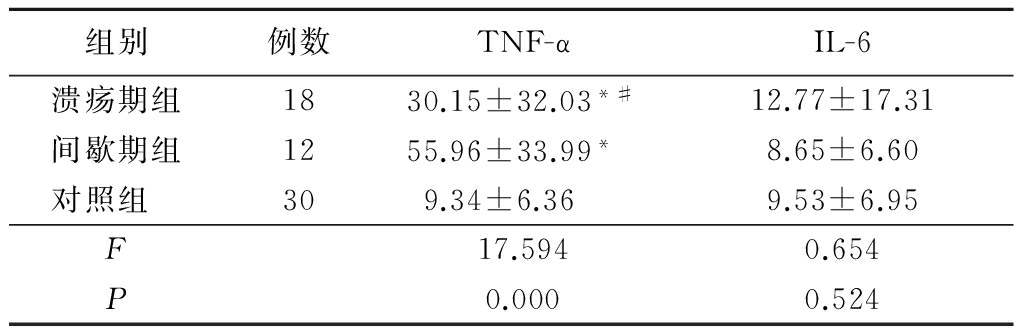
*P<0.05与对照组比较 #P<0.05与间歇期组比较(SNK-q检验)
RAU是一种常见的口腔黏膜病损,特点是无明显诱因地反复出现溃疡性病变,且与身体其他部位溃疡病或潜在性系统疾病无关[3]。关于RAU复杂的发病机制,学者们之间存有争论,讨论最多的是不同的诱发因素,如遗传、免疫、过敏、微生物、消化、内分泌、情感或外伤性因素等[4-6],但这些诱发因素致病的明确发病机制却缺乏证据。
TNF-α是由单核细胞、淋巴细胞、自然杀伤细胞及人肿瘤细胞产生的细胞因子,是一种在恶病质患者体内发现的促炎细胞因子,与动物和人类肿瘤发生的出血性坏死有关[7]。关于TNF-α与RAU的关系,早期报道TNF-α很难在RAU患者的血清中检测到,后来发现急性期RAU患者外周血白细胞TNF-α分泌量显著高于健康人,在溃疡的组织切片中也已探测到高水平TNF-α的表达。本研究发现,溃疡期RAU患者和间歇期RAU患者唾液中TNF-α水平明显高于对照组,差异有统计学意义。提示TNF-α可能是RAU的发病因素之一,分析原因如下。①RAU患者口腔黏膜上皮细胞中TNF-α免疫活性减弱:因为诱导TNF-α产生的因素有内毒素、病毒、免疫复合物、神经肽P物质、IL-1等。快速分泌及免疫诱导性TNF-α主要来源于肥大细胞与嗜碱性粒细胞。TNF-α通过内分泌、旁分泌和自分泌发挥生物学作用,但TNF-α介导的组织器官病理生理效应可能主要取决于特定组织的旁分泌和或自分泌作用。研究证实,TNF-α与许多自身免疫和炎症疾病有关,包括系统性红斑狼疮、风湿性关节炎、银屑病等[8-9]。Sun等[10]认为TNF-α(rs1800629和rs1800630)基因型分布的不同是RAU产生的敏感因素。②细胞黏附分子引发的细胞不良反应,促使唾液中TNF-α含量升高:以往的研究表明,溃疡的始动因素是未知抗原刺激黏膜角质形成细胞,释放细胞因子和白介素,淋巴细胞、中性粒细胞和郎格汉斯细胞发生迁移,导致血管细胞黏附分子1和细胞黏附分子1过表达,招募淋巴细胞聚集,造成上皮内淋巴细胞浸润。有些细胞因子可以刺激主要组织相容性抗原在上皮基底细胞层过表达,这些细胞被T淋巴细胞识别并引发细胞毒性反应,上皮细胞凋亡[11],激活细胞介导免疫,TNF-α等炎症性细胞因子释放,最终可能通过NF-κB通路导致口腔黏膜上皮完整性遭到破坏,黏膜出现坏死和溃疡[12]。③抑制TNF-α分泌水平,可以在一定程度上控制RAU的病情进展:如沙利度胺、己酮可可碱、左旋咪唑、前列腺素E[13]可以有效地治疗RAU和其溃疡性疾病如白塞病。但是这些药物都有严重的不良反应,不能广泛用于临床,而且目前没有哪种单一的治疗方式是有效的[14],需要针对患者的个体差异进行个性化治疗,故监测RAU患者的TNF-α水平变化,找到特异而低毒的TNF-α抑制剂,进行精准性干预,是治疗RAU亟待解决的问题。
本研究还发现,与RAU溃疡期患者相比,RAU间歇期患者唾液TNF-α水平更高。提示与在RAU溃疡期上皮细胞裂解和细胞毒性中的作用相比,TNF-α在愈合阶段中的作用更重要,原因可能是细胞介导免疫的异常激活,造成黏膜自我保护和抑制能力的平衡被打破,从而使口腔黏膜抵抗病原微生物的能力下降而发病,TNF-α等细胞因子可以通过下调过度的免疫反应而抑制炎症的发生发展,且促进上皮损伤后修复,从而使溃疡炎症局限,但是因为机体调节的复杂性,细胞因子在RAU免疫反应中的作用机制仍在探索中[14]。IL-6是一种由巨噬细胞、T细胞、B细胞等多种细胞产生的淋巴因子,能使B细胞前体成为产生抗体的细胞;与集落刺激因子协同,能促进原始骨髓源细胞的生长和分化,增强自然杀伤细胞的裂解功能。IL-6在免疫应答及炎症反应中均起着重要作用,它可以通过细胞因子网络影响宿主环境进而作用于肿瘤细胞,对肿瘤细胞有抑制和促进的双重作用[15]。本研究检测出RAU溃疡期和间歇期患者唾液中IL-6水平与健康人差异无统计学意义。提示在RAU的发病过程中,唾液IL-6水平的改变与该病的发生发展关系不密切,出现这种结果的原因可能是:①IL-6是一种炎性因子, 具有促炎和抗炎的双重作用;②RAU致病抗原具有多样性,不同抗原刺激产生不同的细胞因子;③本研究样本量小,有待于增加样本量来进一步证实RAU患者唾液中IL-6水平与健康人的差异;④本研究检测的IL-6来源于唾液,非血液和组织,样本来源不同,得出的结论会存在分歧。Karakus等[5]认为在RAU中IL-6水平发生变化的原因是IL-6 C-174C基因的多态性,这种基因多态性的改变决定着IL-6含量的变化。
有报道认为,TNF-α与IL-6等细胞因子间可能会有协同作用,TNF-α的增加可引起IL-6等细胞因子发生数量与功能上的变化,从而使细胞因子网络的平衡受到破坏,机体产生病理改变,导致溃疡形成或愈合。但本研究直线相关分析的结果并不支持在RAU发病过程中,TNF-α和IL-6之间有协同作用的假说,这一点可能与上述IL-6的基因多态性有关。
总之,唾液TNF-α的升高是RAU的发病过程中一个重要环节,可以针对这一点研发新的低毒有效药物,减少RAU的复发率。唾液IL-6在RAU发病过程中有升高,具体作用还有待于进一步证实。
[参考文献]
[1] Liu C,Zhou Z,Liu G,et al. Efficacy and safety of dexamethasone ointment on recurrent aphthous ulceration[J]. Am J Med,2012,125(3):292-301.
[2] Sun M,Fu SM,Dong GY,et al. Inflammatory factors gene polymorphism in recurrent oral ulceration[J]. J Oral Pathol Med,2013,42(7):528-534.
[3] Tappuni AR,Kovacevic T,Shirlaw PJ,et al. Clinical assessment of disease severity in recurrent aphthous stomatitis[J]. J Oral Pathol Med,2013,42(8):635-641.
[4] Hijazi K,Lowe T,Meharg C,et al. Mucosal microbiome in patients with recurrent aphthous stomatitis[J]. J Dent Res,2015,94(3 Suppl):87S-94S.
[5] Karakus N,Yigit S,Rustemoglu A,et al. Effects of interleukin (IL)-6 gene polymorphisms on recurrent aphthous stomatitis[J]. Arch Dermatol Res,2014,306(2):173-180.
[6] 杜芹,田馄,廖楚航,等.复发性阿弗他溃疡Th1/Th2细胞因子的检测[J].成都医学院学报,2013,8(6):657-660.
[7] Bagan J,Saez G,Tormos C,et al. Oxidative stress and recurrent aphthous stomatitis[J]. Clin Oral Investig,2014,18(8):1919-1923.
[8] Al-Samadi A,Drozd A,Salem A,et al. Epithelial Cell Apoptosis in Recurrent Aphthous Ulcers[J]. J Dent Res,2015,94(7):928-935.
[9] 张敬,王婷婷,漆明,等.复发性阿弗他溃疡患者外周血中TGF-β1和 IL-10的表达水平及其临床意义[J].实用口腔医学杂志,2014,30(1):82-84.
[10] Sun M,Fu SM,Dong GY,et al. Inflammatory factors gene polymorphism in recurrent oral ulceration[J]. J Oral Pathol Med,2013,42(7):528-534.
[11] Shi L,Wan K,Tan M,et al. Risk factors of recurrent aphthous ulceration among university students[J]. Int J Clin Exp Med,2015,8(4):6218-6223.
[12] Gunhan O,Gunal A,Avci A,et al. Oral epithelial barrier function and the role of nuclear factor kappa-beta pathway in the pathogenesis of aphthous ulceration[J]. Turk J Gastroenterol,2013,24(6):508-514.
[13] Chen H,Sui Q,Chen Y,et al. Impact of haematologic deficiencies on recurrent aphthous ulceration:a meta-analysis[J]. Br Dent J,2015,218(4):E8.
[14] Brocklehurst P,Tickle M,Glenny AM,et al. Systemic interventions for recurrent aphous stomatitis(mouth ulcers)[J]. Cochrane Database Syst Rev,2012,12(9):CD005411.
[15] 田贵金,唐瑞峰,孙超,等.白细胞介素2和白细胞介素6对肝癌细胞表达血管内皮生长因子B的调节[J].河北医科大学学报,2014,35(2):142-145.
(本文编辑:刘斯静)
ZHANG Su-xin1, LI Dan2, CHEN Zhong1, ZHANG Yu-wen1*, ZHANG Jin-hong2, XU Yan-zhi1*
(1.Department of Stomatology, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China; 2.Department of Stomatology, the First Hospital of Hebei Medical University, Shijiazhuang 050031, China; 3.Department of Stomatology, the First Hospital of Hebei Medical Unniversity, Shijiazhuang 050031, China)
Abstract:Objective To evaluate salivary interleukin(IL)-6 and tumor necrosis factor(TNF)-α of patients with recurrent aphthous ulceration(RAU). Methods A total of 30 patients with RAU were selected as the research subjects, including 18 cases of ulcer and 12 cases of intermittent period. Thrity healthy volunteers were used as normal control. TNF-α and IL-6 levels were determined by using enzyme-linked immunosorbent assay. Results The content difference of TNF-α in the 3 groups was statistically significant, the ulcer phase and the interval group were higher than those in the control group, while the interval group was higher than that of the ulcer group, the difference was statistically significant(P<0.05) . In the IL-6 content, there was no significant difference between the 3 groups(P>0.05). There was no correlation between the levels of TNF-α and IL-6 in saliva of RAU patients(r=-0.090,P=0.638). Conclusion TNF-α content increased in saliva may be one of the main risk factors of RAU etiology.
[Key words]oral ulcer;saliva;interleukin-6;tumor necrosis factor-alpha
[收稿日期]2015-11-23;
[修回日期]2016-01-22
[基金项目]河北省医学科学研究重点课题(20110504)
[作者简介]张素欣(1972-),女,河北石家庄人,河北医科大学第四医院副主任医师,医学博士,从事口腔疾病诊治研究。
*通讯作者。E-mail:649589734@qq.com
[中图分类号]R781.5
[文献标志码]A
[文章编号]1007-3205(2012)11-1285-04
doi:10.3969/j.issn.1007-3205.2016.11.012