陈云霞,司 捷,赵淑玲,刘春燕,张艳平,苏俊平
(河北省沧州市人民医院内分泌科,河北 沧州 061000)
[摘要]目的研究咀嚼运动对不同糖耐量人群能量摄入和胃肠激素浓度的作用。方法招募正常体质量志愿者16例、糖调节受损者18例、2型糖尿病患者20例和肥胖者14例,比较不同咀嚼次数下能量摄入情况和胃肠激素浓度。结果组内比较显示4组中咀嚼次数40次/口的摄入能量均低于15次/口(P<0.05)。15次/口和40次/口咀嚼次数时糖调节受损组、2型糖尿病组、肥胖组的能量摄入均高于体质量正常组,差异有统计学意义(P<0.05)。不同组间和不同咀嚼次数空腹VAS评分和饱食VAS评分差异均无统计学意义(P>0.05)。体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血糖浓度组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05)。体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长胰岛素浓度均呈先升高再降低的趋势,时点间差异有统计学意义(P<0.05),组间、组间·时点间交互作用差异均无统计学意义(P>0.05)。体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血浆胃促生长素浓度均呈先降低再升高的趋势,GLP-1浓度和血浆胆囊收缩素浓度均呈先升高再降低的趋势,且40次/口时血浆胃促生长素浓度低于15次/口,GLP-1浓度和血浆胆囊收缩素浓度高于15次/口,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。结论增加咀嚼次数可以减少一餐的能量摄入,这种调节作用可能是通过胃促生长素、GLP-1和胆囊收缩素等胃肠激素介导的。进食时增加咀嚼次数在糖耐量异常和2型糖尿病的预防和治疗中可能起到一定的辅助作用。
[关键词]咀嚼;能量摄取;胃肠激素类
高糖和高脂饮食、进食速度过快、暴饮暴食等饮食习惯易导致肥胖,增加2型糖尿病的发生风险,但作为摄食第一步的咀嚼却没有引起人们的足够重视。近年来发现,进餐后分泌的胃肠道激素如胃促生长素、胰高血糖素样肽1(glucagon-like peptide1,GLP-1)与肥胖、2型糖尿病的发生发展密切相关。本研究观察咀嚼运动对不同糖耐量人群能量摄入和胃肠激素浓度的影响,旨在探讨咀嚼次数在肥胖及2型糖尿病预防和治疗中可能的作用机制。现报告如下。
1.1 一般资料 本研究根据国际肥胖工作小组对亚洲人肥胖的判断标准[1],体质量指数(body mass index,BMI)为18.5~23.0判定为体质量正常,BMI≥25判定为肥胖,招募了体质量正常者16例和肥胖志愿者14例,排除糖尿病、冠心病、继发性肥胖等。另根据1999年世界卫生组织制定的糖尿病诊断标准,招募2型糖尿病患者20例和糖调节受损者18例。体质量正常组男性9例,女性7例,年龄17~22岁,平均(20.8±0.8)岁,身高(174.8±5.2) cm;肥胖组男性8例,女性6例,年龄16~21岁,平均(20.4±0.7)岁,身高(176.5±17.8) cm;2型糖尿病组男性9例,女性11例,年龄17~21岁,平均(20.7±0.4)岁,身高(171.2±10.1) cm;糖调节受损组男性10例,女性8例,年龄19~23岁,平均(21.2±0.6)岁,身高(172.6±4.9) cm。4组性别、年龄、身高差异无统计学意义(P>0.05),具有可比性。
所有受试者均无严重心、肝、肺、肾及脑血管等重大疾患;无任何感染;无其他内分泌代谢性疾病;无手术及其他应激情况;近期无使用抗生素、甾体或非甾体类药物;均不吸烟,且早餐规律进食,牙齿健康,无口腔疾病,无食物过敏,且有较低的饮食限制分数(three-factor eating questionnaire restraint score≤13)[2];糖调节受损者仅行改变生活方式或联合应用口服降糖药治疗,未应用二肽基肽酶Ⅳ抑制剂、GLP-1类似物、胰岛素及其类似物治疗。
本研究获得河北沧州市人民医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 人体测量 主要包括身高、体质量、腰围、臀围和体脂含量。
1.3 研究方法 研究咀嚼运动对正常、肥胖、糖调节受损及2型糖尿病人群能量摄入和胃肠激素浓度的影响。依从性不好的受试者数据在统计分析时会被剔除。
进行咀嚼干预时选择的较少咀嚼次数和较多咀嚼次数分别为15次/口和40次/口。受试者进行2组试验,每组试验连续3 d。第1天进行预试验,便于让受试者适应试验流程;第2天,观察不同咀嚼次数对能量摄入的作用,记录受试者摄入总能量,评价其能量摄入情况;第3天,观察不同咀嚼次数对胃肠激素的作用。为了降低前1 d晚上的饮食对第2天胃肠激素浓度的影响[3],在试验前1 d的19:00给受试者提供标准晚餐,晚餐含2 800 kJ能量,能量构成为碳水化合物占总能量的60%、脂肪占22%、蛋白质占18%。晚餐后,受试者除了喝水外不能吃任何东西。第2天早上,07:00~07:30进行试验。
试验第1天,给每位受试者提供300 g馅饼。所有受试对象每口食物大约10 g,为了避免每口食物大小对试验结果的干扰,将馅饼切成10 g大小的不规则小块,试验时每口吃一块。受试者需要练习每口咀嚼15次或40次,受试者的摄食量不设限制,如果300 g馅饼不够,可以继续追加,记录总摄食量。整个早餐时间控制在30 min之内。受试者进餐过程中面前放置摄像机,记录进餐时的咀嚼情况。试验结束后,对录制的视频进行分析处理。预试验时,每位受试者需要练习每口咀嚼15次或40次,并用视觉模拟评分(Visual Analogue Scale,VAS)问卷,标记饥饿和饱的感觉。VAS问卷在餐前以及餐后30、60、90、120和180 min进行标记,每次标记完问卷即进行肘静脉采血。
试验第2天,观察不同咀嚼次数对一餐能量摄入的影响。给每个受试者提供300 g馅饼,切成10 g大小的不规则小块。受试者在进餐时每口食物吞咽前需要咀嚼15次或40次,进餐期间自由饮水。受试者的摄食量不设限制,如果300 g馅饼不够,可以继续追加,记录总摄食量。受试者进餐过程中面前放置摄像机,记录进餐时的咀嚼情况,以验证受试者在进餐过程中是否咀嚼了正确的次数。
试验第3天,观察不同咀嚼次数对胃肠激素浓度的影响。为了避免不同的能量摄入对胃肠激素浓度的影响,所有受试者的能量摄入限制为2 200 kJ。受试者在进餐时每口食物吞咽前需要咀嚼15次或40次,进餐期间自由饮水,整个进餐过程在30 min内完成。在0(进餐开始前)、30、60、90、120、180 min收集血样。受试者进餐过程中面前放置摄像机,记录进餐时的咀嚼情况,以验证受试者在进餐过程中是否咀嚼了正确的次数。
1.4 血糖及激素检测 血糖浓度用氧化酶-过氧化物酶法进行检测。血浆总胃促生长素、胆囊收缩素和GLP-1度用ELISA试剂盒进行检测。这些试剂盒的最低检出限分为胃促生长素0.02 μg/L、胆囊收缩素0.05 μg/L、GLP-1 0.14 μg/L。试剂盒的组内误差为5%~10%,组间误差为15%。
1.5 统计学方法 应用SPSS 16.0 统计软件分析数据。计量资料比较分别采用独立样本t检验、单因素方差分析、q检验和重复测量方差分析。P<0.05为差异有统计学意义。
2.1 人体测量学数据 肥胖组体质量、BMI、腰围、臀围、腰臀比和体脂含量均显著高于2型糖尿病组、糖调节受损组及体质量正常组,2型糖尿病组BMI高于体质量正常组,差异有统计学意义(P<0.05)。2型糖尿病组、糖调节受损组、体质量正常组体质量、腰围、臀围、腰臀比和体脂含量差异无统计学意义(P>0.05),糖调节受损组和体质量正常组BMI差异无统计学意义(P>0.05)。见表1。
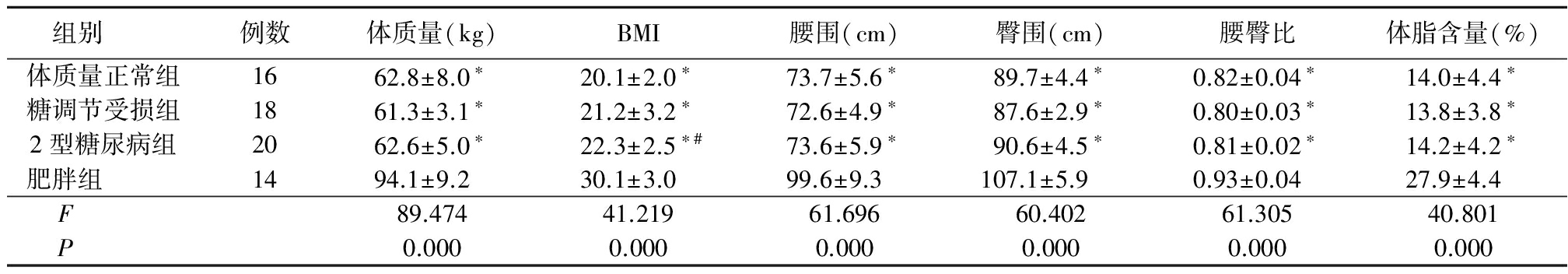
P<0.05与肥胖组比较 #P<0.05与体质量正常组比较(q检验)
2.2 摄取能量比较 组内比较显示4组在咀嚼次数40次/口的摄入能量均低于15次/口(P<0.05)。40次/口咀嚼次数时糖调节受损组、2型糖尿病组、肥胖组的能量摄入均高于体质量正常组,差异有统计学意义(P<0.05)。糖调节受损组、2型糖尿病组、肥胖组摄入能量差异无统计学意义(P>0.05)。见表2。
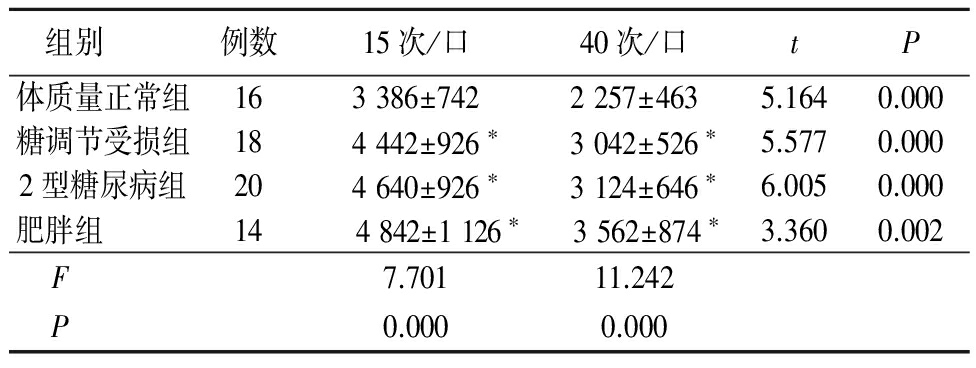
*P<0.05与体质量正常组比较(q检验)
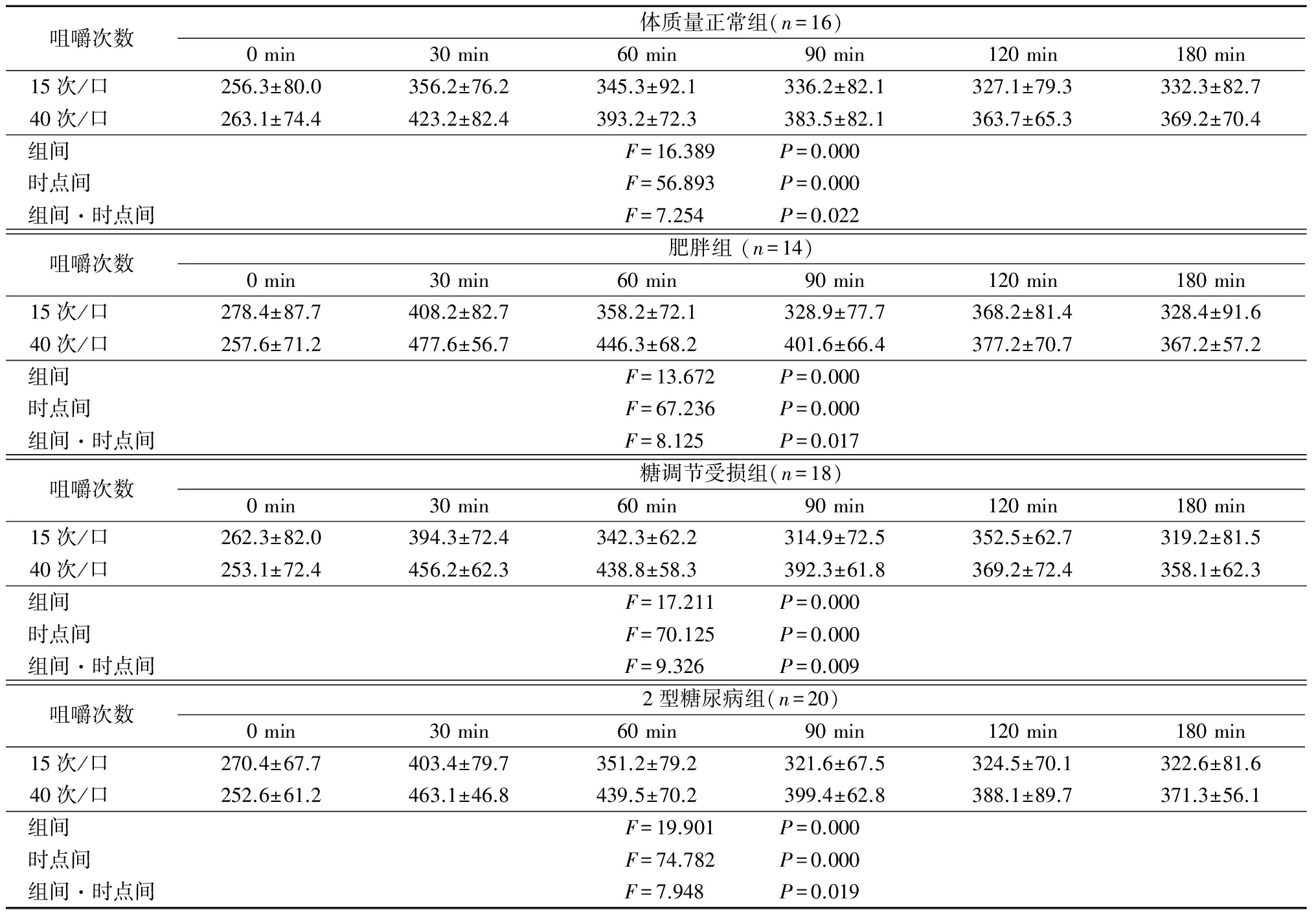
2.3 咀嚼次数对血糖及胰岛素的影响 不同组间和不同咀嚼次数空腹VAS评分和饱食VAS评分差异均无统计学意义(P>0.05)。体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血糖浓度组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05)。体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长胰岛素浓度均呈先升高再降低的趋势,时点间差异有统计学意义(P<0.05),组间、组间·时点间交互作用差异均无统计学意义(P>0.05)。见表3~5。
表3 不同咀嚼干预下的食欲评分比较![]() 分)
分)
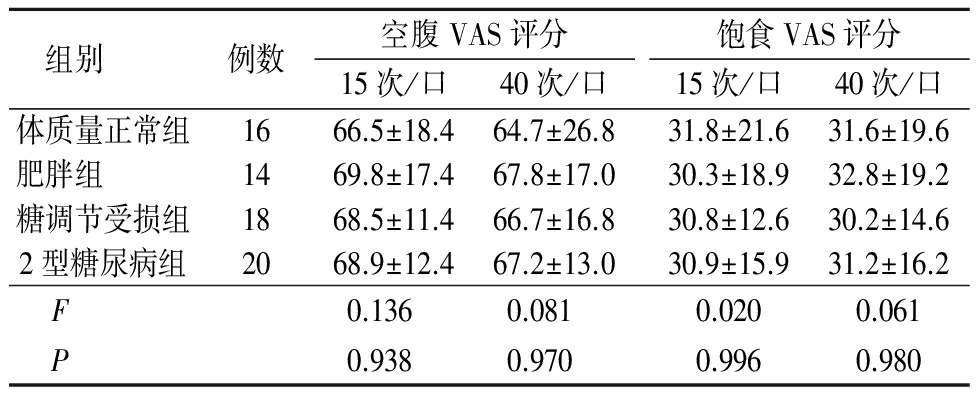
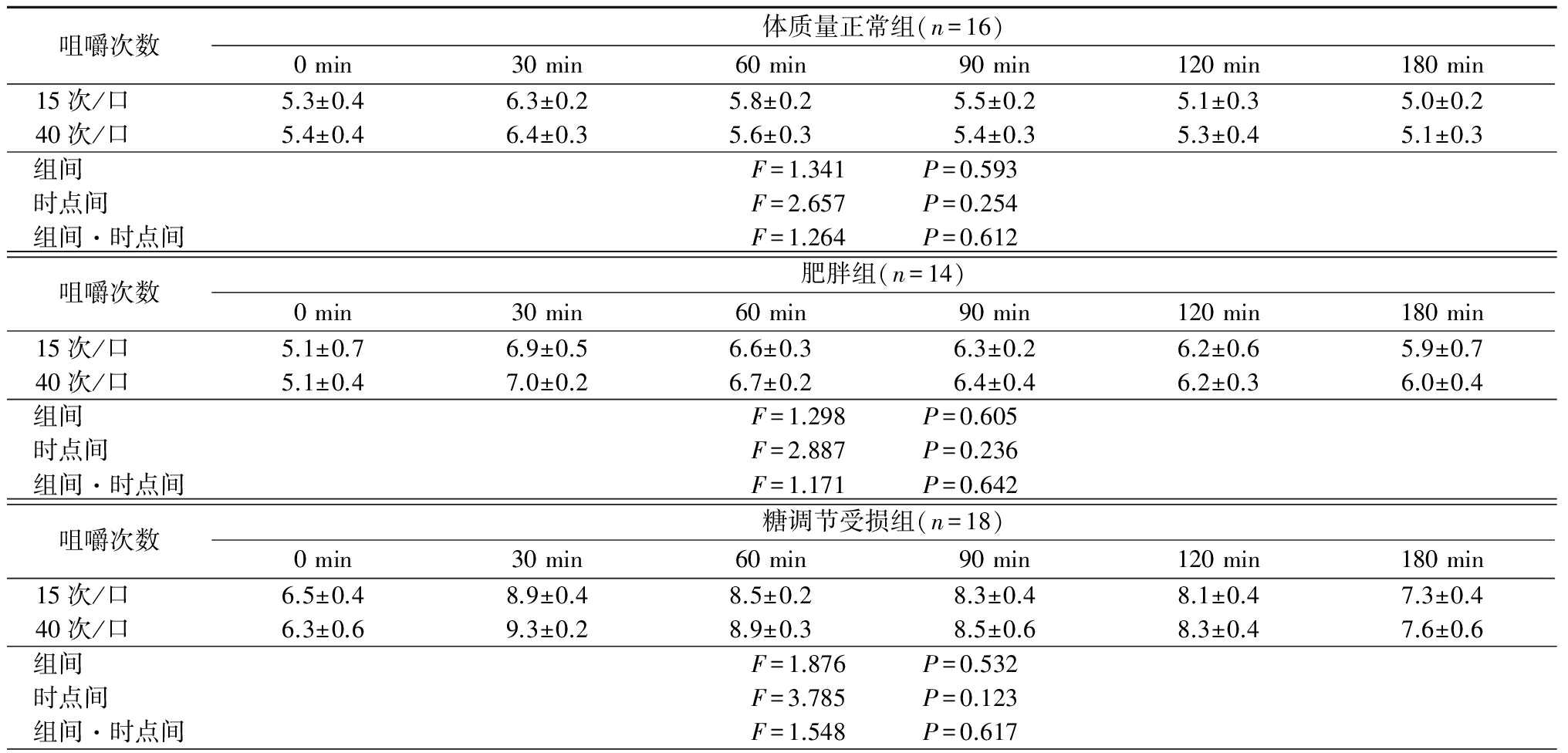
表4 (续)

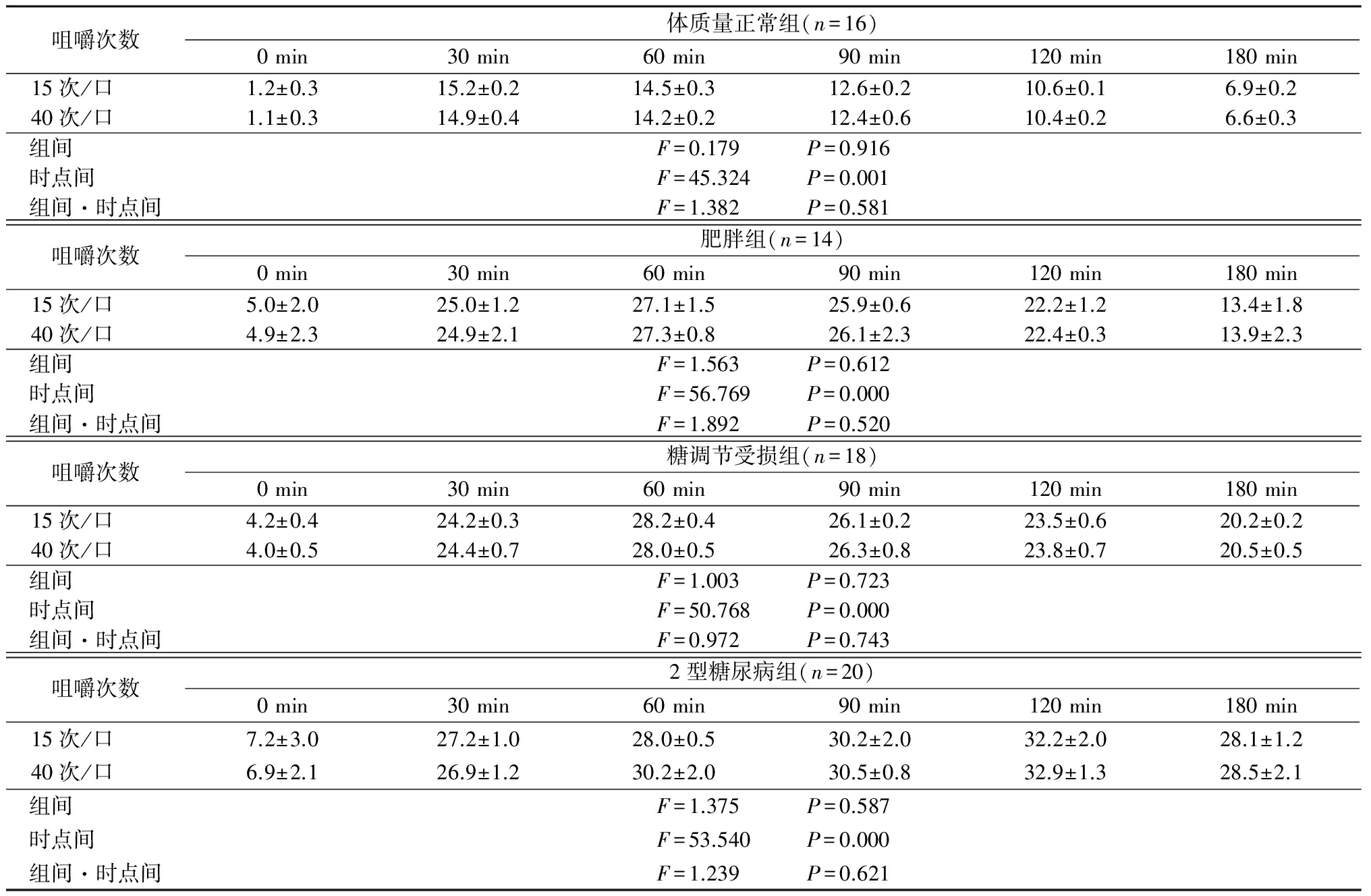
2.4 咀嚼对胃肠激素的影响
2.4.1 血浆胃促生长素浓度 体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血浆胃促生长素浓度均呈先降低再升高的趋势,且40次/口时血浆胃促生长素浓度低于15次/口,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表6。
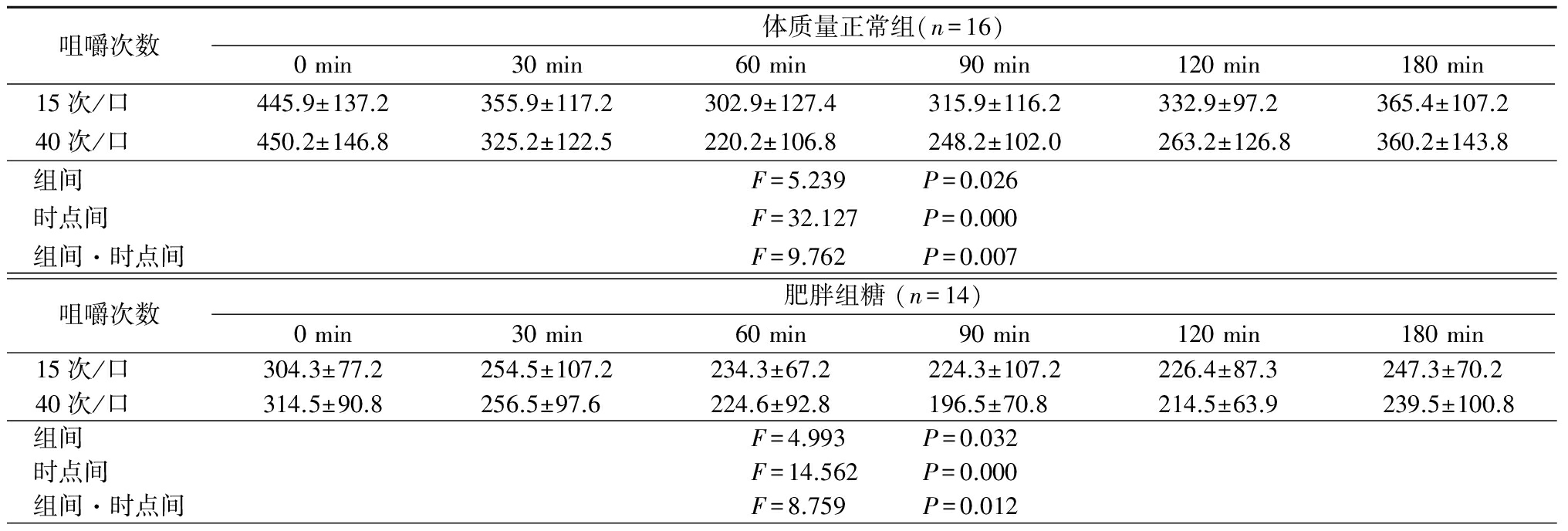
表6 (续)
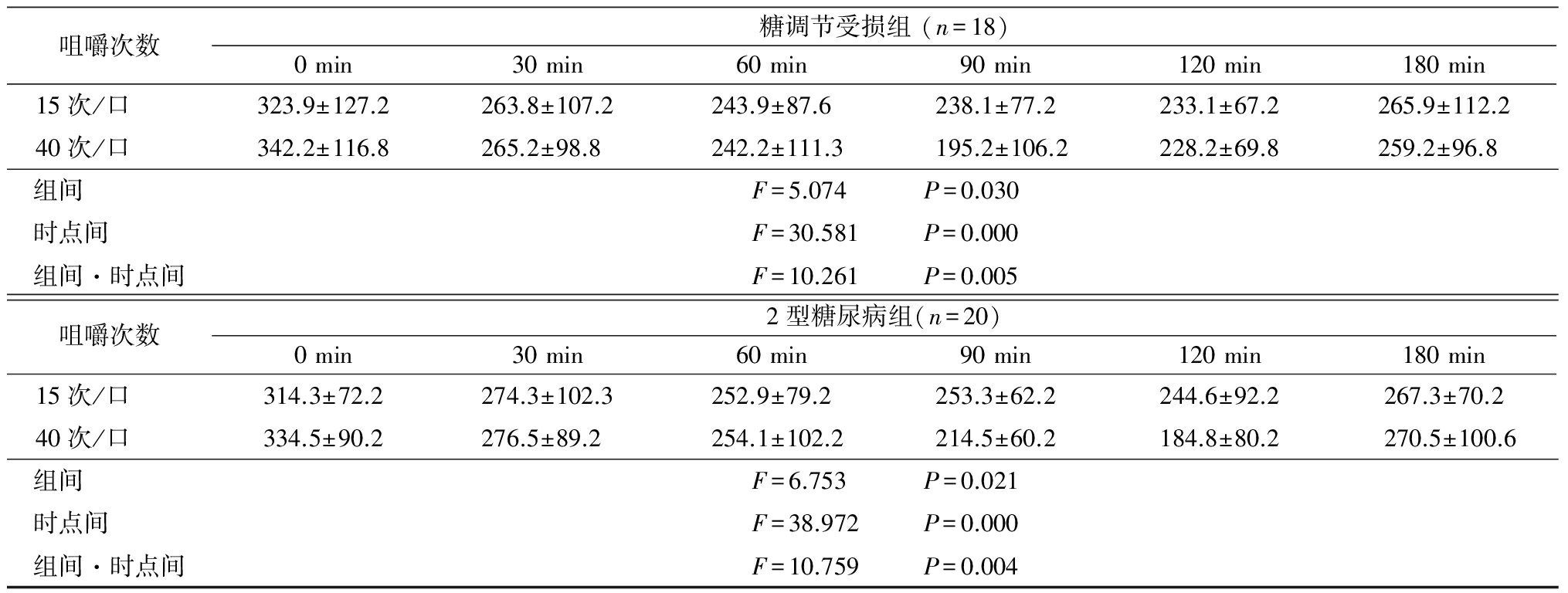
2.4.2 血浆GLP-1浓度 体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长GLP-1浓度均呈先升高再降低的趋势,且40次/口时GLP-1浓度高于15次/口,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表7。
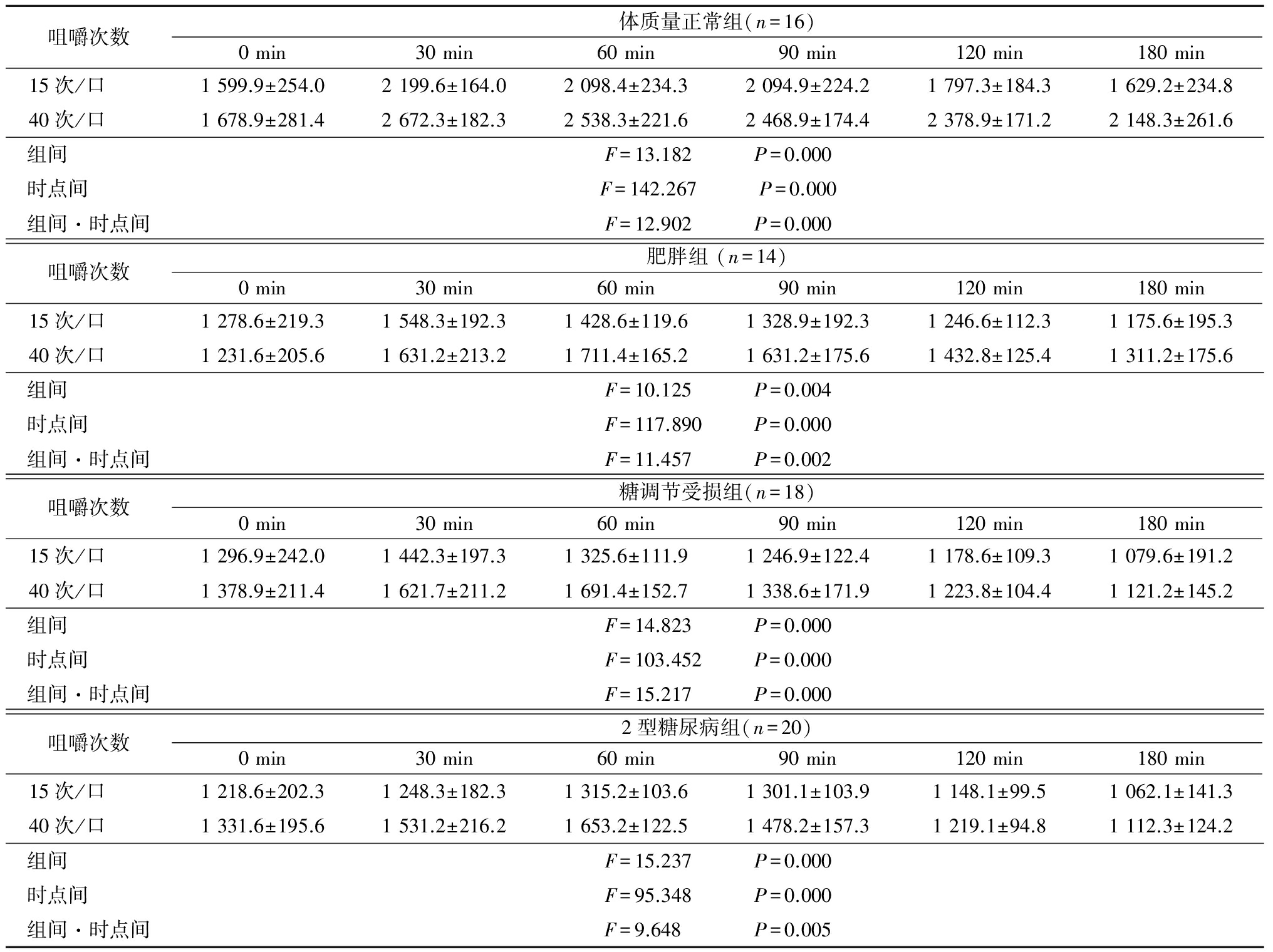
2.4.3 血浆胆囊收缩素浓度 体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血浆胆囊收缩素浓度均呈先升高再降低的趋势,且40次/口时血浆胆囊收缩素浓度高于15次/口,组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05),见表8。
研究表明一些饮食行为,如高糖和高脂饮食、进食速度过快、暴饮暴食进食对2型糖尿病、超体质量或肥胖的形成都有很大的影响[4-5]。本研究显示在15次/口和40次/口咀嚼次数时糖调节受损组、2型糖尿病组、肥胖组的能量摄入均高于体质量正常组。表明无论糖调节受损人群、2型糖尿病人群、肥胖人群,其能量摄入均高于正常人群,体现出能量摄入与血糖及BMI的相关性。最新研究将2型糖尿病描述为一种多相的紊乱,包括糖代谢、脂代谢以及胃肠运动与分泌,最终出现胰岛素抵抗或胰岛素分泌缺陷导致高血糖症,并恶性循环。高糖高脂毒性诱导胰岛细胞凋亡,减少β细胞数量,加重胰岛素抵抗和餐后胰岛素分泌缺陷[6-8]。而胃肠道可以分泌抗胰岛素分泌肽与促胰岛素分泌肽,通过“肠-胰轴”作用于胰岛细胞,调节胰岛素的分泌。正常情况下,进食后营养物质到达小肠引起葡萄糖依赖的肠促胰岛素分泌增加,从而使胰岛素分泌增加,最后通过负反馈作用产生肠抗胰岛素调节胰岛素的作用,保持餐后血糖稳定。在病理状态下,出现的肠抗胰岛素和促胰岛素分泌的失衡将导致胰岛素抵抗和2型糖尿病发生。胃肠激素在调节体质量和能量平衡的过程中发挥着重要的生理和病理生理学作用,并且许多科学家相信胃肠激素可能是将来治疗2型糖尿病、肥胖的潜在的有效靶点。
而咀嚼的主要功能是在吞咽前将食物磨成细小的颗粒,从而有利于营养物质从食物中释放出来,进而影响胃肠感受信号、胃肠蠕动,最终影响消化和吸收过程。一些研究发现进食速度过快、咀嚼不够细致都与2型糖尿病、肥胖密切相关[9-10]。本研究也发现,在同一人群中,咀嚼次数越多,其摄入的能量就越少,表明咀嚼对人体的能量摄入起着非常重要的作用。研究表明,胃肠激素在能量稳态平衡调节中发挥重要作用。咀嚼是进食过程中刺激头部应答的一个重要因素[3,11],本研究结果显示,无论糖耐量如何、体质量如何,咀嚼40次/口血浆胃促生长素浓度显著低于咀嚼15次/口,相应的,血浆GLP-1和胆囊收缩素浓度显著高于咀嚼15次/口。表明咀嚼与胃肠激素有着密切的关联。
胃促生长素是目前已知的存在于血中的唯一一种刺激食欲的激素。血中的胃促生长素浓度在餐前升高,餐后迅速降低。这种分泌模式表明胃促生长素参与调节摄食的启动。本研究结果显示进食后胃促生长素的浓度先低后高,从而印证了这一观点。胃促生长素对葡萄糖及胰岛素的调节作用至今仍存在争论。部分学者认为胃促生长素能抑制胰岛素的分泌。在成年人体内,胃促生长素能呈剂量相关性地抑制胰岛素的释放,而胰岛素也在一定情况下抑制胃促生长素的分泌。胃促生长素能升高血糖,抑制脂肪分解和糖异生;同时,低血糖能促进胃促生长素的分泌,而高血糖能反馈抑制胃促生长素的分泌。胰岛素在糖代谢调控中的作用与胃促生长素的上述功能基本呈相反作用,因此,就能量代谢调控方面,胃促生长素在一定程度上可看作是胰岛素的拮抗激素[12]。有研究表明口腔刺激能够显著影响血中胃促生长素的浓度[3,13-14]。本研究也显示,随着咀嚼次数的增多,胃促生长素浓度减小。与先前研究相符表明或许可以通过咀嚼运动来调节胃促生长素的浓度,从而起到抑制食欲、降低血糖的作用。
胆囊收缩素则经过食物分解出的蛋白质分解产物、脂肪酸盐、盐酸等的刺激,分泌分解因子,刺激下丘脑内侧,产生大量的饱腹信号,从而达到抑制食欲的效果。在餐后,胆囊收缩素从小肠释放到循环系统中,通过与迷走神经上的胆囊收缩素1受体结合,发挥抑制食欲的作用。本研究结果显示,各组内随着咀嚼次数的增多,胆囊收缩素的浓度均增加。表明或许可以通过增加咀嚼次数,来升高胆囊收缩素的浓度,从而达到抑制食欲、减少食物摄入、降低血糖的目的。
GLP-1以葡萄糖浓度依赖性方式促进胰岛β细胞分泌胰岛素,并减少胰岛α细胞分泌胰高血糖素,从而降低血糖。正常人在进餐后肠促胰素开始分泌,进而促进胰岛素分泌,以减少餐后血糖的波动。GLP-1主要通过以下方面发挥降糖作用:GLP-1具有保护β细胞的作用,GLP-1可作用于胰岛β细胞,促进胰岛素基因的转录、胰岛素的合成和分泌,并可刺激胰岛β细胞的增殖和分化,抑制胰岛β细胞凋亡,增加胰岛β细胞数量;此外,GLP-1还可作用于胰岛α细胞,强烈地抑制胰高血糖素的释放,并作用于胰岛δ细胞,促进生长抑素的分泌,生长抑素又可作为旁分泌激素参与抑制胰高血糖素的分泌。本研究结果显示,体质量正常组、肥胖组、糖调节受损组、2型糖尿病组不同咀嚼次数下随时间延长血浆GLP-1浓度呈先升高再降低的趋势,且40次/口时血浆GLP-1浓度高于15次/口。表明咀嚼次数越多,血浆GLP-1浓度越高,其发挥的降糖、抑制食欲的作用就越强。
总之,随着人们生活水平的提高、饮食结构的改变、生活节奏的日趋加快以及少动多坐生活方式的增加,肥胖与2型糖尿病患病率逐年上升。在控制体质量过程中,既要调整膳食中3种产能营养素的比例,也要改善咀嚼运动。增加咀嚼次数可以减少一餐的能量摄入,而这种调节作用可能是通过胃促生长素、GLP-1和胆囊收缩素这些胃肠激素介导的。因此,进食时增加咀嚼次数在肥胖的预防和治疗中可能会起到一定的辅助作用。而胃促生长素等胃肠激素可作为形成胰岛索抵抗和2型糖尿病的可预见性危险因素,为2型糖尿病的早期防治提供理论依据。
[参考文献]
[1] World Health Organization. The Asia-Pacific perspective:redefining obesity and its treatment[M]. New South Wales:Health Communications Australia Pty Limited,2000:18.
[2] Stunkard AJ,Messick S. The three-factor eating questionnaire to measure dietary restraint,disinhibition and hunger [J]. J Psychosom Res,1985,29(1):71-83.
[3] Raymond KL,Lovell GP. Food addiction symptomology,impulsivity,mood,and body mass index in people with type 2 diabetes[J]. Appetite,2015,95:383-389.
[4] Hu FB,Satija A,Manson JE. Curbing the diabetes pandemic :the need for global policy solutions[J]. JAMA,2015,313(23):2319-2320.
[5] Xu Y,Wang L,He J,et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA,2013,310(9):948-959.
[6] Abdul-Ghani MA,Puckett C,Triplitt C,et al.Initial combination therapy with metformin,pioglitazone and exenatide is more effective than sequential add-on therapy in subjects with new-onset diabetes:results from the efficacy and durability of initial combination therapy for type 2 diabetes (EDICT):a randomized trial[J]. Diabetes Obes Metab,2015,17(3):268-275.
[7] Li Y,He Y,Qi L,et al.Exposure to the Chinese famines in early life and the risk of hyperglycemia and type 2 diabetes in adulthood[J]. Diabetes,2010,59(10):2400-2406.
[8] von Bonsdorff MB,Muller M,Aspelund T,et al.Persistence of the effect of birth size on dysglycaemia and type 2 diabetes in old age:ACES-Reykjavik Study[J]. Age (Dordr),2013,35(4):1401-1409.
[9] Ng M,Fleming T,Robinson M,et al.Global,regional,and national prevalence of overweight and obesity in children and adults during 1980-2013:a systematic analysis for the Global Burden of Disease Study-2013[J]. Lancet,2014,384 (9945):766-781.
[10] Rodriguez-Martin BC,Meule A. Food craving:new contributions on its assessment,moderators,and consequences[J]. Front Psychol,2015,6:21.
[11] Feinman RD,Pogozelski WK,Astrup A,et al. Dietary carbohydrate restriction as the first approach in diabetes management:critical review and evidence base[J]. Nutrition,2015,31(1):1-13.
[12] McIaughlin T,Abbasi F,Lamendola C,et al. Plasma ghrelin concentrations are decreased in insulin-resistant obese adults relative to equally obese insulin-sensitive controls[J]. J Clin Endocrinol Metab,2004,89(4):1630-1635.
[13] Lim EL,Hollingsworth KG,Aribisala BS,et al. Reversal of type 2 diabetes:normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol[J]. Diabetologia,2011,54(10):2506-2514.
[14] Smeets AJ,Lejeune MP,Westerterp-Plantenga MS. Effects of oral fat perception by modified sham feeding on energy expenditure,hormones and appetite profile in the postprandial state[J]. Br J Nutr,2009,101(9):1360-1368.
(本文编辑:赵丽洁)
[收稿日期]2016-01-26;
[修回日期]2016-07-11
[作者简介]陈云霞(1969-),女,河北沧州人,河北省沧州市人民医院主任医师,医学硕士,从事内分泌疾病诊治研究。
[中图分类号]R333.1
[文献标志码]B
[文章编号]1007-3205(2017)01-0079-08
doi:10.3969/j.issn.1007-3205.2017.01.019