表1 各组大鼠逃避潜伏期比较
Table 1 Comparison of escape latency of rats in each group![]()
·论 著·
刘 娜1,王金华1,王华龙1,邱会卿1,王彦永1,2*,王铭维1,2
(1.河北医科大学第一医院神经内一科,河北 石家庄 050031;2.河北省脑老化与认知神经科学实验室,河北 石家庄 050031)
[摘要]目的观察红景天对实验性老年痴呆大鼠认知功能的治疗作用。方法制作老年痴呆及红景天干预大鼠模型,Morris 水迷宫检测大鼠模型学习记忆能力;免疫印迹法检测AKT、p-AKT、GSK-3β、p-GSK-3β、bcl-2及bax 蛋白表达水平,电镜观察大鼠海马组织超微结构。结果造模后模型组、红景天组逃避潜伏期时间均长于对照组;治疗后逃模型组、红景天组避潜伏期时间均长于对照组,而红景天组短于模型组(P<0.05)。造模后模型组、红景天组目标象限停留时间均明显短于对照组(P<0.05);治疗后模型组、红景天组目标象限停留时间均短于对照组,而红景天组长于模型组(P<0.05)。p-GSK-3β蛋白红景组与模型组低于对照组,红景天组高于模型组;p-AKT蛋白红景天组高于对照组与模型组,模型组低于对照组(P<0.05)。bcl-2模型组低于对照组,红景天组高于对照组和模型组,(P<0.05);bax模型组高于对照组和红景天组(P<0.05)。结论红景天可改善实验性老年痴呆大鼠认知功能,其机制可能是通过PI3K/AKT/GSK3β 通路上调抑制凋亡蛋白bcl-2、下调促凋亡蛋白bax实现的。
[关键词]阿尔茨海默病;红景天;细胞凋亡
阿尔茨海默病(Alzheimer disease,AD)是一种慢性神经退行性疾病,其临床特征为学习记忆能力减退,常表现为渐进性的记忆障碍、常找不到回家的路、人格改变、对家人冷漠[1]。病理学特征为出现异常蛋白结构,即tau蛋白的过度磷酸化和β淀粉样蛋白斑块形成[2-5]。tau蛋白的分布与疾病的症候、发展密切相关,β淀粉样蛋白变化广泛[6-7]。目前,关于tau蛋白的过度磷酸化和β淀粉样蛋白斑块出现先后问题仍存在争议[8-10]。有文献表明,AD的“元凶”是tau蛋白的过度磷酸化而非Aβ蛋白。2种蛋白结构的异常与神经元及突触减少有关。目前,临床上改善AD症状的药物很多,但效果并不明显。全球范围内AD的患者呈增加趋势,且年龄逐渐年轻化,严重影响患者的生活质量,同时给患者和家庭带来沉重的经济负担,因此亟须开发有效控制和改善其症状的药物。现代药理学认为,红景天被广泛用于心脑血管疾病,除抗衰老、抗疲劳、抗肿瘤外,其还具有强大的抗氧化作用,通过调节神经递质实现对中枢神经系统保护作用[11-13]。红景天可抑制caspase-3和细胞内钙离子水平进而保护海马神经元,发挥神经保护作用[14]。本研究采用AD大鼠模型观察AKT、p-AKT、GSK-3β(ser9)、p-GSK-3β(ser9)、bcl-2、bax等蛋白水平,探讨红景天对AD大鼠的神经保护作用及机制,旨在为临床治疗AD提供可靠的理论依据。
1.1 动物造模及分组 无特定病原体(specific pathogen free,SPF)级雄性SD大鼠30只,体质量为(260±20) g,由河北省实验动物中心提供,分为空白对照组10只,AD模型组10只,红景天组10只。AD模型组及红景天组大鼠每隔2 h皮下注射NaN3,连续4周,对照组注射等量的生理盐水。4周后,Morris水迷宫检测大鼠学习记忆功能,大鼠逃避潜伏期较对照组显著延长,而通过目标象限的次数显著减少,表明大鼠出现认知功能障碍,视为大鼠造模成功。水迷宫实验结束后,红景天组给予15 mg/kg灌胃,对照组和模型组给予等量的生理盐水灌胃,持续4周Morris水迷宫观察大鼠认知功能变化。
1.2 试剂 红景天干燥粉末购自河北省中医研究所。NaN3购自北京恒业中原化工有限公司,兔抗大鼠 GSK-3β、p-GSK-3β(ser9)、bax、bcl-2、AKT、p-AKT购自美国Sigma公司,PIPA裂解液、蛋白提取试剂盒、PDVF模等其他试剂均购自碧云天生物公司。
1.3 实验方法
1.3.1 Morris水迷宫 灌胃4周后进行Morris水迷宫检测。水迷宫直径150 cm,池壁高50 cm,水深40 cm,水温(22±1) ℃。目标象限中央放置一直径10 cm平台,位于水面下1 cm。大鼠经过适应训练后,进行定位航行实验,大鼠面朝池壁下水,记录大鼠找到平台的时间,如果在120 s内找到平台,记录时间(逃避潜伏期);如果120 s未找到平台将其引上平台并让大鼠停留20 s,逃避潜伏期记录为120 s。空间搜索实验:定位航行实验后,移除平台,记录大鼠在目标象限停留时间。
1.3.2 电镜观察大鼠海马组织超微结构 Morris水迷宫后迅速处死大鼠,冰上取海马组织,戊二醛固定。脱水→树脂包埋→聚合→固化→切片(50~60 nm),观察并拍照。
1.3.3 免疫印迹法测定AKT、p-AKT、GSK-3β、p-GSK-3β(ser9)、bcl-2及bax水平 迅速断头,取海马组织,提取蛋白,用于免疫印迹实验。匀浆→冰浴→离心→取上清→BCA试剂盒蛋白定量→煮沸变性(加上样缓冲液)。SDS-PAGE胶分离→转膜→封闭2 h→一抗4℃过夜→洗膜→标记二抗→孵育2 h→ECL显影。
1.4 统计学方法 应用SPSS 16.0统计软件分析数据。计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2.1 Morris水迷宫测试大鼠学习能力 3组造模前逃避潜伏期差异无统计学意义(P>0.05)。造模后模型组、红景天组逃避潜伏期时间均长于对照组(P<0.05);治疗后模型组、红景天组逃避潜伏期时间均长于对照组,而红景天组短于模型组(P<0.05)。见表1。
表1 各组大鼠逃避潜伏期比较
Table 1 Comparison of escape latency of rats in each group![]()

*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
2.2 水迷宫测试大鼠记忆能力 3组大鼠造模前在目标象限停留时间差异无统计学意义(P>0.05)。造模后模型组和红景天组目标象限停留时间均明显短于对照组(P<0.05);治疗后模型组、红景天组目标象限停留时间均短于对照组,而红景天组长于模型组(P<0.05)。见表2。
表2 各组大鼠目标象限停留时间比较
Table 2 The retention time of the target quadrant in each group![]()
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
2.3 免疫印迹法检测各种蛋白定量 模型组p-GSK-3β蛋白明显低于对照组,红景天较模型组明显升高,但仍低于对照组(P<0.05);模型组p-AKT低于对照组,红景天p-AKT明显高于模型组和对照组(P<0.05);模型组bcl-2蛋白明显低于对照组,而红景天组高于模型和对照组(P<0.05);模型组bax蛋白明显高于对照组,红景天组明显低于模型组(P<0.05),但与对照组差异无统计学意义(P>0.05);3组间GSK-3β和AKT差异无统计学意义(P>0.05)。见表3,图1,2。
2.4 电镜观察大鼠海马组织超微结构 对照组海马神经元核膜核膜完整,核仁清晰可见,线粒体饱满,脊清晰可见;模型组染色质边集,核仁消失,线粒体肿胀,脊消失,红景天显著改善了这一状况(图3)。
表3 不同组别海马组织中AKT、GSK-3β、bcl-2和bax相对活性比较
Table 3 The relative activity of AKT,GSK-3β,bcl-2 and bax in hippocampus of different groups![]()
*P<0.05与对照组比较 #P<0.05与模型组比较(SNK-q检验)
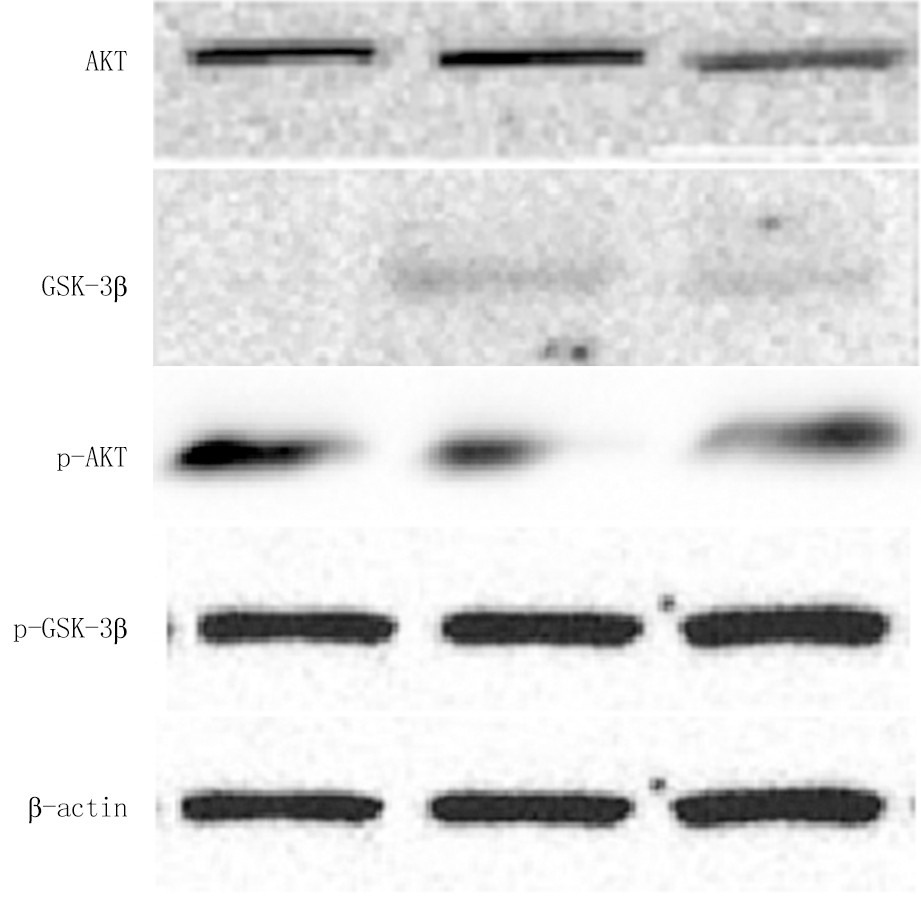
图1 免疫印迹法检测p-GSK-3β和 GSK-3β,p-AKT和AKT
Figure 1 P-GSK-3β and GSK-3β, p-AKT and AKT were detected by Western blot
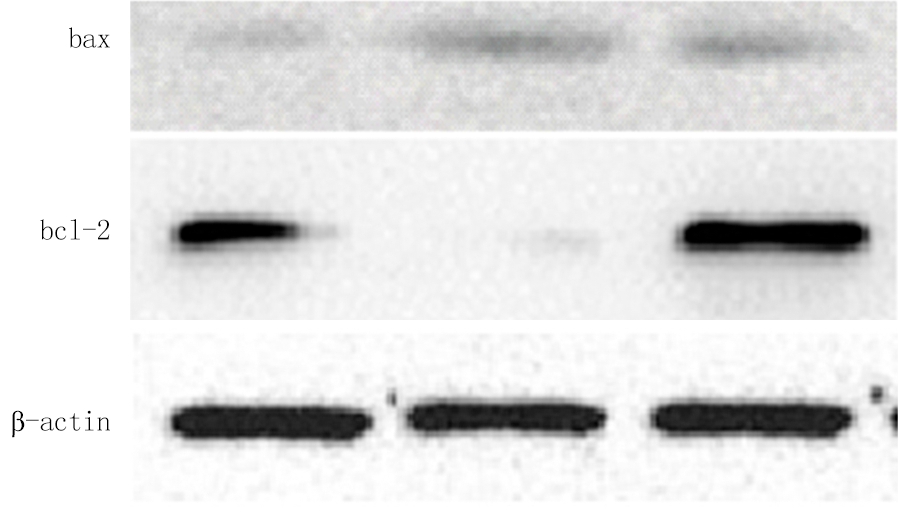
图2 免疫印迹法检测bcl-2、 bax结果
Figure 2 The bcl-2 and bax results were detected by Western blot
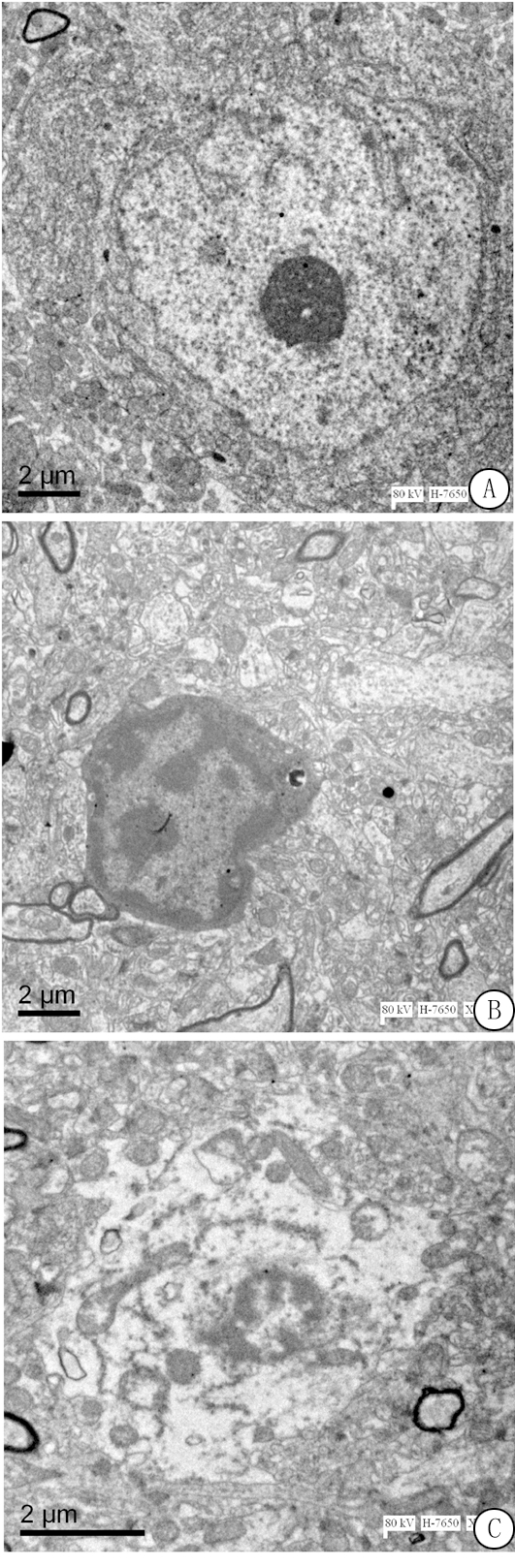
图3 大鼠海马神经元电镜观察结果
A.细胞器排列紧密,数目多,核膜清晰可见;B.染色质边集,线粒体肿胀,脊消失;C.细胞器排列较紧密,数目较多
Figure 3 The results of electron microscopic observation of rat hippocampal neurons
AD是一种不可逆的慢性神经退行性疾病,表现为学习记忆障碍及记忆减退,尤其是近事遗忘突出,性格和行为改变,执行能力下降等痴呆特征[15]。AD患者多见于70岁以上老人,存在性别差异,女性多于男性。随着病情的进展,患者记忆能力严重丧失且生活不能自理,大小便失禁,并出现原始反射,最后昏迷,常死于感染。专家学者致力于AD的研究已逾百年。最初,普遍认为其与细胞外淀粉样斑块形成和神经组织中神经原纤维缠结密切相关。最近有报道指出,以上特征包括神经突触变性、海马神经元数目减少。但是,新的组织学证据认为,AD的病理学特征仍是细胞外淀粉样斑块形成和神经组织中神经原纤维缠结。
目前,用于治疗AD的药物包括多奈哌齐、利斯的明、加兰他敏和美金刚等药物。这些药物能在一定程度上延缓记忆丧失,改善沟通能力和其他的行为障碍。然而,其效果甚微,甚至出现严重的不良反应[16]。迄今为止,没有药物能有效阻止记忆丧失、认知障碍以及学习能力、判断力、日常生活能力丧失[17-18]。也就是说,没有任何药物能治愈AD。
红景天是一种从植物的根茎中提取的传统中药,广泛用于心脑血管疾病、抗衰老、抗疲劳、抗肿瘤,同时具有保护中枢神经系统作用,可抑制caspase-3和细胞内钙离子水平进而保护海马神经元,发挥神经保护作用,其机制可能与PI3K/AKT信号通路相关[19-20]。研究表明,红景天通过降低活性氧族生成减少小鼠脑缺血再灌注损伤,进而延长小鼠的寿命[21]。此外,红景天具有清除自由基的药理作用。另有研究发现,红景天对小鼠缺血再灌注脑保护作用是通过减少神经细胞凋亡,其机制可能与PI3K/AKT信号通路相关联[10]。红景天激活PI3K,进而激活AKT,使其磷酸化,从而影响凋亡相关蛋白Bcl-2和Bax,同时降低caspase-3、caspase-6和caspase-9表达水平,发挥抗凋亡作用,从而具有神经保护作用[22-23]。研究发现,神经胶质细胞中1 052种基因受红景天调控,其中95种基因与神经疾病相关,可见红景天可进行多靶点调控细胞应答,从而作用于多个信号通路[24-25]。
本研究采用AD大鼠模型,Morris水迷宫测试发现,红景天干预后,大鼠的学习记忆能力明显改善,p-GSK-3β/GSK-3β、p-AKT/AKT、bcl-2水平升高,bax水平下降。表明红景天改善认知与PI3K/AKT信号通路有关。电镜观察海马神经元超微结构显示,红景天干预后细胞器数目较AD大鼠增多,染色质边集有明显改善。
综上所述,红景天可改善实验性老年痴呆大鼠认知功能,其机制可能是通过PI3K/AKT/GSK3β通路上调抑制凋亡蛋白bcl-2、下调促凋亡蛋白bax实现的。随着研究的深入,红景天越来越受到研究者青睐,其抗氧化、抗凋亡以及抗炎作用,已经得到普遍认可。红景天的药理机制已逐渐明了,改善AD认知功能障碍的疗效亦被广大研究者和临床工作者接受。今后的研究将进一步探讨红景天改善认知的机制,以便为临床治疗AD提供有效的理论依据,从而提高AD患者的生活质量,缓解其家庭的压力。
[参考文献]
[1] Hasegawa M,Watanabe S,Kondo H,et al. Murayama,S. 3r and 4r tauisoforms in paired helical filaments in Alzheimer's disease[J]. Acta Neuropathol,2014,127(4):303-305.
[2] 王玲,朱鸣峰.阿尔茨海默病发病机制的研究进展[J].吉林医学,2013,34(3):531-532.
[3] 金艳玲,周洋,王洪海,等.红景天苷对大鼠肾脏缺血再灌注损伤的预防与保护作用[J].中药新药与临床药理,2010,21(1):22-25.
[4] 余梦瑶,许晓燕,江南,等.阿尔茨海默症痰湿蕴结与β-淀粉样肽聚集及自噬相关性探讨[J].中华中医药杂志,2016,31(9):3632-3635.
[5] 赵欢,陈晓宇,姬飞虹,等.远志提取物清除β淀粉样蛋白的途径及其信号通路的研究[J].安徽医科大学学报,2014,49(7):913-917.
[6] 陈琛,张中豪,吴秋艳,等.APP/Tau/PS转基因阿尔茨海默病小鼠行为学、炎症反应及自噬水平的研究[J].中华神经医学杂志,2015,14(2):119-124.
[7] 张中豪,石庆学,温蕾,等.转基因阿尔茨海默病小鼠tau蛋白的病理变化[J].中华老年医学杂志,2014,33(6):657-660.
[8] 王楠,何远宏,潘双杰,等.阿尔茨海默病患者认知功能及血清铜、同型半胱氨酸、尿酸水平、tau和A阻-42蛋白的检测[J].郑州大学学报:医学版,2014,43(7):1283-1285.
[9] 王丽.研究证实驱动阿尔茨海默病症状的“元凶”为Tau蛋白,而非Aβ蛋白[J].海南医学,2016,35(10):1003.
[10] 张艳梅,陈金,邬伟,等.GCs对VD大鼠行为学及海马脑区tau蛋白P-tau蛋白、Aβ淀粉样蛋白表达影响的实验研究[J].中风与神经疾病杂志,2015,23(6):494-496.
[11] Wang S,He H,Chen L,et al. Protective effects of salidrosidein the MPTP/MPP(+) -induced model of Parkinson's diseasethrough ROS-NO-related mitochondrion pathway[J]. Mol Neurobiol,2015,51(2):718-728.
[12] Lu-Nguyen NB,Broadstock M,Schliesser MG,et al. Transgenic expression of human glial cell line-derived neurotrophicfactor from integration-deficient lentiviral vectors is neuroprotectivein a rodent model of Parkinson's disease[J]. Hum Gene Ther,2014,25(7):631-641.
[13] Panossian A,Hamm R,Wikman G,et al. Mechanism of actionof Rhodiola,salidroside,tyrosol and triandrin in isolated neuroglialcells:an interactive pathway analysis of the downstream effectsusing RNA microarray data[J]. Phytomedicine,2014,21(11):1325-1348.
[14] Xiao L,Li H,Zhang J,et al. Salidroside protects Caenorhabditiselegans neurons from polyglutamine-mediated toxicity by reducing oxidative stress[J]. Molecules,2014,19(6):7757-7769.
[15] Kim M,Shin MS,Lee JM,et al. Inhibitory effects of isoquinolinealkaloid berberine on ischemia-induced apoptosis via activation ofphosphoinositide 3-kinase/protein kinase B signaling pathway[J]. Int Neurourol J,2014,18(3):115-125.
[16] 赵敏,边芳,田卓华,等.甘草、红景天及黄芪粗提取物对UVB诱导小鼠皮肤慢性光损伤的保护作用[J].世纪科技研究与发展,2015,34(5):295-299.
[17] 朱建建.红景天苷对脑缺血再灌注损伤保护机制概述[J].山东中医杂志,2013,21(10):765-767.
[18] 韩雪娇,郭娜,朱美宣,等.红景天苷药理作用及其作用机理研究进展[J].中国生物药学杂志,2015,35(1):171-175.
[19] 张德钧,元王涛,李梦婷,等.藏药洮河红景天trnS-G基因与红景天苷含量变异的相关性研究[J].基因组学与应用生物学,2015,22(1):130-135.
[20] Li S,Wu C,Chen J,et al. An effective solution to discover synergisticdrugs for anti-cerebral ischemia from traditional Chinese medicinalformulae[J]. PLoS One,2013,8(11):e78902.
[21] Lin TY,Lin YW,Lu CW,et al. Berberine inhibits the release of glutamate in nerve terminals from rat cerebral cortex[J]. PLoS One,2013,8(6):e67215.
[22] Jiang W,Wei W,Gaertig MA,et al. Therapeutic effect of berberine on Huntington's disease transgenic mouse model[J]. PLoS One,2015,10(7):e0134142.
[23] Friedemann T,Schumacher U,Tao Y,et al. Neuroprotective activity of coptisine from Coptis chinensis(Franch)[J]. Evid Based Complement Alternat Med,2015,2015:827308.
[24] Ahmed T,Gilani AU,Abdollahi M,et al. Berberine and neurodegeneration:a review of literature[J]. Pharmacol Rep,2015,67(5):970-979.
[25] Zhang JK, Yang L, Meng GL, et al. Protection by salidroside against bone loss via inhibition of oxidative stress and bone-resorbing mediators[J]. PloS One,2013,8(2):e57251.
(本文编辑:刘斯静)
The therapeutic effects of Rhodosin on cognition in AD rats
LIU Na1, WANG Jin-hua1, WANG Hua-long1, QIU Hui-qing1, WANG Yan-yong1,2*, WANG Ming-wei1,2
(1.Department of Neurology,the First Hospital of Hebei Medical University,Shijiazhuang050031,China;2.Brain aging and Cognitive Neuroscience Laboratory of Hebei Province,Shijiazhuang050031,China)
[Abstract]Objective To study the therapeutic effects of Rhodosin on cognitive function in Alzheimer disease(AD) rats. Methods The AD rat models and Rhodosin intervention models were established. Learning and memory abilities of rats were tested by the Morris water maze. The protein expressions of AKT, p-AKT, GSK-3β, P-GSK-3β, bcl-2 and bax were examined via Western blotting. And the ultrastructure of hippocampus neurons was determined by transmission electron microscopy. Results After modeling, the latent period of the model group and Rhodosin group was prolonged than that in the control group. After treatment, the latent period of the model group and Rhodosin group was prolonged than that in the control group. The Rhodosin group was shorter than the model group(P<0.05). After modeling, the stay time of the target quadrant in model group and Rhodosin group was significantly shorter than the control group, the difference was statistically significant(P<0.05). After treatment, the stay time of the target quadrant in model group and Rhodosin group was also shorter than the control group, but the Rhodosin group was longer than the model group(P<0.05). The protein expressions of p-GSK-3β in the model group and Rhodosin group was lower than that in the control group, Rhodosin group higher than model group. The protein expressions of p-AKT in Rhodosin group was higher than control group and model group, model group lower than control group(P<0.05). The protein expressions of bcl-2 in model group lower than control group, Rhodosin group was higher than control group and model group(P<0.05). The bax protein expressions in model group was high than control group and Rhodosin group(P<0.05). Conclusion Rhodosin could improve cognitive function in AD rats. Its mechanisms may be through up-regulating anti-apoptotic protein bcl-2 and down-regulating pro-apoptotic protein bax via the PI3K/AKT/GSK3β pathway.
[Key words]Alzheimer disease; RHODIOLA SACRA; apoptosis
[收稿日期]2016-11-01;
[修回日期]2016-11-30
[基金项目]河北省医学科学研究重点课题(20110301);河北省医学适用技术跟踪项目(GL2014015);河北省应用基础研究计划重点基础研究项目(14967725D)
[作者简介]刘娜(1981-),女,河北赵县人,河北医科大学第一
医院主治医师,医学硕士,从事神经内科疾病诊治研究。
[中图分类号]R745.7
[文献标志码]A
[文章编号]1007-3205(2017)02-0133-05
doi:10.3969/j.issn.1007-3205.2017.02.003
*通讯作者。E-mail:13223455938@163.com