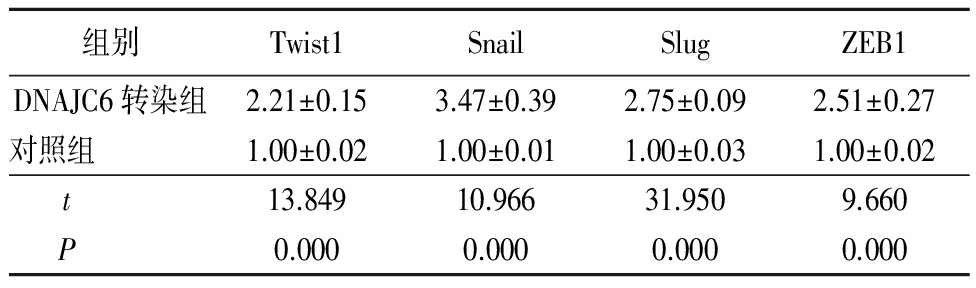
表1 肝癌细胞转染DNAJC6后Twist1、Snail、Slug和ZEB1表达水平变化
Table 1 Changes of Twist1,Snail,Slug and ZEB1 expression in hepatocellular carcinoma cells transfected with DNAJC6![]()
·论 著·
耿蕴峰1,李晓娜2,卢玉娟1,贾金广1,杨 涛1*
(1.河北省石家庄市第一医院肝胆外科,河北 石家庄 050011;2.河北省体育科学研究所门诊部,河北 石家庄 050011)
[摘要]目的通过体外实验,探讨DNAJC6在肝细胞肝癌进展中的作用途径。方法应用体外肝癌细胞培养、质粒构建、转染及逆转录-聚合酶链反应检测肝癌细胞HepG2中DNAJC6表达对上皮-间质转变(epithelial-to-mesenchymal transition,EMT)过程的影响。结果与对照组比较,转染DNAJC6后的肝癌细胞HepG2中EMT相关转录因子Twist1、Snail、Slug、ZEB1表达水平明显升高(P<0.01),间质细胞标记物神经-钙黏素(N-cadherin)和波形蛋白(Vimentin)表达上调(P<0.01),上皮标记物上皮-钙黏素(E-cadherin)和上皮细胞紧密连接蛋白(ZO-1)表达下调(P<0.01)。结论DNAJC6通过诱导EMT过程参与肝细胞肝癌的进程。
[关键词]肝肿瘤;转染;上皮-间质转变
目前研究发现DNAJC6表达与帕金森病和精神发育迟滞癫痫等疾病有关[1-2]。然而在肝癌组织中研究发现DNAJC6在肝癌组织中表达上调,进一步研究发现DNAJC6过表达可以促进细胞的上皮-间质转变(epithelial-to-mesenchymal Transition,EMT)过程。EMT是指上皮细胞受到某些特定的生物信号的刺激而转变成为间质表型细胞的分子生物过程。EMT发生的过程中,与其相关的分子标志物、转录因子及信号通路传递蛋白也发生相应变化[3-6]。本研究显示在体外培养的肝癌细胞HepG2细胞株中转染DNAJC6后,肝癌细胞HepG2中EMT过程明显增强,报告如下。
1.1 实验材料 人肝癌细胞株HepG2购自美国模式菌种收集中心,DMEM高糖培养基和胎牛血清、哺乳动物细胞表达载体pcDNA3.1(+)、4′,6-二脒基-2-苯基吲哚购自美国Invitrogen公司,兔多克隆抗体DNAJC6(1∶1 000)、Vimentin(1∶2 000)、E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、ZO-1(1∶1 000)购自英国Abcam公司,Twist1,Snail、Slug、ZEB1购自美国cell signaling公司,Odyssey荧光双色红外成像仪购自德国LI-COR公司。
1.2 细胞培养 肝癌细胞HepG2从液氮罐中取出,置于恒温水浴箱中(37℃),后将溶解的细胞悬液加入DMEM培养基中。1 000 r/min,离心5 min,去除上清液,置于DMEM培养基中,37 ℃,5% CO2加湿空气培养。
1.3 质粒构建及稳定细胞系筛选 利用肝癌细胞HepG2总DNA 实施逆转录-聚合酶链反应(reverse transcription-polymerize chain reaction,RT-PCR),从而获得全长的DNAJC6 cDNA。引物序列为:正向5′-GGAATTCATGAGCCTCCTC-GGGAGCTAC-3′;反向5′- CCTCGAGATATAA-GGGCTTTTGGCCTTG-3′。PCR产物克隆到载体pcDNA3.1(+)的BamH I和Xho I酶切位点上酶切后,进行连接构建得到DNAJC6的过表达载体(pcDNA3.1-DNAJC6)。用Lipofectamine 2000 转染肝癌细胞HepG2,得到DNAJC6过表达的HepG2细胞系。然后将DNAJC6过表达的HepG2细胞系按照制造商说明书步骤,用800 μg/mL G418进行稳定细胞系筛选。
1.4 实时荧光定量PCR分析 应用SYBR法,取适量的混合cDNA样品,按照体积比1∶4稀释为标准品。后以标准品做为模板,进行合成引物的qPCR扩增。扩增后用得出的Ct值和相对浓度绘制曲线。根据其曲线线性度,确保引物扩增效率合格。在样本检测时,在曲线线性范围内选择模板的起始浓度。25 μL反应体系:2×Sybr Premix 12.5μL、ROX参照染料Ⅱ 0.5 μL、引物 1μL、cDNA模板+H2O 11 μL 。qPCR反应条件:95 ℃ 30 s预变性;95 ℃ 5 s 、60 ℃ 15 s 、72 ℃ 10 s ,10 s末收集荧光信号,照此条件进行40次循环扩增。qPCR实验基因表达值按照以下方式计算:△Ct=Ct待测基因- Ct参照基因,基因相对表达值=2-△Ct。
1.5 统计学方法 应用SPSS 13.0统计软件处理数据,计量资料比较采用独立样本的t检验。P<0.05为差异有统计学意义。
2.1 2组Twist1、Snail、Slug和ZEB1表达水平比较 DNAJC6转染组Twist1、Snail、Slug和ZEB1表达水平均高于对照组,差异有统计学意义(P<0.01),见表1。
表1 肝癌细胞转染DNAJC6后Twist1、Snail、Slug和ZEB1表达水平变化
Table 1 Changes of Twist1,Snail,Slug and ZEB1 expression in hepatocellular carcinoma cells transfected with DNAJC6![]()

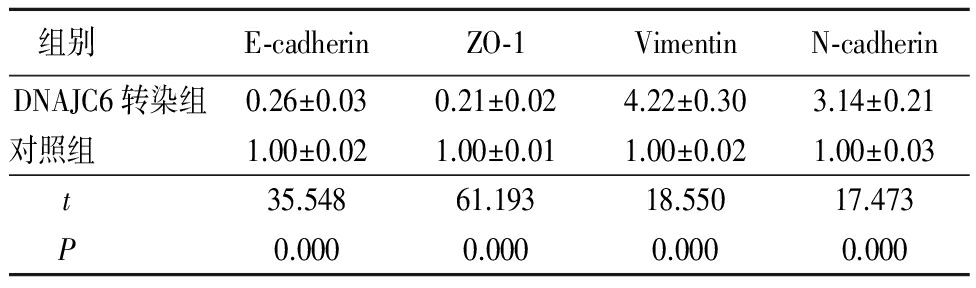
2.2 2组E-cadherin、ZO-1、Vimentin和N-cadherin表达水平比较 DNAJC6转染组E-cadherin和ZO-1表达均低于对照组,Vimentin和N-cadherin的达均高于对照组,差异有统计学意义(P<0.01),见表2。
表 2 2组E-cadherin、ZO-1、Vimentin和N-cadherin表达水平比较
Table 2 Comparison of the expression levels of E-cadherin,ZO-1,Vimentin and N-cadherin in the two groups![]()
肝细胞肝癌是最常见的人类恶性肿瘤之一,据统计每年有约700 000人因肝细胞肝癌死亡,同时约有21 000个新诊断的病例。肝细胞肝癌已经成为严重威胁到人类的健康、发病率呈逐年上升趋势、高转移复发和高病死率的疾病,特别是在我国这样的乙型病毒性肝炎高发的国家,肝细胞肝癌的发病率及病死率更是处于世界前列,成为威胁我国人民生命健康的主要恶性肿瘤之一[7-8]。找到潜在的致病性的分子机制,对于发展肝癌的新的治疗方法、改善肝细胞肝癌患者生存质量有着重要的意义。
DNAJC6属于进化上保守的DnaJ/Hsp40家族的蛋白质,调节分子伴侣活性从而刺激ATP酶活性。DNAJ蛋白可能有多达3个不同的领域:一个保守的70个氨基酸的J结构域,通常在N末端,甘氨酸/苯丙氨酸(G/F)丰富的地区;和一个锌指结构域;富含半胱氨酸结构域。到目前为止证实与DNAJC6相关的疾病包括帕金森病和精神发育迟滞癫痫。而DNAJC6在肿瘤发生发展过程中作用的有关报道十分有限。在前期研究中我们发现在肝癌组织中DNAJC6表达上调,并且本研究结果显示在肝癌细胞中DNAJC6过表达可以诱导细胞的EMT过程。表明DNAJC6可能是潜在的致癌基因。
EMT是上皮细胞在外界刺激信号的作用下细胞失去极性及细胞之间黏附、细胞发生形态变化,由上皮样向间质样转变,同时细胞运动能力及迁移能力明显增强的过程。有研究表明,在不同的肿瘤细胞中EMT可以被多种重要的信号通路调节,如转化生长因子β(trnsfroming growth factor-β,TGF-β)可以在肝癌细胞中诱导EMT过程,促进肝癌细胞增殖、迁移及侵袭;在卵巢癌细胞中可通过抑制TGF-β信号转导通路从而抑制EMT过程,降低卵巢癌的迁移及侵袭能力[9];在人类乳腺癌细胞中血管抑制蛋白2(vasohibin 2,VASH2)可通过激活TGF-β信号转导通路诱导EMT过程,从而促进乳腺癌细胞的侵袭、迁移[10];在肺癌细胞中抑制TGF-β信号转导通路后,间质标记物纤连蛋白、Vimentin、N型钙黏蛋白表达明显减弱,证实在肺癌细胞中TGF-β信号转导通路可通过诱导EMT过程增加肺癌细胞的侵袭及迁移能力[11]。肝细胞生长因子(hepetocyte growth promoting factor,HGF) 可通过上调转录因子Snail表达,从而激活EMT,促进肝癌细胞侵袭、迁移[7];有研究表明,索拉非尼可通过HGF信号通路抑制极化巨噬细胞,从而抑制EMT过程[12]; 在非小细胞肺癌中MiR-206可以通过抑制HGF信号通路活性来抑制EMT过程,从而抑制非小细胞肺癌的侵袭及迁移能力[13]。表皮生长因子受体(epidermal growth factor receptor,EGFR)在卵巢癌的发生发展过程中发挥着重要作用,有研究表明,在卵巢癌细胞中抑制EGFR后间质标记物N-cadherin 表达减低,上皮标记物E-cadherin表达增加,EGFR可通过激活EMT过程参与卵巢癌的发生发展过程[6];在乳腺癌细胞中可通过抑制EGFR信号转导通路,来抑制EMT过程,从而降低乳腺癌细胞的侵袭及迁移能力[14]。血小板源性生长因子D(platelet-derived growth factor-D,PDGF-D) 在子宫内膜癌细胞中增强PDGF-D表达,可诱导EMT过程,从而增加子宫内膜癌细胞的活性[5];在舌鳞癌细胞中PDGF-D可通过激活EMT过程,促进舌鳞癌细胞的侵袭及转移[15];另有研究发现在肝癌细胞中PDGF-D可诱导EMT过程增强,从而导致肝癌细胞对吉西他滨的耐药[16]。这些通路同时也在胚胎早期发育过程中及器官形成过程中起着关键作用,因此这些信号转导通路是胚胎发育和肿瘤进展的共同通道之一。受上游信号通路的影响,在EMT过程中其转录因子Twist、Slug和Snail被活化,诱导EMT过程中Vimentin、N-cadherin表达上调,同时抑制E-cadherin表达。随着对EMT过程的研究深入,有越来越多的研究结果证实在肿瘤发生发展过程中EMT扮演着重要角色,在肿瘤细胞转移侵袭过程中,肿瘤细胞受到炎症细胞及成纤维细胞的信号刺激,上皮细胞转变为间质细胞,由原发病灶向局部邻近组织侵袭。并且间质样的肿瘤细胞脱离原发灶后可以通过血液及淋巴途径,造成远端组织器官的转移。EMT主要是在肿瘤发展的前期发挥作用,通过调节细胞黏附分子(如Integrin、Ig超家族、Cadherin、CD44及Selectin)、细胞外基质(包括胶原、蛋白聚糖、弹力蛋白、纤维结合蛋白及层黏连蛋白等)介导细胞-基质和细胞-细胞之间的相互作用。
EMT被认为是一个正常的发展过程如中胚层和神经嵴细胞的形成。癌症的发展过程中,EMT使上皮细胞极性丧失,从而促进肿瘤细胞的迁移和侵袭。本研究结果表明,DNAJC6诱导人肝癌细胞EMT程序,包括间质细胞标记物N-cadherin、Vimentin上调,上皮标记物E-cadherin和ZO-1表达下调。此外,DNAJC6可激活EMT相关转录因子的表达(Twist1、Snail、Slug、ZEB1)从而诱导EMT过程。
综上所述,DNAJC6在肝癌的表达上调,与DNAJC6具有癌基因活性有关,其通过诱导EMT过程影响肝癌细胞生长、侵袭和转移过程,表明DNAJC6可能成为肝癌治疗的一个潜在靶点。
[参考文献]
[1] Olgiati S,Quadri M,Fang M,et al. DNAJC6 mutations associated with early-onset parkinson's disease[J]. Annals Neurol,2016,79(2):244-256.
[2] Elsayed LE,Drouet V,Usenko T,et al. A novel nonsense mutation in DNAJC6 expands the phenotype of autosomal-recessive juvenile-onset parkinson's disease[J]. Ann Neurol,2016,79(2):335-337.
[3] Wang Y,Qiu H,Hu W,et al. Over-expression of platelet-derived growth factor-D promotes tumor growth and invasion in endometrial cancer[J]. Int J Mol Sci, 2014 ,15(3):4780-4794.
[4] Xu L,Wu H,Jiang C,et al. Dacomitinib,a new pan-EGFR inhibitor,is effective in killing ovarian cancer cells[J]. Discov Med,2016,22(122):297-309.
[5] Liu WT,Jing YY,Yu GF,et al. Hepatic stellate cell promoted hepatoma cell invasion via the HGF/c-Met signaling pathway regulated by p53[J]. Cell Cycle,2016,15(7):886-894.
[6] Zhang M,Sui C,Dai B,et al. PEG10 is imperative for TGF-β1-induced epithelial mesenchymal transition in hepatocellular carcinoma[J]. Oncol Rep,2017,37(1):510-518.
[7] 杨涛,孙轶飞,王立伟,等.KIF14 过表达与肝细胞肝癌手术预后密切相关[J].河北医科大学学报,2014,35(3):263-265.
[8] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA:A Cancer J Clin,2011,61(2):69-90.
[9] Pazos MC,Abramovich D,Bechis A,et al. Gamma secretase inhibitor impairs epithelial-to-mesenchymal transition induced by TGF-β in ovarian tumor cell lines[J]. Mol Cell Endocrinol,2017,440:125-137.
[10] Tu M,Li Z,Liu X,et al. Vasohibin 2 promotes epithelial-mesenchymal transition in human breast cancer via activation of transforming growth factor β 1 and hypoxia dependent repression of GATA-binding factor 3[J]. Cancer Lett,2016,388:187-197.
[11] Baek SH,Ko JH,Lee JH,et al. Ginkgolic acid inhibits invasion and migration and tgf-β-induced emt of lung cancer cells through pi3k/akt/mtor inactivation.[J]. J Cell Physiol,2017,232(2):346-354.
[12] Deng YR,Liu WB,Lian ZX,et al. Sorafenib inhibits macrophage-mediated epithelial-mesenchymal transition in hepatocellular carcinoma[J]. Oncotarget,2016,7(25):38292-38305.
[13] Chen QY,Jiao DM,Wu YQ,et al. MiR-206 inhibits HGF-induced epithelial-mesenchymal transition and angiogenesis in non-small cell lung cancer via c-Met /PI3k/Akt/mTOR pathway[J]. Oncotarget,2016,7(14):18247-18261.
[14] Balakrishnan S,Bhat FA,Raja Singh P,et al. Gold nanoparticle-conjugated quercetin inhibits epithelial-mesenchymal transition,angiogenesis and invasiveness via EGFR/VEGFR-2-mediated pathway in breast cancer[J]. Cell Prolif,2016,49(6):678-697.
[15] Zhang H,Sun JD,Yan LJ,et al. PDGF-D/PDGFRβ promotes tongue squamous carcinoma cell(TSCC) progression via activating p38/AKT/ERK/EMT signal pathway[J]. Biochem Biophys Res Commun,2016,478(2):845-851.
[16] Wang R,Li Y,Hou Y,et al. The PDGF-D/miR-106a/Twist1 pathway orchestrates epithelial-mesenchymal transition in gemcitabine resistance hepatoma cells[J]. Oncotarget,2015,6(9):7000-7010.
(本文编辑:许卓文)
Overexpression of DNAJC6 induces the occurrence of EMT in hepatocellular carcinoma cells
GENG Yun-feng1, LI Xiao-na2, LU Yu-juan1, JIA Jin-guang1, YANG Tao1*
(1.Department of Heapatobiliary Surgery,the First Hospital of Shijiazhuang City,Hebei Province,Shijiazhuang050011,China; 2.The Outpatient department,the Sports Science Institute of Hebei Province,Shijiazhuang050011,China)
[Abstract]Objective To investigate the role of DNAJC6 in the progression of hepatocellular carcinoma in vitro. Methods The effects of DNAJC6 expression on epithelial-to-mesenchymal transition(EMT) in HepG2 cells were detected by in vitro liver cancer cell culture, plasmid construction, transfection and reverse transcription-polymerize chain reaction. Results Compared with the control group,the expression level of EMT related transcription factor in hepatocellular carcinoma cell line HepG2 transfected with DNAJC6 Twist1, Snail, Slug, ZEB1 was increased significantly(P<0.01). Mesenchymal cell markers N-cadherin and vimentin were up-regulated(P<0.01). Epithelial markers E-cadherin and ZO-1 were down-regulated(P<0.01). Conclusion DNAJC6 is involved in the process of hepatocellular carcinoma by inducing EMT.
[Key words]liver neoplasms; transfection; epithelial-to-mesenchymal transition
[收稿日期]2017-01-04;
[修回日期]2017-02-06
[基金项目]河北省科技计划项目(16277705D);石家庄市科学技术研究与发展指导计划(141463243)
[作者简介]耿蕴峰(1980-),男,河北石家庄人,河北省石家庄市第一医院主治医师,医学硕士,从事肝胆外科疾病诊治研究。
*通讯作者。E-mail:yangtaopla@163.com
[中图分类号]R575.2
[文献标志码]A
[文章编号]1007-3205(2017)02-0151-04
doi:10.3969/j.issn.1007-3205.2017.02.007