表1 2组临床症状改善情况比较
Table 1 Changes of clinical symptoms of two groups (n=30,例数,%)
·论 著·
张 岁,贾 蓓,郭翠敏,王海舫,周 靖*
(河北医科大学第一医院中西医结合肝病诊疗中心,河北 石家庄 050031)
[摘要]目的评价经外周静脉移植脐带间充质干细胞治疗乙型肝炎肝硬化的临床效果。方法选择乙型肝炎肝硬化患者60例,分为治疗组和对照组各30例,治疗组在内科综合治疗的基础上给予脐带间充质干细胞移植治疗,对照组给予内科综合治疗。观察2组治疗后2、4、12、24周生化指标变化情况、临床症状改善情况及不良反应发生情况。结果治疗4周后,治疗组乏力、腹胀、食欲、腹腔积液改善率均高于对照组,差异有统计学意义(P<0.05)。2组随治疗时间延长丙氨酸转氨酶、天冬氨酸转氨酶、总胆红素均呈下降趋势,时点间差异有统计学意义(P<0.05),组间、组间·时点间交互作用差异无统计学意义(P>0.05);白蛋白、胆碱酯酶、凝血酶原活动度均呈升高趋势,时点间、组间·时点间交互作用差异有统计学意义(P<0.05),组间差异无统计学意义(P>0.05)。2组均未发生不良反应和并发症。结论经外周静脉移植脐带间充质干细胞治疗乙型肝炎肝硬化安全有效。
[关键词]肝硬化;乙型肝炎;间质干细胞移植
肝硬化是以肝组织弥漫性肝纤维化、假小叶和再生结节为组织学特征的进行性慢性肝病,是众多肝病的终末期阶段。每年新增肝硬化患者30万左右[1],死于肝硬化及其并发症者近50万[2]。由乙型肝炎病毒导致的肝硬化占肝硬化患者总数的80%左右[3]。目前治疗终末期或失代偿期肝硬化最有效的方法为肝移植,但肝移植也伴随着诸多问题,如肝源缺乏、长期服用免疫抑制剂、手术费用昂贵等,限制了其临床广泛应用。干细胞移植技术的发展为肝硬化的治疗提供了一条新途径。脐带间充质干细胞来源丰富,取材方便,无伦理问题,且细胞含量高、增殖能力强、免疫原性低,越来越受到研究者的关注[4],被广泛应用于肝脏疾病的临床研究,并取得了一定的疗效[5-7]。本研究采用经外周静脉移植脐带间充质干细胞方法治疗乙型肝炎肝硬化患者,并对其安全性及临床疗效进行评估,现报告如下。
1.1 一般资料 选取2012年9月—2015年9月我院诊治的乙型肝炎肝硬化患者60例,均符合2000年《病毒性肝炎防治方法》中肝硬化的临床诊断标准。排除标准:确诊肝脏或其他脏器肿瘤;重型肝炎急性期;严重感染;消化道大出血;肝肾综合征;Ⅲ期以上肝性脑病;严重脑、心、肺疾病以及衰竭状态患者;有精神疾病者;高度过敏体质者。采用单盲、平行对照分为治疗组和对照组。治疗组30例,男性17例,女性13例,年龄33~72岁,平均(55.97±9.08)岁;Child-Pugh分级:A级7例,B级12例,C级11例;乙型肝炎病毒DNA<102U/mL 12例,102~104U/mL 8例,>104U/mL 10例;腹腔积液22例。对照组30例,男性18例,女性12例,年龄33~71岁,平均(55.53±9.27)岁;Child-Pugh分级:A级6例,B级14例,C级10例;乙型肝炎病毒DNA<102U/mL 13例,102~104U/mL 6例,>104U/mL 11例;腹腔积液23例。2组性别、年龄、Child-Pugh分级、病毒复制、腹腔积液情况差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会许可,所有患者均签署知情同意书。
所有患者均给予口服核苷类药物抗病毒、保肝降酶等内科综合治疗。治疗组在此基础上给予脐带间充质干细胞输注治疗。
1.2 脐带间充质干细胞制备 选择健康产妇,排除艾滋病、梅毒、乙型肝炎、丙型肝炎及其他传染性疾病,无病理妊娠者,并获产妇同意并签署知情同意书。脐带自手术台取下后,浸入含抗生素的0.9%氯化钠注射液中,4 ℃保存,在超净台取出脐带,用PBS冲洗干净脐静脉和脐动脉内的残余血液,用剪刀和止血钳清除上述血管,将脐带剪成1 mm3大小的组织块,通过100 目筛网过滤并收集细胞。置于37 ℃,5% CO2培养箱进行培养。3 d后更换培养液,弃去杂质和未贴壁的细胞,第6~7天后显微镜下可见贴壁生长的单个梭形细胞从组织块中游离出来,再次更换培养液。待细胞长到80%融合时,用0.25%胰蛋白酶进行消化;将细胞悬液1 500 r/min离心5 min,原代细胞以1∶1的比例进行传代,记为P1代。直至细胞彼此融合,铺满瓶底再重复上述操作。P2代以后按1∶3或1∶4的比例传代。脐带间充质干细胞传代到第3代,镜下观察,可见细胞贴壁良好,融合密度达85%。进行流式染色后,流式细胞仪上机检测细胞表型确定为脐带间充质干细胞。收集培养至第4代的细胞。
1.3 细胞回输 经外周静脉回输脐带间充质干细胞,输注前20 min给予肌肉注射苯海拉明注射液20 mg,输注前后给予生理盐水100 mL冲管。每次回输的脐带间充质干细胞数量为(2~4)×107/mL,用生理盐水稀释至100 mL,静脉滴注。每半月输注1次,共2次。
1.4 疗效评估 治疗前及治疗后2、4、12、24周检测患者丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、胆碱酯酶(cholinesterase,CHE)、凝血酶原活动度(prothrombin activity,PTA)水平,观察临床症状乏力、腹胀、食欲的改善情况,腹部超声了解腹腔积液情况,观察治疗后不良反应、病死率及肝癌发生率。
1.5 统计学方法 应用SPSS 17.0统计学软件进行数据分析。计量资料比较采用重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2.1 临床症状改善情况 治疗4周后,治疗组乏力、腹胀、食欲、腹腔积液改善率高于对照组,差异有统计学意义(P<0.05),见表1。
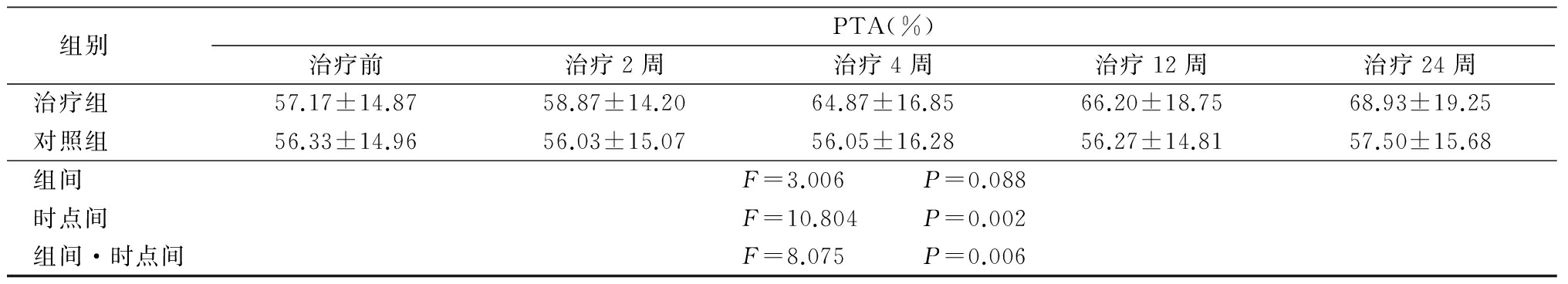
2.2 生化指标改善情况 2组随治疗时间延长ALT、AST、TBIL均呈下降趋势,时点间差异有统计学意义(P<0.05),组间、组间·时点间交互作用差异无统计学意义(P>0.05);ALB、CHE、PTA均呈升高趋势,时点间、组间·时点间交互作用差异有统计学意义(P<0.05),组间差异无统计学意义(P>0.05)。见表2。
2.3 不良反应 随访24周2组均未发生不良反应和并发症,无肝癌发生,无死亡患者。
表1 2组临床症状改善情况比较
Table 1 Changes of clinical symptoms of two groups (n=30,例数,%)

表2 2组生化指标变化
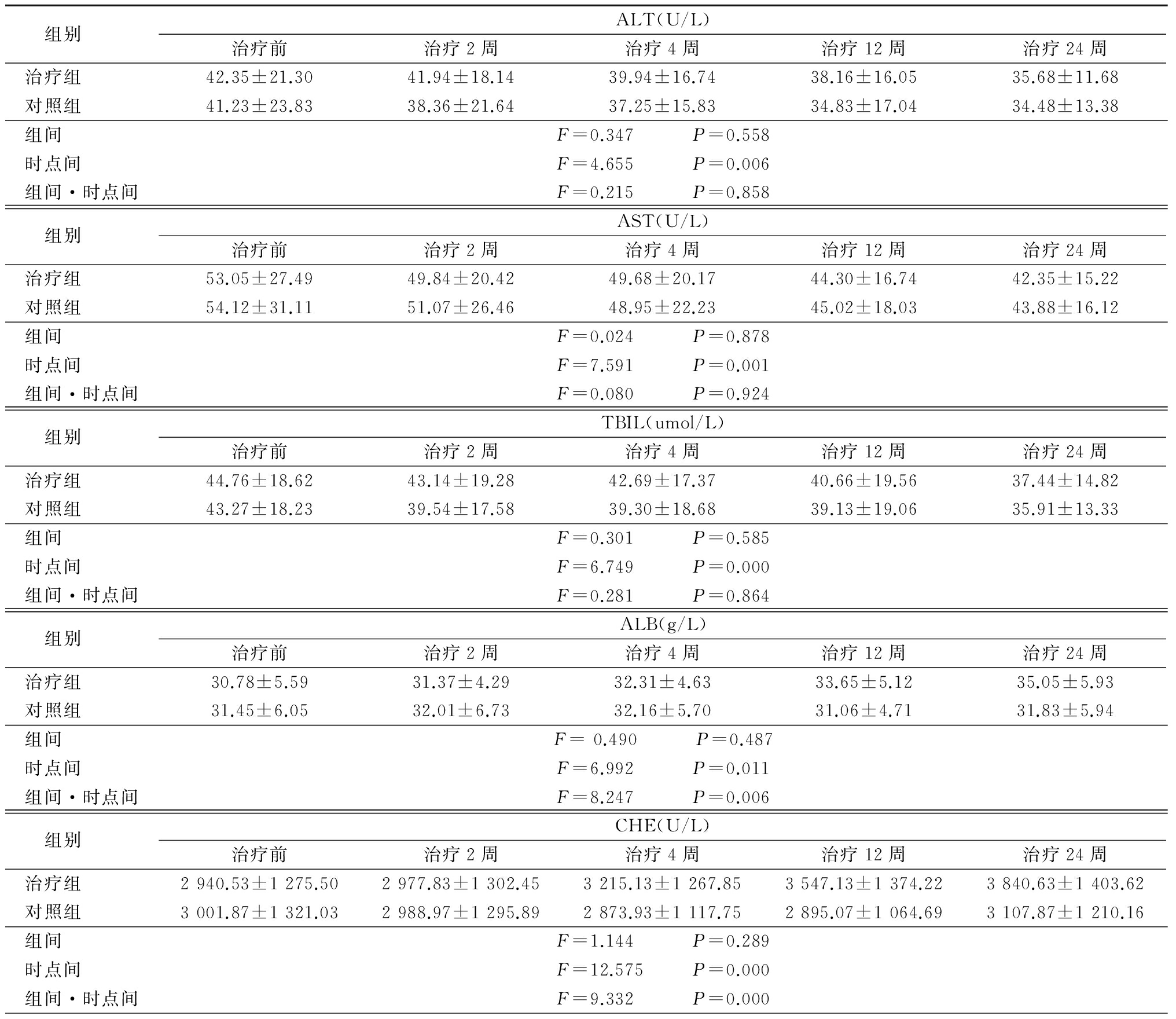
表2 (续)
肝硬化是严重威胁人类健康的肝脏疾病,常并发上消化道出血、肝性脑病、继发感染等而死亡,内科治疗手段有限。脐带间充质干细胞起源于中胚层,可以分化为中胚层的间质组织,具备干细胞的2个重要特征,即自我更新和多向分化潜能,具有减轻和消除炎症、修复组织损伤、免疫调节和改善造血等生物学功能,已越来越多地应用于器官损伤的治疗,为肝硬化的治疗提供了一种新方法。Yang等[8]给肝硬化小鼠通过尾静脉注入脐带间充质干细胞,结果显示血清ALT水平显著降低,血清ALB水平显著升高,表明脐带间充质干细胞移植可以改善小鼠的肝功能,还发现间充质干细胞发挥治疗作用的机制为可以分化为肝细胞样细胞。Hong等[9]通过动物实验证实给肝硬化小鼠注入脐带间充质干细胞可以通过分解胶原纤维改善肝硬化的程度。本研究通过外周静脉途径移植脐带间充质干细胞治疗乙型肝炎肝硬化患者,并对其安全性和临床疗效进行分析。
本研究结果发现,2组治疗随时间延长ALB、CHE、PTA水平呈升高趋势,ALB、CHE、PTA均为肝脏合成功能的指标,提示脐带间充质干细胞可以改善肝硬化患者的合成功能,其可能机制为:①干细胞“归巢”到达受损伤的肝脏后可以分化为功能性肝细胞,抑制肝细胞的凋亡,分泌多种生物活性因子促进肝细胞的再生[10-12];②肝纤维化是所有慢性肝病的共同病理基础,干细胞抑制肝纤维化[13-17]可能为其改善肝功能的机制之一;③氧化应激反应诱发肝损伤,干细胞的抗氧化活性起到了降低肝损伤的作用[18];④炎症细胞浸润和免疫损伤在肝硬化的发生发展过程中起了重要推动作用,研究证明干细胞可表达各种可溶性因子,如前列腺素E2、吲哚胺2,3双加氧酶、白细胞介素6、白细胞介素10和人白细胞抗原G,这些可溶性因子可调节各种免疫细胞的增殖和功能[19],另外干细胞可以减少CD4+T细胞的浸润和激活,抑制Th1辅助细胞,诱导调节性T细胞,并可调控树突细胞,树突细胞通过表皮生长因子β的产生诱导调节性T细胞分化[20]。本研究结果还显示,2组随治疗时间延长ALT、AST、TBIL均呈下降趋势,但2组的改善趋势无差异,考虑2组ALT、AST、TBIL治疗后较治疗前降低与保肝降酶效果显著有关,影响了脐带间充质干细胞对上述指标的改善效果。
本研究结果显示,治疗组临床症状明显改善,未发生与干细胞移植相关的不良反应,安全性好。既往有研究指出干细胞可通过直接转化、抑制抗肿瘤免疫反应和对肿瘤细胞的营养作用等导致肿瘤发生[21]。但也有报道认为干细胞移植可能对肝硬化患者发挥了更好的保护作用,防止了肝癌发生[22]。本研究2组乙型肝炎肝硬化患者随访24周均无肝癌发生,进一步说明了脐带间充质干细胞治疗的安全性。
综上所述,经外周静脉移植脐带间充质干细胞治疗乙型肝炎肝硬化患者,可以改善其肝功能和临床症状,无严重不良反应发生,安全有效,与既往报道的脐带间充质干细胞移植可以改善患者肝功能的结果相似[5-7]。但本研究病例数量少,随访时间短,仍需设计大样本对照试验进行长期随访观察。
[参考文献]
[1] 杨上文,汪剑波,叶斌,等.食管静脉曲张与胃左静脉血流动力学的关系[J].现代实用医学,2015,27(11):1445-1446.
[2] 汪建中.肝硬化腹水的临床治疗效果观察[J].现代诊断与治疗,2013,24(17):4030.
[3] 蒋兆荣,顾生旺,刘欢,等.益气散结消臌汤配合西药治疗乙肝肝硬化腹水的临床观察[J].中国中医急症,2015,24(11):2000-2002.
[4] 韩华,薛改,张俊勤,等.人脐带间充质干细胞的分离、培养及鉴定[J].河北医科大学学报,2015,36(1):21-23.
[5] Xue HL,Zeng WZ,Wu XL,et al. Clinical therapeutic effects of human umbilical cord-drived mesenchymal stem cells transplantation in the treatmentof end-stage liver disease[J]. Transplant Proc,2015,47(2):412-418.
[6] Yu SJ,Chen LM,Lyu S,et al. Safety and efficacy of human umbilical cord derived-mesenchymal stem cell transplantation for treating patients with HBV-related decompensated cirrhosis [J]. Zhonghua Gan Zang Bing Za Zhi,2016,24(1):51-55.
[7] 佟立新,张岁,闫宝勇,等.人脐带间充质干细胞经外周静脉移植治疗失代偿期肝硬化的临床疗效[J].世界华人消化杂志,2015,23(15):2457-2462.
[8] Yang L,Wang Y,Wang X,et al. Effect of allogeneic umbilical cord mesenchymal stem cell transplantation in a rat model of hepatic cirrhosis [J]. J Tradit Chin Med,2015,35(1):63-68.
[9] Hong J,Jin H,Han J,et al. Infusion of human umbilical cord-derived mesenchymal stem cells effectively relieves liver cirrhosis in DEN-induced rats[J]. Mol Med Rep,2014,9(14):1103-1111.
[10] Eow YW,Shim KY,Baik SK. Mesenchymal stem cell therapy for liver fibrosis[J]. Korean J Intern Med,2015,30(5):580-589.
[11] Al Ghrbawy NM,Afify RA,Dyaa N,et al. Differentiation of bone marrow:derived mesenchymal stem cells into hepatocyte-like cells[J]. Indian J Hematol Blood Transfus,2016,32(3):276-283.
[12] Liu WH,Song FQ,Ren LN,et al. The multiple functional roles of mesenchymal stem cells in participating in treating liver diseases[J]. J Cell Mol Med,2015,19(3):511-520.
[13] Chai NL,Zhang XB,Chen SW,et al. Umbilical cord-derived mesenchymal stem cells alleriate liver fibrosis in rats[J]. World J Gastroenterol,2016,22(26):6036-6048.
[14] Hirata M,Ishigami M,Matsushita Y,et al. Multifaceted therapeutic benefits of factors derived from dental pulp stem cells for mouse liver fibrosis[J]. Stem Cell Transl Med,2016,5(10):1416-1424.
[15] Zhang LT,Fang XQ,Chen QF,et al. Bone marrow-derived mesenchymal stem cells inhibit the proliferation of hepatic stellate cells by inhibiting the transforming growth factor β pathway[J]. Mol Med Rep,2015,12(5):7227-7232.
[16] Meier RP,Mahou R,Morel P,et al. Microencapsulated human mesenchymal stem cells decrease liver fibrosis in mice [J]. J Hepatol,2015,62(3):634-641.
[17] 曹慧颖,邵鹏,石金升.骨髓间充质干细胞治疗肝纤维化研究进展[J].河北医科大学学报,2012,33(2):240-243.
[18] Quintanilha LF,Takami T,Hirose Y,et al. Canine mesenchymal stem cells show antioxidant properties against thioacetamide-induced liver injury in vitro and in vivo[J]. Hepatol Res,2014,44(10):E206-217.
[19] Sharma RR,Pollock K,Hubel A,et al. Mesenchymal stem or stromal cells:a review of clinical applications and manufacturing practices[J]. Transfusion,2014,54(5):1418-1437.
[20] Zhang Y,Cai W,Huang Q,et al. Mesenchymal stem cells alleviate bacteria-induced liver injury in mice by inducing regulatory dendritic cells[J]. Hepatology,2014,59(2):671-682.
[21] Khan AA,Parveen N,Mahaboob VS,et al. Safety and efficacy of autologous bone marrow stem cell transplantation through hepatic artery for the treatment of chronic liver failure:a preliminary study[J]. Transplant Proc,2008,40(4):1140-1144.
[22] Peng L,Xie DY,Lin BL,et al. Autologous bone marrow mesenchymal stem cell transplantation in liver failure patients caused by hepatitis B:short-term and long-term outcomes[J]. Hepatology,2011,54(3):820-828.
(本文编辑:赵丽洁)
Therapeutic effect of human umbilical cord mesenchymal stem cells transplantation via peripheral vein in the treatment of hepatitis B liver cirrhosis
ZHANG Sui, JIA Bei, GUO Cui-min, WANG Hai-fang, ZHOU Jing*
(Department of Live Disease Diagnoses and Treatment Center of Chinese Western Medicine,the First Hospital of Hebei Medical University,Shijiazhuang050031,China)
Abstract:Objective To evaluate the curative effect of peripheral vein transplant human umbilical cord mesenchymal stem cells on patients with hepatitis B liver cirrhosis. Methods Sixty patients with hepatitis B liver cirrhosis were equally divided into treatment group and control group. The treatment group was given umbilical cord mesenchymal stem cell transplantation on the basis of comprehensive medical treatment and the control group was adapted with the comprehensive medical treatment. The changes of biochemical indexes, clinical symptoms and the occurrence of adverse reactions at 2, 4, 12 and 24 weeks before and after treatment were observed. Results After 4-week treatment, the improvement rate of fatigue, abdominal distension, appetite and ascites in the treatment group were higher than that in the control group and the differences have statistical significance(P<0.05). With time extension, alanine aminotransferase, aspartate aminotransferase and total bilirubin of the two groups were decreased, there was significant difference of time dissimilarity between two groups(P<0.05), but there were no significant differences of interblock and interaction of interblock with time dissimilarity between two groups(P>0.05). The albumin, cholinesterase and prothrombin activity showed an increasing trend and there were significant differences of time dissimilarity and interaction of interblock with time dissimilarity between two groups(P<0.05), but there was no significant difference of interblock between two groups(P>0.05). There were no suffered severe complications and adverse reactions in all groups. Conclusion Human umbilical cord mesenchymal stem cell transplantation via peripheral vein in the treatment of hepatitis B liver cirrhosis is safe and effective.
[Key words]liver cirrhosis;hepatitis B;mesenchymal stem cell transplantation
[收稿日期]2016-11-24;
[修回日期]2017-01-03
[基金项目]河北省医学科学研究重点课题(20150636)
[作者简介]张岁(1982-),女,河北辛集人,河北医科大学第一
[中图分类号]R575.2
[文献标志码]A
[文章编号]1007-3205(2017)03-0270-05
doi:10.3969/j.issn.1007-3205.2017.03.006
医院主治医师,医学硕士,从事肝脏疾病诊治研究。
*通讯作者。E-mail:zj21362165@126.com