·论 著·
商书霞1,宋光耀2*,赵军魁1,张俊霞1, 郭洪涛1,李 玲1
(1.冀中能源峰峰集团有限公司总医院内分泌科, 河北 邯郸 056200;2.河北省人民医院内分泌科, 河北 石家庄 050051)
[摘要]目的探讨正常范围内血清总胆红素(total bilirubin,TBIL)水平与2型糖尿病患者下肢动脉粥样硬化性病变(lower extremity atherosclerotic disease,LEAD)的关系。方法2型糖尿病患者431例,收集其血清TBIL、踝肱指数(ankle brachial index,ABI)、临床一般资料及其他生化指标,根据血清TBIL分为4组:Q1组(TBIL≤8.9 μmol/L)106例,Q2组(TBIL 9.0~11.9 μmol/L)106例,Q3组(TBIL 12.0~17.1 μmol/L)110例,Q4组(TBIL≥17.2 μmol/L)109例。结果Q2组、Q3 组和Q4组SBP低于Q1组,Q3组、Q4组FPG和HbA1c低于Q2组,Q4组LDL-C低于Q2组, Q3组LEAD发生率低于Q1组,Q4组LEAD发生率低于Q1组、Q2组,差异均有统计学意义(P<0.05);Logistic回归分析显示,TBILOR值及95%CI为0.907(0.866~0.950)是LEAD的保护因素,HbA1cOR值及95%CI为1.113(1.018~1.217)、病程OR值及95%CI为1.034(1.005~1.064)是LEAD发病的危险因素。结论正常范围内血清TBIL水平的降低与2型糖尿病患者LEAD的发生有关。
[关键词]糖尿病,2型;血清胆红素;踝肱指数
糖尿病是一组由遗传和环境因素共同作用所致的代谢性疾病,其血管并发症是糖尿病致残和死亡的主要原因,而下肢动脉粥样硬化性病变(lower extremity atherosclerotic disease,LEAD)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的严重慢性并发症之一,LEAD可导致糖尿病足、坏疽甚至截肢等严重后果。血清胆红素(total bilirubin,TBIL)的生成:血液循环中衰老红细胞通过单核-吞噬细胞系统的破坏释放出血红蛋白,并分解成游离珠蛋白和血红素,血红素在血红素氧合酶(heme oxygenase 1,HO-1)作用下进一步降解为胆绿素、一氧化碳和游离铁离子,而胆绿素通过胆绿素还原酶催化生成TBIL。Abbasi等[1]研究认为,TBIL水平的升高是T2DM发病的潜在保护因素,TBIL可清除氧自由基,抑制脂质及脂蛋白氧化,特别是低密度脂蛋白胆固醇(low-density lipoprotein,LDL-C)的氧化[2]。Sahin 等[3]研究结果显示,血清TBIL水平与周围动脉粥样硬化密切相关。本研究以431例T2DM住院患者为临床研究对象,探讨正常范围内血清TBIL水平与T2DM患者LEAD的相关性及可能的临床意义。
1.1 一般资料 收集2013年9月—2014年12月在河北省人民医院内分泌科住院的T2DM患者431例,男性238例,女性193例,年龄41~83岁;平均(63.48±11.26)岁;病程1~25年;平均(10.52±7.67)年;收集研究对象的一般资料,包括姓名、性别、年龄、病程、降血糖药物及他汀类药物应用情况;进行体格检查,包括身高、体质量、体质量指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastol blood pressure,DBP);记录有无高血压病(病程及治疗情况)、下肢症状(是否出现静息痛、间隙性跛行、麻木)、冠心病、脑血管病史,近期是否服用过β受体阻滞剂、噻嗪类利尿剂及抗结核类药物。
应用经过校正的体质量秤清晨空腹时测量体质量,以千克(kg)为单位,数据精确到0.1 kg。测量身高时,被测者脱鞋,赤脚或仅保留袜子,脚跟靠拢,脚尖分开约60 °,双膝并拢挺直,脚跟、臀部及两肩胛骨间紧靠身高计的立柱上,头部保持正立位置,测量出身高,以厘米(cm)为单位,数据精确到0.1 cm。
所有研究对象的T2DM的诊断标准均符合世界卫生组织(1999年)制定的糖尿病诊断标准。LEAD诊断标准:①有下肢症状(间歇性跛行、下肢静息痛、足温低、毛发少或足部皮肤紫癜)、股动脉闻及杂音、足背动脉或胫后动脉搏动减弱或消失;②静息踝肱指数(ankle brachial index,ABI)<0.9,或运动后ABI下降20%;③超声多普勒检查显示下肢动脉硬化狭窄或闭塞性病变。排除标准:严重的肝脏及胆道疾病、肝功能受损,即丙氨酸转氨酶(alanine aminotransferase,ALT)和(或)天冬氨酸转氨酶(aspartate aminotransferase,AST)>80 U/L;1型糖尿病及其他内分泌疾病引起的继发性糖尿病、糖尿病酮症酸中毒、高血糖高渗状态等严重急性并发症;恶性肿瘤、营养不良、贫血及感染;严重心功能不全及肾功能不全。
1.2 研究方法
1.2.1 实验室检查 所有被测患者均禁食8~10 h,次日清晨空腹采集肘静脉血,分别测定空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2-hour post-meal glucose,2 hPG)、糖化血红蛋白(hemoglobin A1c,HbA1c)、总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、LDL-C、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、ALT、AST、TBIL。主要仪器分别为Hitachi7600型全自动生化分析仪(日本日立公司)、CENTRA CL3-R低温离心机(Thermo公司)、全自动酶标仪(芬兰雷勃公司)。
1.2.2 ABI测量 应用动脉硬化检查装置/血压脉波检查装置BP-203RPEⅢ(大连欧姆龙),检查ABI:检查前受检者禁止吸烟,事先排尿,脱掉厚重衣服及鞋袜,平卧在床上,伸直四肢,保持安静10 min,输入受检者姓名、性别、年龄等,安装上臂及脚踝袖带和传感器,开始测量。以ABI<0.9作为判断LEAD的标准。
1.2.3 LEAD超声诊断 应用高分辨率彩色血管多普勒超声诊断仪(荷兰飞利浦医疗公司,型号iU22)对所有患者进行下肢动脉超声检测,由专人进行操作,探头频率为3~9 MHz,分别检测股动脉、腘动脉、胫前动脉、胫后动脉、足背动脉,将发现的LEAD按病变性质分为3种:①动脉内中膜厚度(intima media thickness,IMT)≥1.0 mm;②单发、多发、弥漫斑块;③动脉狭窄≥30%。有以上3种病变中的任何一种,认为合并有LEAD。
1.3 统计学方法 应用SPSS 13.0统计软件包对资料进行分析。计量资料比较采用单因素方差分析和SNK-q检验;计数资料比较采用χ2检验;相关性采用Logistic回归分析。P<0.05为差异有统计学意义。
2.1 不同胆红素组一般资料、血压、转氨酶比较 所有受试者血清TBIL中位水平12.0 μmol/L ,根据血清TBIL分为4组:Q1组(TBIL≤8.9 μmol/L)106例,Q2组(TBIL 9.0~11.9 μmol/L)106例,Q3组(TBIL 12.0~17.1 μmol/L)110例,Q4组(≥17.2 μmol/L)109例。4组间性别、年龄、病程、BMI、DBP、ALT和AST差异均无统计学意义(P>0.05);Q2组、Q3 组和Q4组SBP低于Q1组,差异有统计学意义(P<0.05)。见表 1。
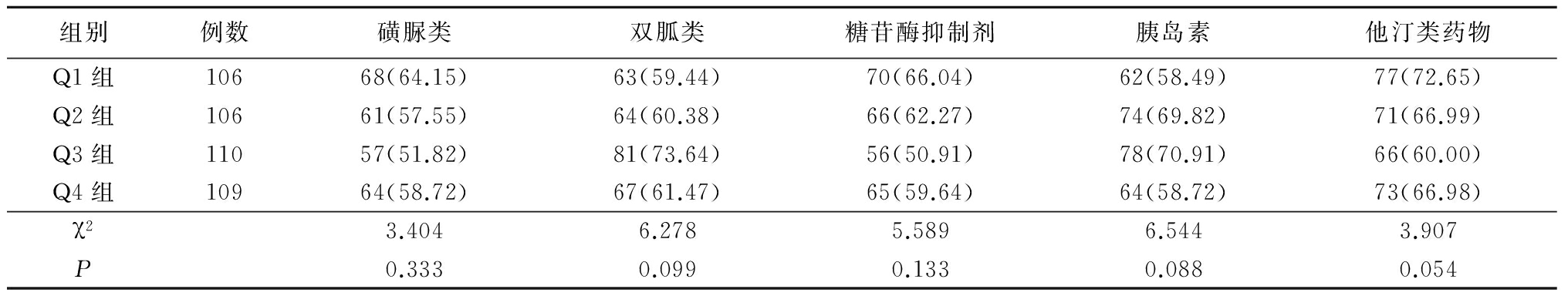
2.2 4组用药情况比较 4组应用磺脲类、双胍类、糖苷酶抑制剂及胰岛素降糖药和他汀类药物的比率差异均无统计学意义(P>0.05),见表2。
2.3 4组血糖血脂水平和LEAD发生率比较 4组间2 hPG、TC、TG、HDL-C差异无统计学意义(P>0.05);Q3组、Q4组FPG和HbA1c低于Q2组,Q4组LDL-C低于Q2组,Q3组LEAD发生率低于Q1组,Q4组LEAD发生率低于Q1组、Q2组,差异均有统计学意义(P<0.05)。见表3。
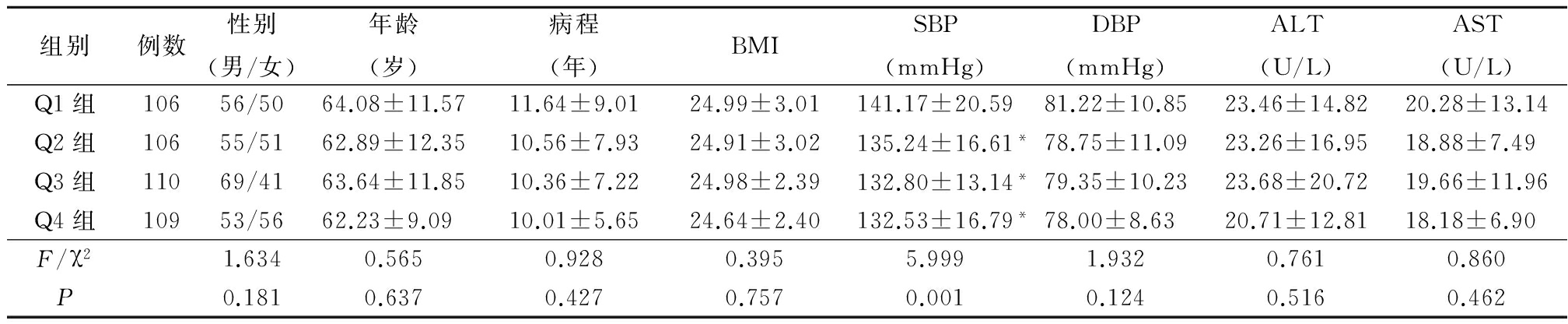
*P<0.05与Q1组比较(SNK-q检验)
表2 4组应用药物比较 (例数,%)
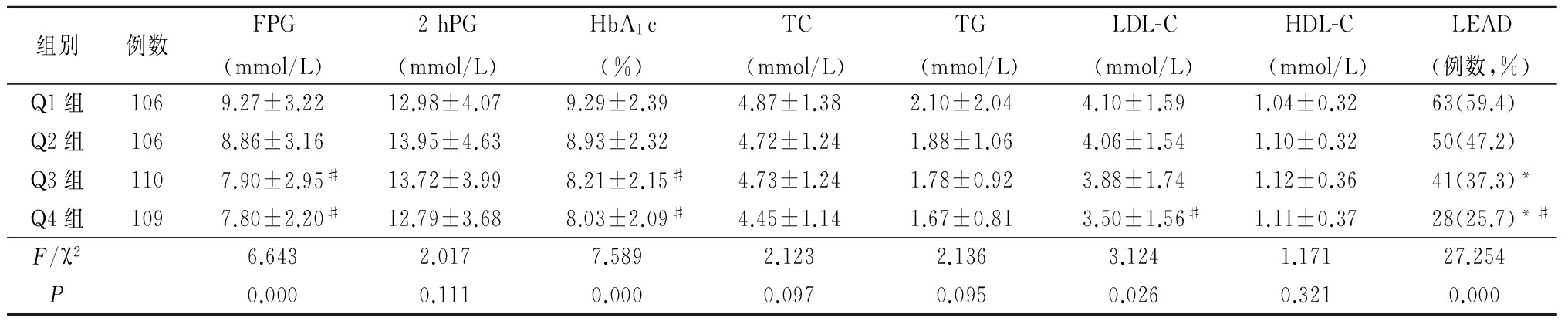
*P<0.05与Q1组比较 #P<0.05与Q2组比较(SNK-q检验或χ2检验)
2.4 Logistic回归分析 根据有无LEAD将研究对象分为LEAD 182例,非LEAD 249例。以有无合并LEAD为因变量(Y),以各危险因素为自变量(X),年龄(X1,>63岁=1,≤63岁=0)、病程(X2,>10年=1,≤10年=0)、BMI(X3,>24=1,≤24=0)、SBP(X4,>140 mmHg=1,≤140 mmHg=0)、DBP(X5,>80 mmHg=1,≤80 mmHg=0)、FPG(X6,>7.0 mmol/L=1,≤7.0 mmol/L=0)、2 hPG(X7,>11.1 mmol/L=1,≤11.1 mmol/L=0)、HbA1c(X8,>6.5%=1,≤6.5%=0)、TC(X9,>5.7 mmol/L=1,≤5.7 mmol/L=0)、TG(X10,>1.7 mmol/L=1,≤1.7 mmol/L=0)、LDL-C(X11,>4.53 mmol/L=1,≤4.53 mmol/L=0)、HDL-C(X12,>1.55 mmol/L=1,≤1.55 mmol/L=0)、ALT(X13,>40 U/L=1,≤40 U/L=0)、AST(X14,>40 U/L=1,≤40 U/L=0)、TBIL(X15,>12 μmol/L=1,≤12 μmol/L=0)建立回归方程,最终有3个自变量选入回归方程,提示TBIL为LEAD的保护因素,而HbA1c、病程是LEAD发病的危险因素,见表4。
表4 LEAD患者相关危险因素的Logistic回归分析

TBIL是人体内衰老红细胞的代谢产物,经肝脏加工后的胆红素为直接胆红素,未加工的胆红素为间接胆红素,两者合称TBIL。在既往临床工作中,TBIL常被作为肝胆系统疾病的诊断指标。有研究显示TBIL具有抗炎和抗氧化作用[4]。陈如法[5]研究也显示,TBIL可通过抗炎、抗氧化作用改善心脏舒张功能。LEAD是T2DM患者的主要大血管并发症之一,其病理生理基础可能为动脉粥样硬化。Gomez等[6]在研究中发现,动脉粥样硬化发病机制可能与氧化应激相关,而TBIL具有内源性抗氧化应激作用,故TBIL是否通过影响氧化应激途径阻止糖尿病LEAD的发生发展,已成为目前研究者的课题之一。
金京等[7]在综述中提示,动脉粥样硬化的病理基础可能与氧化应激及内皮功能紊乱相关,而TBIL具有内源性抗氧化应激作用。Liu等[8]在对糖尿病大鼠的研究结果也显示,TBIL可通过激活磷脂酰肌醇-3-激酶/丝氨酸-苏氨酸激酶/内皮型一氧化氮合酶(PI3K/Akt/eNOS)级联信号传导通路,致一氧化氮的生物利用度提高,从而增强HO-1对血管的保护作用。Jung等[9]于2007-2011年期间对韩国3个地区5 960例男性非糖尿病人群进行了4年纵向观察研究,结果发现与血清TBIL最低组相比,T2DM发病率在血清TBIL最高组中明显降低。由此可见,血清TBIL水平可作为健康人群T2DM发生发展的预测因子。本研究结果显示,与血清TBIL中Q1组相比,Q3、Q4组LEAD明显降低,Logistic回归分析提示血清TBIL的降低可能参与糖尿病LEAD的发生发展,TBIL为LEAD的保护因素。血清TBIL与糖尿病LEAD的相关机制可能如下:①活性氧(reactive oxygen speies,ROS)由血管内皮细胞、平滑肌细胞、外膜成纤维细胞等多种细胞产生,氧化应激时,ROS在体内或细胞内过量蓄积,可能直接导致了内皮细胞功能障碍[10]。同时,在氧化应激时,HO-1的表达上调,增加了TBIL的水平,从而对组织和细胞起到保护作用,故血清TBIL降低可致血管内皮功能紊乱,导致动脉粥样硬化的发生发展。②TBIL可抑制平滑肌细胞的增殖,防止动脉粥样硬化作用。国内有研究显示,与正常对照组人群相比,TBIL水平在血管病变特别是冠状动脉血管病变患者中是降低的[11]。Kim等[12]对韩国1 711例2型糖尿病患者进行研究也显示,低TBIL水平可增加女性T2DM患者动脉粥样硬化的发生率。③TBIL可以有效清除超氧自由基,抑制LDL-C氧化和高胆固醇血症诱导的DNA损伤,因此可以阻止动脉粥样硬化发生和发展[6]。本研究还发现,随着血清TBIL水平的升高,SBP、DBP降低。Chung等[13]对1746例T2DM患者的一项横断面研究发现,随着血清TBIL水平的升高,高血压发生率有所降低。McCallum 等[14]对12 000例高血压人群进行研究也发现,正常范围内血清TBIL水平的升高,与其病死率和血压的控制有关。提示血清TBIL水平是影响血压波动的重要因素之一,其影响血压机制可能与TBIL能改善动脉粥样硬化患者内皮依赖性血管舒张功能有关[15]。
本研究结果显示FPG、HbA1c、LDL-C也随着血清TBIL水平的升高而降低,与国外临床研究结果相似[16]。Dullaart等[17]对T2DM患者研究显示,随着血清TBIL水平降低,TG升高,而HDL-C降低,经Logistic回归分析,调整性别、年龄和BMI后,TG仍与血清TBIL呈负相关,HDL-C仍与血清TBIL呈正相关。表明血清TBIL水平的降低影响血脂代谢,并可能同时参与了动脉粥样硬化的形成。TBIL影响脂质代谢的可能机制为:①TBIL可影响血脂合成和排泄;②TBIL可提高胰岛素敏感性、葡萄糖的吸收速率,从而影响血脂的代谢[18]。本研究中,年龄、病程、BMI、2 hPG、ALT、AST、HDL-C与血清TBIL水平之间未得出相关性结果,这可能与本研究样本量较小有关。
综上所述,随着血清TBIL水平的升高,T2DM患者LEAD的发病率下降,提示血清TBIL的降低可能与T2DM患者LEAD的发生发展存在相关性,具有内源性抗氧化性的血清TBIL,可在T2DM患者LEAD早期干预中具有重要作用,而且,如何合理利用TBIL的抗氧化作用,将成为T2DM患者大血管病变预防与治疗的研究目标。
[参考文献]
[1] Abbasi A,Deetman PE,Corpeleijn E,et al.Bilirubin as a potential causal factor in type 2 diabetes risk:a Mendelian randomization study[J]. Diabetes,2015,64(4):1459-1469.
[2] O′Malley SS Wu R,Mayne ST,et al. Smoking cessation is followed by increases in serum bilirubin an endogenous antioxidant associated with lower risk of lung cancer and cardiovascular disease[J]. Nicotine Tob Res,2014,16(8):1145-1149.
[3] Sahin O,Akpek M,Elcik D,et al. Bilirubin levels and the burden of coronary atherosclerosis in patients with STEMI[J]. Angiology,2013,64(3):200-204.
[4] Qaisiya M,Coda Zabetta CD,Bellarosa C,et al. Bilirubin mediated oxidative stress involves antioxidant response activation via Nrf2 pathway[J]. Cell Signal,2014,26(3):512-520.
[5] 陈如法.原发性高血压患者血清胆红素水平与左心室舒张功能的相关性研究[J].河北医科大学学报,2013,34(5):598-600.
[6] Gomez M,Vila J,Elosua R,et al. Relationship of lipid oxidation with subclinical atherosclerosis and 10-year coronary events in general population[J]. Atherosclerosis,2014,232(1):134-140.
[7] 金京,李强.2型糖尿病下肢血管病变相关危险因素研究进展[J].临床荟萃,2015,30(5):597-600.
[8] Liu J,Wang L,Tian XY,et al.Unconjugated bilirubin mediates heme oxygenase-1-induced vascular benefits in diabetic mice[J]. Diabetes,2015,64(5):1564-1575.
[9] Jung CH,Lee MJ,Kang YM,et al. Higher serum bilirubin level as a protective factor for the development of diabetes in healthy Korean men:a 4 year retrospective longitudinal study[J]. Metabolism,2014,63(1):87-93.
[10] Hall JE,Granger JP,do Carmo JM,et al. Hypertension:physiology and pathophysiology[J]. Compr Physiol,2012,2(4):2393-2442.
[11] 胡慧英,李志刚.老年冠心病及血运重建对QT离散度的影响[J].临床荟萃,2012,27(4):280-283.
[12] Kim ES,Mo EY,Moon SD,et al. Inverse association between serum bilirubin levels and arterial stiffness in Korean women with type 2 diabetes[J]. PLoS One,2014,9(10):e109251.
[13] Chung JO,Cho DH,Chung DJ,et al. The duration of diabetes is inversely associated with the physiological serum bilirubin levels in patients with type 2 diabetes[J]. Intern Med,2015,54(2):141-146.
[14] McCallum L,Panniyammakal J,Hastie CE,et al. Longitudinal blood pressure control,long-term mortality,and predictive utility of serum liver enzymes and bilirubin in hypertensive patients[J]. Hypertension,2015,66(1):37-43.
[15] Kang SJ,Lee C,Kruzliak P. Effects of serum bilirubin on atherosclerotic processes[J]. Ann Med,2014,46(3):138-147.
[16] Liu J,Dong H,Zhang Y. Bilirubin increases insulin sensitivity by regulating cholesterol metabolism,adipokines and pparγ Levels[J]. Sci Rep,2015,5:9886.
[17] Dullaart RP,de Vries R,Lefrandt JD. Increased large VLDL and small LDL particles are related to lower bilirubin in Type 2 diabetes mellitus[J]. Clin Biochem,2014,47(16/17):170-175.
[18] Dong H,Huang H,Yun X,et al. Bilirubin increases insulin sensitivity in leptin-receptor deficient and diet-induced obese mice through suppression of ER stress and chronic inflammation[J]. Endocrinology,2014,155(3):818-828.
(本文编辑:许卓文)
[收稿日期]2016-03-07;
[修回日期]2016-04-08
[基金项目]河北省医学科学研究重点课题(20160744)
[作者简介]商书霞(1973-),女,河北临漳人,冀中能源峰峰集团有限公司总医院副主任医师,医学硕士,从事内分泌及代谢疾病诊治研究。
*通讯作者。E-mail: sguangyao2@163.com
[中图分类号]R587.1
[文献标志码]B
[文章编号]1007-3205(2017)03-0339-05
doi:10.3969/j.issn.1007-3205.2017.03.022