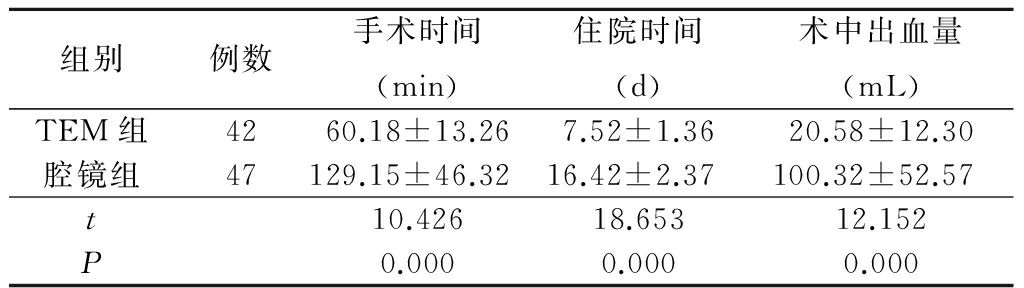
表1 2组手术时间、住院时间及术中出血量比较
![]() ±s)
±s)
·论 著·
李青科
1,何立芳
2,耿学辰
1,马国明
1,梁 磊
1,刘远廷
1*
(1.河北省唐山市人民医院胃肠外科,河北 唐山 063000;2.河北省唐山市丰润区人民医院内分泌肾内科,河北 唐山 064000)
[摘要]目的探讨经肛门内镜显微手术(transanal endoscopic microsurgery,TEM)联合术后放疗治疗早期直肠癌的的临床效果。方法89例早期直肠癌患者术前经电子肠镜、CT、MRI、腔内超声等检查证实为单发性病灶,无远处转移灶,无淋巴结转移。肠壁浸润深度为黏膜层或黏膜下层;术前病理取活组织检查组织类型为中、高分化腺癌;术前均未行新辅助放化疗。根据患者及家属意愿分为TEM组42例和腹腔镜下直肠癌根治术(腔镜)组47例,分别采用TEM和腹腔镜下直肠癌根治术;TEM组联合术后放疗。结果TEM组手术时间、住院时间、术中出血量、术后并发症种类和例数均少于腔镜组,差异有统计学意义( P<0.05)。结论TEM具有术中出血量少、手术时间短、术后并发症少、术后恢复快、住院时间短的优点,联合术后放疗治疗早期直肠癌是安全可靠的,具有与腹腔镜下直肠癌根治术相同的临床疗效。
[关键词]直肠肿瘤;经肛门内镜显微手术;化放疗
直肠癌是临床最常见的消化道恶性肿瘤之一, 据2015年公布的全球癌症统计结果显示,目前直肠癌发病率男性和女性分别位居第3位,死亡人数占全部恶性肿瘤死亡总人数的8%~9%,居恶性肿瘤第4位,其发病率和病死率每年呈现上升趋势 [1]。随着肿瘤医学理论知识和诊疗技术的不断发展,临床上对早期直肠癌发现率逐步提高。对于早期直肠癌,外科切除仍是首选方法。但直肠癌外科切除不仅要注重是否根治性切除,还必须考虑患者术后生活质量,尽量避免术中永久性造瘘,损伤盆腔、腹下神经丛造成排便、排尿及性功能障碍。多学科联合诊治,综合分析直肠癌患者病情,选择合理的外科手术方式,制定安全有效的治疗方案是治疗直肠癌的关键。经肛门内镜显微手术(transanal endoscopic microsurgery,TEM)和腹腔镜下直肠癌根治术都属于微创手术,但是TEM为局部切除术。为了证实TEM局部切除术后联合放疗也能够达到腹腔镜下直肠癌根治术相同的疗效,本研究对42例早期直肠癌患者采用TEM联合术后放疗,取得了较好效果,现报告如下。
1.1 一般资料 收集2013年1月—2015年1月河北省唐山市人民医院胃肠外科收治的直肠癌患者89例,所有患者术前经电子肠镜、CT、MRI、腔内超声等检查证实为单发性病灶,无远处转移灶,无淋巴结转移;肠壁浸润深度为黏膜层或黏膜下层;术前病理取活组织检查组织类型为中、高分化腺癌;术前均未行新辅助放化疗。临床与病理分期采用美国癌症联合委员会TNM分期(2010版)。根据患者及家属意愿分为TEM组42例,男性23例,女性19例,年龄42~78岁,平均(58.35±8.63)岁,肿瘤最大直径(1.54±0.39) cm, 肿瘤距肛缘距离(5.52±1.44) cm;腹腔镜下直肠癌根治术组(腔镜组)47例,男性28例,女性19例,年龄45~76岁,平均(60.14±4.45)岁,肿瘤最大直径(1.62±0.25) cm, 肿瘤距肛缘距离(5.34±1.38) cm。2组性别、年龄、肿瘤最大直径差异均无统计学意义( P>0.05),具有可比性。
所有患者术前均签署手术知情同意书。
1.2 手术器械 主要由特定的经肛直肠镜、腹腔镜显像系统和专用手术器械组成。手术应用德国进口STORZ手术系统设备,特殊的直肠镜外径4 cm,常用长度有2种型号分别为10 cm、20 cm(图1)。直肠镜前端是一斜形切口,当光源通过此切口时,术者能观察到更宽阔的视野范围;其后端是手术操作入口平台(图2),此平台上有一主接口与腹腔镜高清显像装置对接作为TEM显像系统(图3),通过光源摄像,术野能够清晰地呈现在显示屏上。为了维持直肠腔内压力相对恒定,在直肠镜光源摄像装置旁有一充气孔,与恒量恒压气腹机对接,使充入肠腔内CO 2压力保持相对稳定,一般维持在12~15 mmHg。肠腔内压力过大会造成肠壁过度扩张,压力过小无法使肠腔充盈建立有效的视野。另外,在操作平台下方有专用手术器械通过的袖套式密封进口。调节双球关节活动机械臂装置(Martin臂)将选定型号的直肠镜固定在手术台上,防止脱落(图4)。专用的手术器械包括针形高频电刀、5 mm超声刀、无损伤肠钳、分离钳、注射针、施夹器和吸凝棒等(图5)。
1.3 手术方法 常规术前肠道准备,给予复方聚乙二醇电解质散配置成2 000 mL温水冲服导泻;术前30 min预防性给予抗生素。麻醉方法多采用静脉吸入复合全身麻醉或腰硬联合麻醉。为利于术中手术操作,在摆放患者体位时需根据肿瘤所在肠壁位置调整合适体位,使肿瘤位置完全暴露在操作视野近下方。如肿瘤位于直肠前壁,需摆成折刀位;如肿瘤位于直肠后壁,需摆放成头低足高截石位;如肿瘤位于直肠侧壁,需摆放成侧卧位。体位摆放合适后,会阴肛门部常规消毒,铺盖无菌手术巾,充分扩肛后放置长度合适的直肠镜,调节操作视野范围,用Martin臂将其固定于手术台上,防止滑脱。为扩大视野持续注入CO 2(最大速率为6 L/min左右),气压一般控制自动调节为12~15 mmHg。确定无CO 2气体外漏后,在腔镜显像系统辅助下进行操作(图6),距离肿瘤边缘至少1 cm的黏膜下层注射肾上腺素盐水(1∶200 000),用针形电刀电灼标记切除边界,沿着预先标记线仔细切除,对T 1期直肠癌行全层切除,以保证肿瘤完整切除(图7,8)。切除后的肿瘤组织标本展平快速冰冻送病理检查以明确病变性质及环周切缘情况。若术中切缘回报阳性或出现大出血等并发症时,需中转腹腔镜下直肠癌根治术。检查有无活动性出血,止血确切后取合适长度的3-0号可吸收线,尾端银夹固定,给予连续缝合后再次银夹固定或采用3-0号可吸收倒刺线连续缝合创面(图9)。创面用蒸馏水冲洗后,关闭气腹机,退出直肠镜。
1.4 术后放疗 患者在术后2~4周内开始辅助放疗。均行盆腔三维适形放疗,6 MV X线,依据肿瘤位置选择放射野,照射范围为瘤床、直肠系膜和盆腔淋巴引流区,剂量是全盆腔DT 45~50 GY/5周。给予每日4野照射,每周5次,总共5周的放疗计划。放疗过程中均未出现肠梗阻,出现的腹泻、骨髓抑制、膀胱炎等并发症经对症处理后好转。
1.5 统计学方法 应用 SPSS 16.0统计学软件处理数据。计量资料比较采用独立样本的 t检验;计数资料比较采用χ 2检验。 P<0.05为差异有统计学意义。
2.1 2组手术时间、住院时间、术中出血量比较 89例患者均成功完成手术,未出现中转其他术式者。TEM组手术时间、住院时间、术中出血量均少于腔镜组,差异有统计学意义( P<0.05),见表1。
表1 2组手术时间、住院时间及术中出血量比较
![]() ±s)
±s)

2.2 2组术后并发症比较 TEM组术后并发症的种类和例数均少于腔镜组,差异有统计学意义( χ 2=11.766,P<0.05),见表2。
表2 2组术后并发症比较 (例数)

2.3 随访 随访时间截至2016年1月,主要采用门诊随访形式,并辅以电话随访。术后2年内,每3~6个月复查1次;第3年开始,每6个月复查1次。电话随访每月1次。复查主要包括血常规、肿瘤标志物系列、腹部盆腔 CT、电子肠镜。目前89例患者均在随访过程中(随访时间均>12个月),未出现肿瘤复发、转移,未出现死亡病例。
临床上对于已确诊的直肠癌患者,在符合手术指征的情况下首选外科手术治疗。经腹会阴联合直肠癌根治术、直肠癌前切除术是临床上治疗直肠癌的常用手术方式,尽管两者存在较高并发症,降低患者术后生活质量(如永久造瘘,排便、排尿困难及性功能障碍等) [2-3],但是能确保肿瘤完整切除,同时清扫周围淋巴结,预防肿瘤复发,提高无瘤生存期。然而,有临床研究显示对于早期直肠癌采用根治术仍有过度手术治疗之嫌 [4],尽管其能够清扫周围淋巴结,但是存在较高并发症,弊大于利。
19世纪初 Lisfranc报道成功地采用局部切除术方法治疗低位直肠癌(癌肿距肛缘距离≤7 cm)以来,局部切除术作为一种可根治性切除肿瘤的方式或姑息性切除肿瘤的方式,在临床上治疗直肠癌逐渐被接受,越来越多的的文献对其加以报道 [5-6]。癌肿侵犯直肠黏膜的深度与淋巴结发生转移密切相关。有学者通过研究直肠癌浸润肠壁深度与淋巴结转移关系,表明直肠黏膜几乎无淋巴引流,当癌灶局限于黏膜时几乎不会发生淋巴结转移 [7]。当病灶侵犯到黏膜下层时就会有发生淋巴结转移的可能;当病灶侵犯到肠壁肌层时,淋巴结转移的发生率会明显增加。这一观点已成为直肠癌可行局部切除术的理论基础。研究显示直肠癌 T 1、 T 2期病变的淋巴结转移率分别为10.1%、23% [8]。因此有学者认为对直肠癌(病变仅侵及黏膜层)癌灶及其周围1 cm行肠壁全层切除也能达到根治的目的。
近年来,随着人类对医学理论和临床实践的不断探索与研究,外科手术治疗直肠癌的选择上不断更新交替,有相关文献报道对于早期直肠癌( T 1 N 0 M 0),局部切除术甚至可以代替传统根治性手术。 TEM是一项治疗直肠肿瘤较新的局部切除术式,由德国 Buess首次应用于临床,可以做到微创、视野暴露好、精确切除,能够在内镜下完整切除、止血、缝合等操作,同时兼备传统的经肛门局部切除术与内镜下肠黏膜切除术2种术式的优点,具有手术时间短、术中及术后并发症少、创伤小、术后恢复快、住院时间短的优势,逐渐用于治疗直肠癌 [9-11]。本研究结果与文献报道大致相仿。
局部复发与原病灶肿瘤大小、分化程度、浸润肠壁深度及淋巴结转移密切相关。 TEM治疗早期直肠癌( T 1期)导致术后局部复发的危险因素包括癌肿侵犯肠壁达到黏膜下深度、环周切缘阳性、肿瘤最大直径大小、临床分期、有无淋巴结转移、年龄等 [12]。 TEM属于局部切除,其主要缺陷是不能清扫可能受累的淋巴结。尽管术前腔镜超声、盆腔 MRI诊断无淋巴结转移,但实际上对于与正常淋巴结大小相似的转移淋巴结很难明确诊断。局部复发的主要原因是淋巴结发生转移。直肠癌对放疗敏感,通过放疗杀灭亚临床病灶和潜在转移淋巴结,对预防局部复发有重要意义。目前尚无Ⅰ类证据证明直肠癌局部切除术后采取辅助放疗是否使患者最大受益。有大量研究术后放疗可有效降低直肠癌复发率,延长局部复发时间 [13-14]。也有观点认为对Ⅰ期低位直肠癌(分化程度好,未侵及脉管)患者行单纯局部切除术疗效可能较好,对高危者(分化程度低和侵及淋巴、血管)术后放疗价值待商榷。本研究中 TEM组术后均采用盆腔三维适形放疗能够降低因手术不能切除直肠系膜,留有潜在转移淋巴结从而导致术后可能复发的风险。三维适形放疗不仅可以使肿瘤靶区受到较高剂量照射,而且最大限度地保护周围正常组织,有效提高肿瘤靶区的照射率。三维适形放疗操作简便,实用性强,与常规放疗相比具有不良发应少的特点,从而提高患者生活质量。有报道显示盆腔三维适形放疗技术对放疗剂量均匀性控制优势明显,术后复发率低,直肠癌术后宜采用盆腔三维适形方法进行放射治疗 [15]。 TEM术后放疗,由于病理诊断明确,术中原病灶处留有银夹,使得瘤床范围更加准确,从而能避免过度治疗,相对也减少了放疗不良发应。
综上所述,早期直肠癌患者行 TEM治疗,必须严格把握手术适应证,术前应全面检查评估,对分化程度较好、未见淋巴结转移等低危 T 1 N 0 M 0期直肠癌患者可行 TEM, TEM联合术后放疗治疗早期直肠癌可以最小的创伤使患者受益最大化。(本文图见封三)
[参考文献]
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics,2015[ J]. CA Cancer J Clin,2015,65(1):5-29.
[2] Xu Y, Zhu JY, Chang EI, et al. Weakly supervised histopathology cancer image segmentation and classification[ J]. Med Image Anal,2014,18(3):591-604.
[3] 姚明辉,张宁夫.直肠癌外科手术的新进展[ J].中国社区医师:医学专业,2013,15(7):6.
[4] Atallah S, Nassif G, Polavarapu H, et al. Robotic- assisted transanal surgery for total mesorectal excision( RATS- TME): a description of a novel surgical approach with video demonstration[ J]. Tech Coloproctol,2013,17(4):441-447.
[5] Restivo A, Zorcolo L, D' Alia G, et al. Risk of complications and long- term functional alterations after local excision of rectaltumors with transanal endoscopic microsurgery( TEM)[ J]. Int J Colorectal Dis,2016,31(2):257-266.
[6] Osman KA, Ryan D, Afshar S, et al. Transanal endoscopic microsurgery( tem) for rectal cancer: university hospital of north tees experience[ J]. Indian J Surg,2015,77( Suppl3):930-935.
[7] 柯群刚,黄继超,郝占伟,等. T1~2期原发性直肠癌患者淋巴结转移的相关因素分析[ J/ CD].中华临床医师杂志:电子版,2015,9(14):2649-2651.
[8] 张晓路,王鑫,徐岩,等. T2期直肠癌淋巴结转移情况的临床病理因素分析[ J].中国医科大学学报,2014,43(2):142-145.
[9] 林国乐,邱辉忠,周皎琳,等.经肛门内镜微创手术治疗直肠肿瘤的临床研究[ J].中国全科医学,2016,19(3):254-259.
[10] 任辉,宫路路,刘晶晶,等.经肛门内镜下手术治疗直肠腺瘤和早期直肠癌[ J/ CD].中华结直肠疾病电子杂志,2013,2(3):119-122.
[11] 黄和艮,刘飞. TEM与腔镜治疗中上段早期直肠癌临床比较[ J].结直肠肛门外科,2015,21(2):103-105.
[12] 田衍,罗华友.老年直肠癌根治术后局部复发的危险因素分析[ J].中国普通外科杂志,2014,23(4):533-536.
[13] 梁博,屈国普,曾彪,等.直肠癌术后调强放疗不同射野参数的剂量学对比[ J].医疗装备,2016,29(13):28-30.
[14] 高浩基,张弢,赵任,等.影响直肠癌术后局部复发的因素[ J].中华胃肠外科杂志,2015,18(11):1176-1179.
[15] 刘可佳.直肠癌术后盆腔三维适形放疗、简化强调技术和适形调强放疗的三维剂量学比较分析[ J].中国当代医药,2015,22(14):60-62.
(本文编辑:许卓文)
[收稿日期]2016-11-15;
[修回日期]2017-02-06
[作者简介]李青科(1981-),男,河北邢台人,河北省唐山市人民医院主治医师,医学硕士,从事胃肠外科疾病诊治研究。
*通讯作者。E-mail:Helifang1125@126.com
[中图分类号]R735.37
[文献标志码]B
[文章编号]1007-3205(2017)04-0461-05
doi:10.3969/j.issn.1007-3205.2017.04.022