·论 著·
局部亚低温治疗对急性脑梗死患者疗效及可能作用机制的研究
宋德刚1,陈晓雪2*,李京龙3,王 芳4
(1.河北省秦皇岛市第一医院神经内科,河北 秦皇岛 066000;2.河北省秦皇岛市第一医院超声诊断科,河北 秦皇岛 066000;3.河北省秦皇岛市第一医院核磁共振科,河北 秦皇岛 066000;4.河北省秦皇岛市第一医院检验科,河北 秦皇岛 066000)
[摘要]目的观察局部亚低温对急性脑梗死患者的疗效,探讨局部亚低温作用机制。方法急性脑梗死患者100例随机分为对照组及治疗组各50例。对照组给予标准内科治疗;治疗组标准治疗同时给予局部亚低温治疗,保持脑温度在33~35 ℃并维持24 h。入院时及入院5 d行颅脑MRI检查计算脑梗死体积;亚低温治疗前及治疗后(发病72 h)采血检验血清超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malondialdehyde,MDA)浓度;发病3个月后行改良Rankin量表(modified Rankin scale,mRS)评分。结果2组患者入院时及入院5 d时新发脑梗死体积差异无统计学意义(P>0.05)。发病后72 h治疗组患者体内血清SOD浓度高于对照组,MDA低于对照组,治疗组预后良好(mRS评分<3分)患者多于对照组,差异均有统计学意义(P<0.05)。结论亚低温治疗可改善急性脑梗死患者预后,其机制可能为亚低温调控机体氧化应激反应。
[关键词]脑梗死;低温;预后
随着生活、饮食方式的转变及近年来我国人口老龄化进程的加剧,新发脑梗死发病率不断升高,严重威胁中老年人健康和影响其生活质量,给患者个人、家庭以及整个国家带来了严重的社会和经济负担。急性期静脉溶栓血管再通治疗仍为急性脑梗死患者最有效的治疗方法[1],但其具有严格禁忌证及狭窄的时间窗,很多缺血性脑卒中患者失去溶栓的机会,因此脑保护治疗对此类患者尤为重要。近年来亚低温治疗逐步成为缺血性脑损伤后脑保护治疗的研究热点,大量动物实验证实局部亚低温治疗对急性脑梗死具有明确的神经保护作用[2],但目前相关临床研究仍较少。本研究观察局部亚低温对失去溶栓机会的急性脑梗死患者梗死体积及预后的影响,旨在探讨局部亚低温对急性脑梗死患者的治疗作用。
1 资料与方法
1.1 一般资料 收集2013年1月—2015年10月就诊于河北省秦皇岛市第一医院神经内科的急性脑梗死患者100例,随机分别治疗组及对照组各50例。治疗组男性26例,女性24例,年龄39~78岁,平均(60.75±8.02)岁。对照组男性25例,女性26例,年龄42~79岁,平均(61.10±8.45)岁。2组性别、年龄、入院时美国国立卫生研究院率中量表(National Institutr of Health Stoke Scale,NIHSS)评分、新发梗死分布、入院时间、危险因素(包括高血压、糖尿病、房颤、高血脂、冠心病及既往卒中)差异均无统计学意义(P<0.05),具有可比性,见表1。
所有患者或知情委托人签署知情同意书,本院医学伦理委员会同意此研究。
表1 2组基线资料比较
Table 1 Patient characteristics in two groups (n=50)
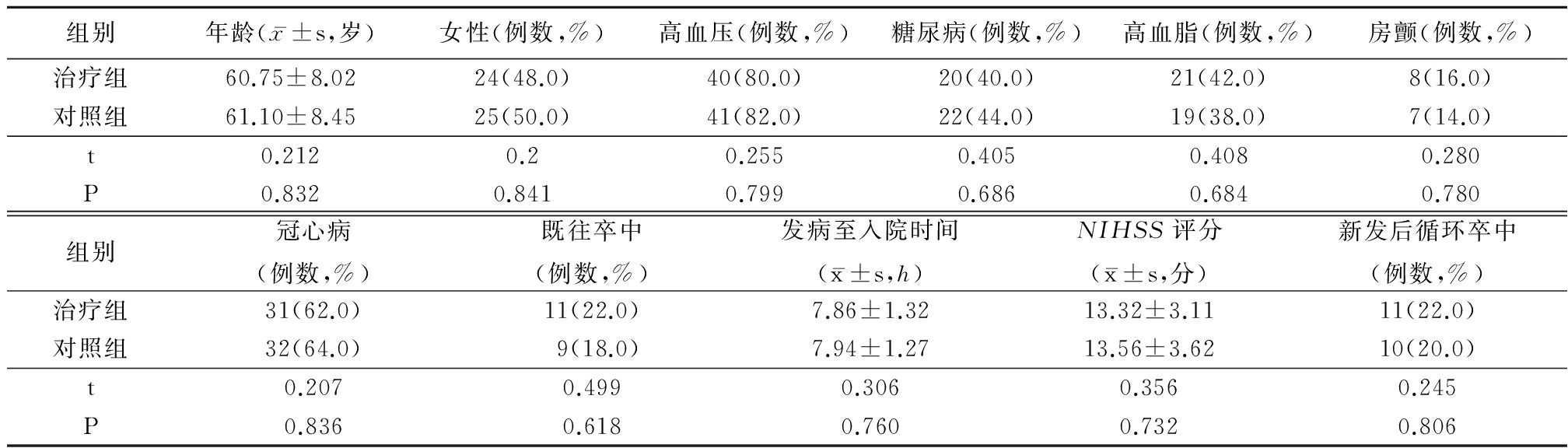
组别年龄(x-±s,岁)女性(例数,%)高血压(例数,%)糖尿病(例数,%)高血脂(例数,%)房颤(例数,%)治疗组60.75±8.0224(48.0)40(80.0)20(40.0)21(42.0)8(16.0)对照组61.10±8.4525(50.0)41(82.0)22(44.0)19(38.0)7(14.0)t0.2120.20.2550.4050.4080.280P0.8320.8410.7990.6860.6840.780组别冠心病(例数,%)既往卒中(例数,%)发病至入院时间(x-±s,h)NIHSS评分(x-±s,分)新发后循环卒中(例数,%)治疗组31(62.0)11(22.0)7.86±1.3213.32±3.1111(22.0)对照组32(64.0)9(18.0)7.94±1.2713.56±3.6210(20.0)t0.2070.4990.3060.3560.245P0.8360.6180.7600.7320.806
1.2 纳入标准及排除标准 纳入标准:年龄18~80岁;头颅MRI、磁共振扩散加权成像(diffusion weighted imaging,DWI)提示存在急性新发脑梗死;至医院就诊时超过发病4.5 h,小于发病24 h; NIHSS评分≥5分;住院治疗>7 d。排除标准:症状迅速改善或证实为短暂脑缺血发作(transient ischemic attack,TIA);继发梗死后出血;就诊时瞳孔散大、固定,生命体征不稳定;合并脑外伤、脑肿瘤、蛛网膜下腔出血、脑炎、动脉瘤、颅内静脉窦血栓等其他脑损伤疾病;合并严重脓毒症;存在严重凝血、肝肾功能障碍;孕妇;治疗过程中接受去骨瓣减压术;住院治疗<10 d;不能耐受MRI检查;未能配合随访行改良Rankin量表(modified Rankin scale,mRS)评估。
1.3 研究方法 2组患者均接受脑梗死标准治疗,包括控制危险因素、抗栓、营养神经、改善微循环、活血化瘀、酌情抗凝、脱水降颅内压、保持水电解质稳定,必要时化痰、抗炎、呼吸机通气、鼻饲饮食、导尿等治疗。治疗组在对照组治疗基础上开展颅脑局部亚低温治疗。应用密贴式冰帽亚低温治疗仪(HKAI,型号HGT-200Ⅳ),降温帽包裹患者头部开启降温仪,2 h左右逐步使患者鼓膜温度降至34 ℃并保持在33~35 ℃(脑温=鼓膜温±0.5 ℃)。维持亚低温状态24 h后,撤除低温设备,在室温下复温,使患者每6 h复温0.5 ℃左右。治疗过程中,给予小剂量镇静药物(咪达唑仑0.5~2 mg/h)静脉泵入辅助治疗控制寒战等并发症,监测患者意识、生命体征及瞳孔变化。如出现瞳孔显著变化,中止低温,积极复查CT,如出现显著寒战,镇静药物不能控制,可在呼吸机辅助呼吸支持下给予肌松药物。鼓膜温度测量方法:应用OMRON红外线耳式温度计测量鼓膜温度,降温过程中每15 min测量1次,维持及复温阶段1 h测量1次。
1.4 观察指标及疗效标准
1.4.1 新发脑梗死体积测量 入院时及入院5 d,2组患者行头颅MRI(SIANA EXCITE Ⅱ型1.5T)检查,应用DWI系统,记录新发梗死灶部位(皮质、皮质-皮质下、皮质下、脑干或小脑,前循环或后循环卒中)。应用开放源图像处理软件OsiriX 3.6.1对检查结果进行处理,应用感兴趣区分割功能,逐层分割获得梗死灶边缘,软件自动三维勾画梗死灶边缘并计算获得急性梗死灶体积[3]。脑梗死体积测量由MRI医师单独完成,影像医师对分组情况不知情。
1.4.2 血清超氧化物歧化酶(superoxide dismutase,SOD)及丙二醛(malondialdehyde,MDA)测定 入院时及治疗3 d(72 h)时静脉采血,监测2组患者SOD及MDA,SOD运用化学比色法、MDA运用硫代巴比妥酸比色法测定。试剂盒由南京建成生物工程研究所有限公司提供。按照试剂盒说明书配制各种试剂,测定严格按照操作规程完成。
1.4.3 mRS评分测量 患者出院后每2周至我院门诊复诊,详细记录患者病情变化、按时服用药物情况等,对患者随访3个月,在发病后3个月对其预后进行mRS评分,将患者按mRS评分分为预后良好(mRS评分<3分)和预后较差(mRS评分≥3 分)[4]。
1.5 统计学方法 应用SPSS 13.0软件进行数据分析。计量资料比较采用成组设计的t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组新发脑梗死体积比较 2组患者入院时及入院5 d时新发脑梗死体积差异均无统计学意义(P>0.05),见表2。
表2 2组入院时及入院5 d脑梗死体积比较
Table 2 Infarct volume at the first day and the fifth days after admission
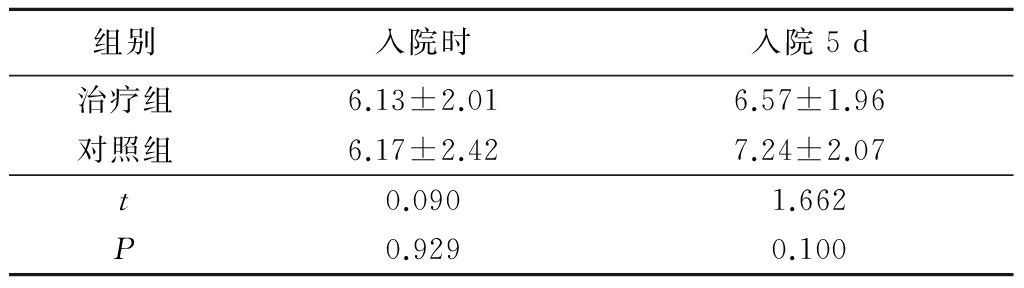
组别入院时入院5d治疗组6.13±2.016.57±1.96对照组6.17±2.427.24±2.07t0.0901.662P0.9290.100
2.2 2组SOD及MDA比较 入院3 d(梗死后72 h)治疗组患者体内血清SOD浓度高于对照组,MDA低于对照组(P<0.05),而入院时2组SOD和MDA差异无统计意义(P>0.05),见表3。
表3 2组低温治疗前后血清中SOD、MDA水平比较
Table 3 The serum levels of SOD and MDA before and after mild hypothermia therapy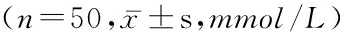
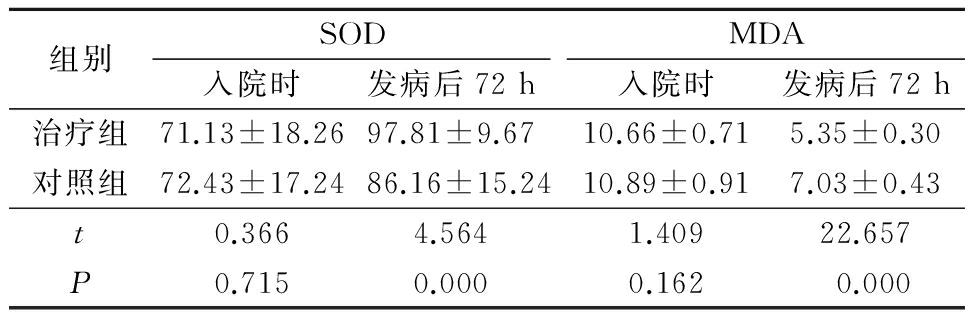
组别SOD入院时发病后72hMDA入院时发病后72h治疗组71.13±18.2697.81±9.6710.66±0.715.35±0.30对照组72.43±17.2486.16±15.2410.89±0.917.03±0.43t0.3664.5641.40922.657P0.7150.0000.1620.000
2.3 2组mRS评分比较 治疗组预后良好(mRS评分<3分)患者多于对照组,差异有统计学意义(P<0.05),见表4。
表4 2组mRS评分比较
Table 4 Distribution of mRS scores in two groups (n=50,例数)
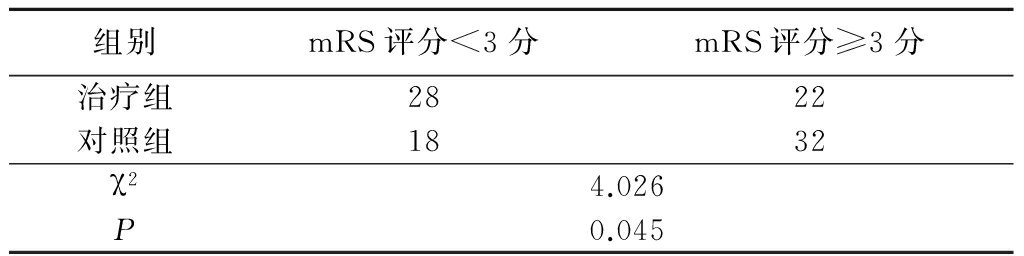
组别mRS评分<3分mRS评分≥3分治疗组2822对照组1832χ24.026P0.045
3 讨 论
急性脑梗死脑组织缺血后的数小时至数天之内是继发性损害的高峰期,缺血缺氧导致大量炎性细胞激活、炎症介质及氧化活性物质释放,血脑屏障及微循环破坏,导致缺血半暗带进展为脑梗死、加重脑水肿;与此同时,神经细胞信号通路也随着上述病理过程而激活或改变,加速神经细胞凋亡,进而引起严重的脑损害影响患者预后。如得不到有效的治疗,患者可出现进展性脑损害,表现为脑梗死体积进展及mRS评分分值增加[5]。本研究入选患者入院就诊时间均超过溶栓时间窗,但短于发病后24 h,处于脑梗死亚急性期。对丧失溶栓治疗机会的急性脑梗死患者在标准治疗基础上,脑梗死亚急性期给予持续局部脑亚低温干预24 h,治疗组中预后良好的人数明显多于对照组,提示亚低温治疗可以改善急性脑梗死患者预后,对患者结局具有积极影响。Su等[6-7]进行的临床随机对照试验研究中,同样发现全身亚低温干预能够改善大面积脑梗死的临床预后,不明显增加低温干预患者的并发症。一项关于术中亚低温治疗蛛网膜下腔出血的Meta分析显示亚低温治疗对轻型患者预后具有积极作用[8]。基础实验提示亚低温治疗能够缩小脑梗死模型动物的脑梗死体积[9]。本研究针对入院时梗死部位行前循环和后循环分类,并未发现分布差异;对新发梗死灶体积进行比较,亦未发现差异有统计学意义。但分析2组入院5 d脑梗死体积数值,治疗组均数低于对照组,虽差异无明显统计学意义,但可初步显示亚低温存在抑制脑梗死灶进展的治疗效应。住院5 d并未处于脑梗死水肿高峰极期,考虑随着病程进展,脑梗死体积仍会进展并达到峰值,考虑在住院7~10 d测量患者MRI结果,获得梗死体积差异的可能性较大,但在本研究中因部分患者住院时间略短,未能获得住院7~10 d的脑梗死结果。理论上脑梗死患者的梗死灶部位及体积可影响患者的预后,考虑在后期的研究中应对不同时间段梗死体积及梗死部位进行细化比较,以获得有意义的结果。推测随着样本量增加或以后的Meta分析中,可能会出现差异有统计学意义的证据。
目前,脑梗死治疗一直是研究的重点、热点及难点,期待新的有效方法出现以有效治疗脑梗死。低温治疗在新生儿缺氧缺血性脑病以及心脏骤停所致全脑缺血的临床研究中被证明有确切的神经保护作用[10-11]。因此,人们对低温治疗的神经保护作用寄予了很大的期望并投入了大量的研究工作。随着动物实验和临床研究的不断深入,研究者们逐渐认识到亚低温干预(33~35 ℃)有确切的神经保护作用,耐受性好,并发症少,更适合于临床应用。国内研究证实在重型脑损伤动物实验及临床研究中,亚低温取得了良好的疗效[12-13]。近年来,局部亚低温在缺血性脑卒中脑保护领域的研究成为热点,研究证实亚低温对缺血性脑卒中具有脑保护作用,其在脑梗死急性期、亚急性期及恢复期均具有神经保护作用[14]。脑梗死急性期,脑血流下降破坏离子稳定加速细胞钙内流,促使细胞加速释放兴奋性神经介质如谷氨酸,细胞内钙超载导致线粒体功能障碍,进而引起氧自由基及氮自由基生成增加。亚低温降低脑细胞代谢率,减少氧耗,增加葡萄糖利用率,减少乳酸生成,抑制酸中毒发生[15]。亚低温可改善缺血后脑组织内部环境,有利于维持离子稳定,减少细胞内钙超载,同时亚低温还可下调谷氨酸受体表达,减少兴奋性氨基酸诱导的NO合成,进而在脑梗死急性期具有神经保护作用[16]。亚急性期脑梗死引发炎症反应及细胞凋亡,再灌注损伤引起大量氧自由基释放,进而导致血脑屏障破坏、脑水肿。研究证实亚低温能够抑制自由基产生,阻止氧自由基介导的脑损害[17];同时亚低温可下调多种炎症因子如肿瘤坏死因子的表达,进而调节或抑制炎症反应[18]。有研究显示亚低温能通过多种途径抑制或减少脑细胞凋亡[19]。亚低温还能够通过调控基质金属酶保护血脑屏障,下调水通道蛋白4表达,抑制脑水肿形成[20]。脑梗死恢复期,亚低温有利于神经及血管再生,促进脑损害的恢复[21-22]。氧化应激指体内活性氧族(reactive oxygen species,ROS)的产生与抗氧化防御体系间的失衡,从而导致组织损伤的状态。ROS可以氧化细胞膜上的不饱和脂肪酸,反应的最终产物是MDA。与之相反,SOD是生物体内重要的抗氧化酶。通过对MDA及SOD测定可间接反映机体氧化与抗氧化能力的情况。本研究在脑梗死亚急性期应用局部亚低温治疗,与对照组比较,亚低温治疗组SOD水平升高,MDA水平下降,差异有统计学意义,提示亚急性期给予亚低温治疗能够调控脑梗患者的氧化应激反应,推测其为亚低温脑保护的机制。
总之,丧失溶栓机会的急性脑梗死患者,需进行积极有效的脑保护治疗。目前临床上多给予抗栓、药物脑保护、危险因素控制等综合治疗,但预后仍难满意。本研究在急性脑梗死的亚急性期应用局部亚低温治疗具有积极的治疗价值并取得了良好的效果,值得临床推广。
[参考文献]
[1] 刘静,吴雅坤.急性脑梗死rt-PA溶栓治疗进展[J].河北医科大学学报,2016,37(3):355-357.
[2] van der Worp HB,Sena ES,Donnan G A,et al. Hypothermia in animal models of acute ischaemic stroke:a systematic review and meta-analysis[J]. Brain,2007,130(Pt 12):3063-3074.
[3] 叶珊,林绍鹏,范永祥,等.血清总胆红素水平与急性缺血性卒中患者梗死灶体积、严重程度和病因学分型的相关性[J].国际脑血管病杂志,2016,24(6):497-503.
[4] 文婉玲,张永巍,杨志刚,等.数字减影血管造影评估急性脑梗死患者血管再通术预后的初步分析[J].中华神经科杂志,2015,48(5):373-376.
[5] de Meyer SF,Denorme F,Langhauser F,et al. Thromboinflammation in Stroke Brain Damage[J]. Stroke,2016,47(4):1165-1172.
[6] Su Y,Fan L,Zhang Y,et al. Improved Neurological Outcome With Mild Hypothermia in Surviving Patients With Massive Cerebral Hemispheric Infarction[J]. Stroke,2016,47(2):457-463.
[7] Gao XY,Zhu SZ,Xiang W,et al. Prolonged hypothermia exposure diminishes neuroprotection for severe ischemic-hypoxic primary neurons[J]. Cryobiology,2016,72(2):141-147.
[8] Li LR,You C,Chaudhary B. Intraoperative mild hypothermia for postoperative neurological deficits in people with intracranial aneurysm[J]. Cochrane Database Syst Rev,2016,3:D8445.
[9] Cechmanek BK,Tuor UI,Rushforth D,et al. Very Mild Hypothermia(35 degrees C) Postischemia Reduces Infarct Volume and Blood/Brain Barrier Breakdown Following tPA Treatment in the Mouse[J]. Ther Hypothermia Temp Manag,2015,5(4):203-208.
[10] Cheung KW,Green RS,Magee KD. Systematic review of randomized controlled trials of therapeutic hypothermia as a neuroprotectant in post cardiac arrest patients[J]. CJEM,2006,8(5):329-337.
[11] Shankaran S,Pappas A,McDonald SA,et al. Childhood outcomes after hypothermia for neonatal encephalopathy[J]. N Engl J Med,2012,366(22):2085-2092.
[12] 杨细平,涂悦,马铁柱,等.亚低温对重型创伤性脑损伤患者凝血功能的影响[J].中华创伤杂志,2014,30(6):491-494.
[13] 李迪彬,涂悦,程世翔,等.亚低温联合促红细胞生成素对颅脑创伤大鼠脑保护作用的研究[J].中华神经外科杂志,2015,31(4):381-385.
[14] Han Z,Liu X,Luo Y,et al. Therapeutic hypothermia for stroke:where to go?[J]. Exp Neurol,2015,272:67-77.
[15] Keller E,Steiner T,Fandino J,et al. Changes in cerebral blood flow and oxygen metabolism during moderate hypothermia in patients with severe middle cerebral artery infarction[J]. Neurosurg Focus,2000,8(5):e4.
[16] Seo M,Kim JH,Cho YE,et al. Hypothermic regulation of astrocyte proteome profile in experimental stroke[J]. Electrophoresis,2012,33(24):3835-3848.
[17] 胡晓,瞿浩,李世容,等.静脉溶栓联合亚低温治疗对急性脑梗死患者疗效及可能作用机制的研究[J].中国神经精神疾病杂志,2016,42(1):15-21,33.
[18] Gu LJ,Xiong XX,Ito T,et al. Moderate hypothermia inhibits brain inflammation and attenuates stroke-induced immunodepression in rats[J]. CNS Neurosci Ther,2014,20(1):67-75.
[19] Zgavc T,Ceulemans AG,Hachimi-Idrissi S,et al. The neuroprotective effect of post ischemic brief mild hypothermic treatment correlates with apoptosis,but not with gliosis in endothelin-1 treated rats[J]. BMC Neurosci,2012,13:105.
[20] Zhao JK,Guan FL,Duan SR,et al. Effect of focal mild hypothermia on expression of MMP-9,TIMP-1,Tau-1 and beta-APP in rats with cerebral ischemia/reperfusion injury[J]. Brain Inj,2013,27(10):1190-1198.
[21] 郑瑞娟,高玉红.亚低温对构建脑梗死模型大鼠梗死区神经再生微环境的影响[J].中国组织工程研究,2016,20(27):4013-4019.
[22] 解燕春,李承晏,杨靖.亚低温对大鼠局灶性脑缺血梗死体积及微血管新生的影响[J].武汉大学学报:医学版,2007,28(2):200-202.
(本文编辑:刘斯静)
Clinical effect and possible mechanism of lacol mild hypothermia on acute cerebral infarction
Song De-gang1, Chen Xiao-xue2*, Li Jing-long3, Wang Fang4
(1.DepartmentofNeurology,theFirstHospitalofQinhuangdao,HebeiProvince,Qinhuangdao066000,China; 2.DepartmentofUltrasound,theFirstHospitalofQinhuangdao,HebeiProvince,Qinhuangdao066000,China; 3.DepartmentofNuclearMagneticResonance,theFirstofHospitalQinhuangdao,HebeiProvince,Qinhuangdao066000,China; 4.DepartmentofClinicalLaboratory,theFirstHospitalofQinhuangdao,HebeiProvince,Qinhuangdao066000,China)
[Abstract]Objective To examine the effects of local mild hypothermia therapy on patients with acute cerebral infarction and to further investigate underlying mechanism for the treatment of cerebral infarction. Methods One hundred cases of cerebral infarction patients were randomly divided into two groups with 50 patients in each group. The control group was given standard medical treatment. The treatment group was given standard medical treatment plus mild hypothermia with a target temperature of 33 ℃ to 35 ℃. Hypothermia was maintained for 24 hours. MRI cerebral infarction volume was observed at the first day and the fifth days after admission. Modified Rankin scale(mRS) scores were measured at 3 months after infarction. The serum levels of superoxide dismutase(SOD) and malondialdehyde(MDA) were assessed before(on admission)and after mild hypothermia therapy(at 72 h after infarction). Results There was no difference in infarct volume between the two groups(P>0.05). The concentration of SOD was higher in treatment groups than in control group(P<0.05) at 72 h after infarction. The concentration of MDA was lower in treatment groups than in control group(P<0.05) at 72 h after infarction. Patients in the treatment group with good prognosis(mRS<3 scores) were higher than those in the control group, the difference was statistically significant(P<0.05). Conclusion Mild hypothermia treatment can improve the prognosis of patients with cerebral infarction, the beneficial effects may be accomplished by reducing oxidative stress reaction.
[Key words]brain infarction; hypothermia; prognosis
[收稿日期]2016-12-15;
[修回日期]2017-01-03
[基金项目]秦皇岛市科学技术研究与发展计划(201401A191)
[作者简介]宋德刚(1981-),男,河北唐山人,河北省秦皇岛市第一医院副主任医师,医学博士研究生,从事脑血管疾病诊治研究。
*通讯作者。E-mail37067011@qq.com
[中图分类号]R743
[文献标志码]A
[文章编号]1007-3205(2017)05-0510-05
doi:10.3969/j.issn.1007-3205.2017.05.004



