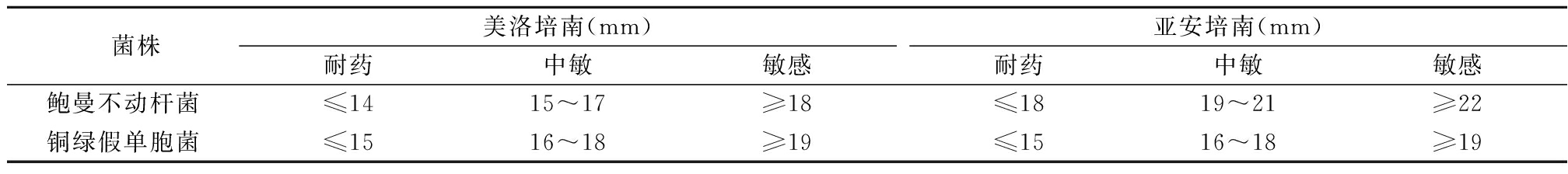
表1 美洛培南和亚安培南对鲍曼不动杆菌和铜绿假单胞菌的判断标准
·论 著·
邱万臣1,杨 靖2,时东彦2*,范士英2
(1.河北省清河县人民医院检验科,河北 邢台 054000;2.河北医科大学第二医院检验科,河北 石家庄 050000)
[摘要]目的应用Carba NP方法检测耐碳青霉烯类抗生素鲍曼不动杆菌和铜绿假单胞菌产生的碳青霉烯酶。方法收集30株耐碳青霉烯类抗生素鲍曼不动杆菌和10株耐碳青霉烯类抗生素铜绿假单胞菌,应用全自动细菌鉴定仪进行菌株鉴定和药物敏感试验,应用Carba NP方法检测碳青霉烯酶。结果30株鲍曼不动杆菌中,Carba NP试验结果阳性23株,阳性率为76.7%。10株铜绿假单胞菌中,Carba NP试验结果阳性8株,阳性率为80.0%。结论Carba NP方法操作简单,试剂成本低,易于在实验室开展,可快速检测耐碳青霉烯类抗生素细菌的产酶情况。
[关键词]鲍氏不动杆菌;铜绿假单胞菌;碳青霉烯酶
鲍曼不动杆菌和铜绿假单胞菌属于非发酵革兰阴性杆菌,是医院内重要的机会致病菌,尤其在免疫力低下的患者中,可以引起严重的甚至致死性的感染,如败血症、呼吸机相关肺炎、泌尿系统感染、脑膜炎等。近年来碳青霉烯类药物耐药的鲍曼不动杆菌和铜绿假单胞菌检出率呈上升趋势,尤其碳青霉烯类抗生素耐药鲍曼不动杆菌的检出率上升最为明显。碳青霉烯类抗生素一直是作为治疗革兰阴性杆菌的最后防线,但如此高的耐药率导致目前出现了无药可选的局面,故尽快寻找产生这种耐药的机制,成为当前研究的热点。本研究应用Carba NP方法检测耐碳青霉烯类抗生素的鲍曼不动杆菌和铜绿假单胞菌,旨在及早报告临床,从而为临床选择合适抗生素、减少医疗消耗、减少耐药株传播提供有效服务。
1.1 菌株来源 选择从河北省清河县人民医院和
河北医科大学第二医院临床标本分离所得的耐碳青霉烯类抗生素的鲍曼不动杆菌和铜绿假单胞菌共计40株,全部菌株均采用全自动细菌鉴定药物敏感鉴定仪进行验证。菌株采用无菌纸片-20 ℃低温保存。选取肺炎克雷伯菌ATCC BAA-1705碳青霉烯酶阳性对照质控菌株,肺炎克雷伯菌ATCC BAA-1706碳青霉烯酶阴性对照质控菌株,药物敏感质控菌株大肠埃希菌ATCC 25922。
1.2 药物敏感试剂 药物敏感试验平板(郑州安图生物工程股份有限公司),亚胺培南和美洛培南纸片(北京天坛试剂公司),亚安培南西司他丁(默沙东制药公司)
1.3 药物敏感试验方法 统一采用美洛培南和亚安培南纸片法检测耐碳青霉烯类抗生素耐药的菌株,依据美国临床与实验室标准化协会2015年判断标准[1],见表1。
表1 美洛培南和亚安培南对鲍曼不动杆菌和铜绿假单胞菌的判断标准

1.4 Carba NP检测液的配制[2]A液:准备25~50 mL容器,加入2 mL 0.5%酚红溶液于16.6 mL蒸馏水中,然后加入180 μL 10 mmol/L ZnSO4溶液。用0.1 N NaOH或者10%HCl调节pH值为7.8±0.1。4~8 ℃保存1个星期,避免长时间光照。B液:检测液A中加入12 g/L亚胺培南西司他丁钠。计算B液需要量,平均1株菌需要100 μL B液。共配制15 mL A液,加入180 mg亚胺培南西司他丁备用。加完后不用再调pH值。4~8 ℃保存3 d,一般现配现用。
1.5 Carba NP方法 分别设置A、B两管。每管中加入100 μL 5 mol/L NaCl。用10 μL接种环挑取满环经过过夜培养的菌落加入到A、B两管100 μL 5 mol/L NaCl溶液中,肺炎克雷伯菌ATCC BAA-1705碳青霉烯酶阳性对照质控菌株和肺炎克雷伯菌ATCC BAA-1706碳青霉烯酶阴性对照质控菌株也分别加入到A、B两管100μL 5 mol/L NaCl溶液中,盖上盖子,涡旋振荡混匀。在标记的A、B管中,分别对应加入100μL A、B检测液,盖上盖子,振荡混匀。放入35 ℃温箱中2 h后观察结果。
1.6 结果解释 依据美国临床与实验室标准化协会2016年标准[3]进行结果解释,见表2。
表2 Carba NP对于怀疑产碳青霉烯酶细菌试验结果的解释

2.1 药物敏感试验结果 统一采用美洛培南和亚安培南纸片法检测耐碳青霉烯类抗生素耐药的菌株,2种抗生素任意1种耐药即可判定为碳青霉烯类抗生素耐药的菌株,经过筛选共收集耐碳青霉烯类抗生素的鲍曼不动杆菌30株,耐碳青霉烯类抗生素的铜绿假单胞菌10株。
2.2 Carba NP检测结果分析 30株鲍曼不动杆菌中Carba NP试验结果阳性23株,阳性率为76.7%;10株铜绿假单胞菌中Carba NP试验结果阳性8株,阳性率为80%(图1)。
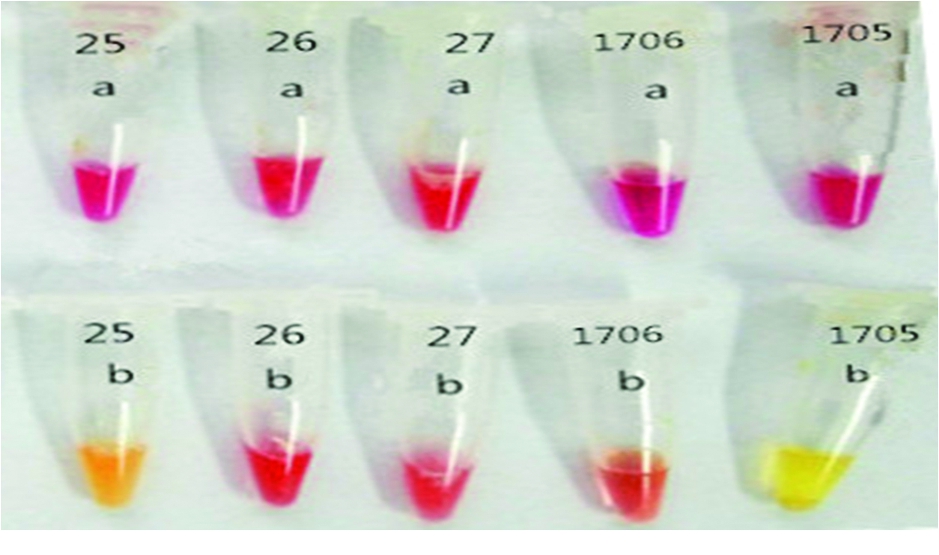
图1 Carba NP 试验结果
25,26,27:检测菌株;1705:阳性对照;1706:阴性对照
近年来,由于广谱抗生素的广泛和不合理应用,导致铜绿假单胞菌和鲍曼不动杆菌对多种抗生素出现了获得性耐药,并导致了多重耐药甚至泛耐药菌株。而碳青霉烯类药物具有抗菌谱广、抗菌活性强,同时能有效抑制几乎所有革兰阴性细菌生长的特性,成为临床上治疗多重耐药菌感染的常用抗菌药物。但随着其临床应用的日益广泛,耐碳青霉烯铜绿假单胞菌和鲍曼不动杆菌逐渐增多,还有天然耐碳青霉烯类的细菌逐渐增多,如嗜麦芽窄食单胞菌,给临床感染的预防与治疗带来了极大的困难。近几年有关耐碳青霉烯类抗生细菌的报道越来越受到重视,无论从国家耐药监测网到省级耐药监测网还是医院内部都有此类菌的报道,耐碳青霉烯类抗生素的鲍曼不动杆菌有逐年上升的趋势,而耐碳青霉烯类抗生素的铜绿假单胞菌耐药率变化不大。2012、2013年河北省细菌耐药性监测网报道铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为35.0%和39.2%,而鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别为70.9%和78.2%[4-5]。耐亚安培南的铜绿假单胞菌为33.0%,耐美洛培南的铜绿假单胞菌为33.4%[6-8]。2015年CHINET监测网报道耐亚安培南的铜绿假单胞菌为27.6%,耐美洛培南的铜绿假单胞菌为23.4%,耐亚安培南的鲍曼不动杆菌为62.0%,耐美洛培南的鲍曼不动杆菌为70.5%[9-10]。
细菌对碳青霉烯类抗生素产生耐药的主要耐药机制有:①碳青霉烯酶产生;②外膜蛋白改变导致外膜通透性的减少;③外排泵的高度表达;④青霉素结合蛋白靶位的改变,青霉素结合蛋白靶位改变主要见于革兰阳性球菌,在革兰阴性杆菌中较少见。碳青霉烯酶的产生一直被认为是最常见的,碳青霉烯酶是一类能够水解亚胺培南或者美罗培南等碳青霉烯类的一类β内酰胺酶[11]。包括Ambler分类中的A、B、D三类酶。有重要临床意义的是质粒介导的碳青霉烯酶基因型,主要包括亚胺培南铜绿假单胞菌酶(imipenemase, IMP)、亚胺培南酶(verona Imipenemase,VIM)、苯唑西林酶(oxacillinases,OXA)、产碳青霉烯酶的肺炎克雷伯菌(Klebsiella pneumonia carbapenemase,KPC)和新德里一号金属酶(New Delhi metalloid β-lactamase 1,NDM-1), D类碳青霉烯酶的水解作用是鲍曼不动杆菌耐碳青霉烯类的最主要原因,这类酶的基因位于质粒和染色体上,OXA-23、OXA-24和OXA-58在鲍曼不动杆菌中发现的较多[12],IMP和VIM在铜绿假单胞菌中常见[13]。
Carba NP方法[14]是2015年美国临床与实验室标准化协会推荐的碳青霉烯酶的生化检测法。主要原理是测试菌水解亚胺培南的β内酰胺环,通过pH指示剂的颜色变化(通常是用酚红指示剂,颜色由红色变为黄色或橘黄色)判断细菌的产酶情况。美国临床与实验室标准化协会推荐这种试验适用于肠杆菌和铜绿假单胞菌,而不动杆菌属产生了大量弱的D类碳青霉烯酶,传统的Carba NP很难检测出在不动杆菌属中高表达的OXA型的D类碳青霉烯酶。因此,建立一个改良的Carba NP(CarbAcineto NP)方法[15]用于检测不动杆菌的碳青霉烯酶。在Carba NP试验中,大量的蛋白抽提液会阻碍弱的碳青霉烯酶活性的释放。而在CarbAcineto NP中,用高渗的5 mol/L NaCl取代了蛋白抽提液,可以使细菌完全溶解,释放蛋白,并且挑取的菌量也增加了2倍,可以增加酶的释放量,故可以更好地检测鲍曼不动杆菌产酶情况。目前Carba NP试验用于检测肠杆菌科细菌的产酶情况研究较多,国外已经有了报道[16],但是国内报道较少,对于鲍曼不动杆菌和铜绿假单胞菌的产酶检测报道更少,因为收集菌株麻烦,且产酶量相对较低。因此,本研究选择了临床上耐药率较高的2种细菌,筛选耐药性较高的菌株进行研究,以期能使得此方法尽快得到认可和应用。30株耐碳青霉烯类的鲍曼不动杆菌中Carba NP试验结果阳性23株。大量基因研究表明鲍曼不动杆菌产OXA-23类基因的碳青霉烯酶是鲍曼不动杆菌耐碳青霉类抗生素的主要耐药机制[17],故产碳青霉烯酶也是鲍曼不动杆菌最主要的耐药机制,通过Carba NP方法检测虽然不知道具体产酶的类型,但是可以检测产酶的结果。Carba NP方法使用的试剂廉价,操作简单,用时短,结果易于解释,在普通实验室就可以开展,可以为临床及时应用及调整抗生素提供快速有效的依据。
目前已经公认的碳青霉烯酶表型检测方法为HODGE试验,这个方法对检测A类和D类碳青霉烯酶有很高的敏感度,包括检测具有弱碳青霉烯酶活性的OXA23、GES-5,但是对于产金属酶的敏感度较低。Girlich等[18]研究了对碳青霉烯类耐药的肠杆菌,检测产NDM的敏感度只有50%。这可能是由于细菌释放细菌素肽,干扰指示菌的生长,影响结果。由于金属酶MBL的活性依赖Zn2+,研究者们往MH药物敏感琼脂中添加硫酸锌(100 mg/L),使敏感度提高到了85.7%。经过长期实验证明,由于不同种类碳青霉烯酶对药物的水解作用有差异,另外如果菌株产CTX-M型ESBLs或高于亚胺培南和美罗培南AmpC酶并且伴有外膜蛋白表达减少或缺失可引起假阳性。由于此方法对于金属酶检测不到,对于过度表达的头孢菌素酶可以导致假阳性,故此类方法目前在临床中仅推荐用于肠杆菌科细菌的检测,不能用于检测鲍曼不动杆菌和铜绿假单胞菌,其他的表型检测方法复杂,敏感度不高,故未被广泛应用。PCR是碳青霉烯酶基因检测的“金标准”,可以精确鉴定碳青霉烯酶的种类。目前直接进行碳青霉烯酶基因检测的技术有普通PCR、实时荧光定量PCR、多重PCR、环介导等温扩增、基因芯片等。PCR 缺点是成本较高,需要较高的专业技能,只能检测已经确定的基因。PCR方法[19]可以精确鉴定碳青霉烯酶的种类,但是实验过程复杂,试剂消耗高,需要专门的仪器,并且只能鉴定已知的碳青霉烯酶基因,在普通实验室很难开展。由于目前碳青霉烯类抗生素耐药菌株分离率越来越高,故迫切需要一种简便快速的方法应用于临床,2015年美国临床与实验室标准化协会推荐了Carba NP方法。此方法虽然检测的菌株和酶的种类增加了,但是操作仍然复杂,需要试剂种类繁多,操作需要专业人员。因此,仍需开发更适用、更简便、更可靠的方法。
随着碳青霉烯类抗生素的广泛使用,细菌耐药性逐渐增加,耐碳青霉烯类抗生素的鲍曼不动杆菌和铜绿假单胞菌明显增加。这些耐药菌株造成医院感染的暴发流行,给临床治疗带来了严峻挑战,病死率高,无药可用。耐碳青霉烯铜绿假单胞菌已成为全球关注的重大问题,应加强对碳青霉烯类耐药的细菌动态监测,密切关注其耐药的发生与发展,探讨其耐药机制,寻找快速检测方法,从而有效延缓其耐药性的进展。
[参考文献]
[1] Wayne PA. Performance Standards for Antimicrobial Susceptibility Testing:Twenty-fifth Informational Supplement(M100-S25)[S]. CLSI:USA,2015.
[2] Diene SM,Rolain JM. Carbapenemase genes and genetic platforms in Gram-negative bacilli:Enterobacteriaceae, Pseudomonas and Acinetobacter species[J]. Clin Microbiol Infect,2014,20(9):831-838.
[3] Wayne PA. Performance Standards for Antimicrobial Susceptibility Testing:Twenty-sixth Informational Supplement(M100-S26)[S]. CLSI:USA,2016.
[4] 时东彦,赵建宏,李志荣,等.2013年河北省细菌耐药监测网三级甲等医院细菌耐药性监测[J].临床荟萃,2015,30(9):965-969.
[5] 时东彦,赵建宏,李继红,等.2012年河北地区临床分离细菌分布及耐药性监测[J].现代检验医学杂志,2014,29(5):49-53,57.
[6] 董爱英,时东彦,曹丽军,等.2013年河北省细菌耐药监测网三级甲等医院临床分离铜绿假单胞菌耐药性监测[J].临床荟萃,2015,30(9):974-977.
[7] 魏宏莲,王崇,苏军华,等.临床分离铜绿假单胞菌耐药性分析与监控管理[J].河北医科大学学报,2015,36(1):45-47.
[8] 魏宏莲,杨靖,袁茵,等.临床分离铜绿假单胞菌分布及耐药性监测[J].河北医科大学学报,2016,31(2):218-220.
[9] 张辉,张小江,徐英春,等.2005-2014年CHINET不动杆菌属细菌耐药性监测[J].中国感染与化疗杂志,2016,16(4):429-436.
[10] 胡付品,朱德妹,汪复,等. 2015年CHINET细菌耐药性监测[J].中国感染与化疗杂志,2016,16(6):685-694.
[11] 潘文森,张丽丽,于婧,等.多重耐药鲍曼不动杆菌感染重症肺炎患者预后相关因素分析[J].河北医科大学学报,2016,37(8):869-873.
[12] van der Zwaluw K,de Haan A,Pluister GN,et al. The carbapenem inactivation method(CIM),a simple and low-cost alternative for the Carba NP test to assess phenotypic carbapenemase activity in Gram-negative rods[J]. PLoS One,2015,10(3):e0123690.
[13] 张伟红,叶慧芬,杨银梅,等.耐亚胺培南鲍曼不动杆菌耐药表型和碳青霉烯酶基因型分析[J].中国感染与化疗杂志,2011,11(1):45-48.
[14] Dortet L,Poirel L,Nordmann P. Rapid identification of carbapenemase types in Enterobacteriaceae and Pseudomonas spp. by using a biochemical test[J]. Antimicrob Agents Chemother,2012,56(12):6437-6440.
[15] Dortet L,Poirel L,Errera C,et al. CarbAcineto NP test for rapid detection of carbapenemase-producing Acinetobacter spp[J]. J Clin Microbiol,2014,52(7):2359-2364.
[16] Tijet N,Patel SN,Melano RG. Detection of carbapenemase activity in Enterobacteriaceae:comparison of the carbapenem inactivation method versus the Carba NP test[J]. J Antimicrob Chemother,2015,70(1):274-276.
[17] Nordmann P,Gniadkowski M,Giske CG,et al. Identification and screening of carbapenemase-producing Enterobacteriaceae[J]. Clin Microbiol Infect,2012,18(5):432-438.
[18] Girlich D,Poirel L,Nordmann P. Value of the modified Hodge test for detection of emerging carbapenemases in Enterobacteriaceae[J]. J Clin Microbiol,2012,50(2):477-479.
[19] Rumbo C,Gato E,López M,et al. Contribution of efflux pumps,porins,and β-lactamases to multidrug resistance in clinical isolates of Acinetobacter baumannii[J]. Antimicrob Agents Chemother,2013,57(11):5247-5257.
(本文编辑:赵丽洁)
[收稿日期]2016-12-27;
[修回日期]2017-02-19
[作者简介]邱万臣(1981-),男,河北清河人,河北省清河县人民医院主管技师,医学学士,从事临床检验学研究。
*通讯作者。E-mail:shidongyan73@126.com
[中图分类号]R446.1
[文献标志码]B
[文章编号]1007-3205(2017)07-0847-04
doi:10.3969/j.issn.1007-3205.2017.07.027