Table1ComparisonofTNF-alphaandIL-6levelsinbraintissueofratsineachgroup
·论著·
郭 勇1,杨 茜2*,张 杰3,郭 唯4,李 婧2
(1.河北省石家庄市第一医院医务处,河北 石家庄 050011;2. 河北省石家庄市第一医院神经内科,河北 石家庄 050011;3.河北省石家庄市第一医院检验科,河北 石家庄 050011;4.河北省深州市医院检验科,河北 深州 053800)
[摘要]目的探讨白藜芦醇对大鼠脑缺血损伤中肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)和白细胞介素6(inter leukin 6,IL-6)水平的影响。方法36只大鼠制作成脑组织缺血模型,分为A组、B组、C组,每组12只,A组为对照组未治疗,B组和C组给予白藜芦醇25 mg/kg和白藜芦醇50 mg/kg,应用双抗体夹心酶联免疫吸附测定法检测脑组织匀浆中TNF-α和IL-6水平,检测白藜芦醇对细胞增殖的抑制作用。结果B组和C组大鼠脑组织中TNF-α和IL-6水平明显低于A组,C组大鼠脑组织中TNF-α和IL-6水平又低于B组,差异均有统计学意义(P<0.05)。结论白藜芦醇通过抑制脑部TNF-α、IL-6表达水平,减轻脑部炎症程度,改善脑缺血,值得临床应用。
[关键词]脑缺血;白藜芦醇;细胞因子类;大鼠
缺血性脑损伤过程中存在氧化应激引起的脑微血管内皮细胞的损伤[1]。脑缺血时,细胞兴奋毒性增强和能量衰竭,可触发脑实质内的炎症反应,肿瘤坏死因子α(tumornecrosisfactoralpha,TNF-α)和白细胞介素6(interleukin6,IL-6)等细胞因子参与机体的炎症反应,在脑缺血损伤状态下TNF-α和IL-6的表达增加,加重了组织细胞损伤。为了重建或恢复细胞功能,应在脑缺血后尽快启动干预措施[2]。而白藜芦醇具有抗氧化、抗炎等重要作用,研究表明白藜芦醇对正常细胞无毒性[3],在脑缺血时可通过多种机制发挥神经保护作用。本研究以大鼠为研究对象,探讨白藜芦醇在脑缺血损伤中对TNF-α和IL-6的影响。
1.1 实验动物及试剂 成年雄性SD大鼠48只,体貭量250~300g,由河北省实验动物中心提供,标准饲料喂养。白藜芦醇购自美国Sigma公司,TNF-α和IL-6 一抗、二抗及相关试剂盒均购自信帆生物工程有限公司。
1.2 模型制备 参照文献,采用线栓法阻断大鼠颈外动脉(externalcarotidartery,ECA)及其分支,阻断翼腭动脉(pterygopalatineartery,PPA),以切断颅外来源的侧支循环血流。从ECA插入尼龙线,经颈内动脉(internalcarotidartery,ICA)到大脑前动脉(anteriorcerebralartery,ACA),机械性阻断大脑中动脉(middlecerebralartery,MCA)发出处的血供,制作大鼠右侧大脑半球脑缺血模型。48只大鼠用10%水合氯醛(35mg/kg)腹腔注射麻醉。仰卧位固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈颈总动脉(commoncarotidartery,CCA)、ECA和ICA,在CCA远心端和近心端及ECA处挂线备用。用微动脉夹暂时夹闭ICA,然后近心端结扎CCA、ECA。在距CCA分叉部4mm处剪一小口,将拴线插入到ICA,这时用绕在CCA远心端的细线轻轻系牢拴线。用眼科镊轻推拴线,从血管分叉处开始算距离,当插入深度在18mm时,紧紧系牢CCA远心端的细线(血管外的栓线不要留得过长,更不要缝在皮外,否则大鼠醒来后会自己拔出)。缝合伤口,单笼饲养观察。以出现左上肢屈曲,行走时向左侧偏斜或左侧肢体瘫痪为成模标准,共筛选出符合条件的大鼠36只。排除标准:①无明显神经功能缺损表现或症状很轻的大鼠;②蛛网膜下腔出血的大鼠;③手术时出血较多,症状很重甚至死亡的大鼠。
1.3 实验动物分组及给药方法 按随机化原则分为A、B、C组,A组(未治疗)、B组(白藜芦醇25mg/kg)、C组(白藜芦醇50mg/kg),每组12只。各组处理方法:B、C组在造模后分别给予白藜芦醇25mg/kg、50mg/kg置于0.85%的NaCl溶液,A组大鼠给予同体积0.85%的NaCl溶液,各组大鼠均按10mL/kg给药,连用5d。观察3组大鼠精神状态、肢体偏瘫情况,实验完毕在麻醉状态下处死大鼠,取脑组织50~80mg置于匀浆器中。
1.4IL-6和TNF-α检测 将所取的脊髓组织制成匀浆,低温(4 ℃)条件以下4 000r/min离心10min,取上清液,分装,置于-86 ℃冰箱保存至检测;TNF-α和IL-6测定采用双抗体夹心酶联免疫吸附测定法,操作严格按照说明书。
1.5 统计学方法 应用SPSS13.0统计软件包处理数据,计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
B组和C组大鼠脑组织中TNF-α和IL-6水平均明显低于A组,差异有统计学意义(P<0.05);C组大鼠脑组织中TNF-α和IL-6水平又均低于B组,差异有统计学意义(P<0.05)。见表1。
表1各组大鼠脑组织中TNF-α和IL-6水平比较
Table1ComparisonofTNF-alphaandIL-6levelsinbraintissueofratsineachgroup![]()
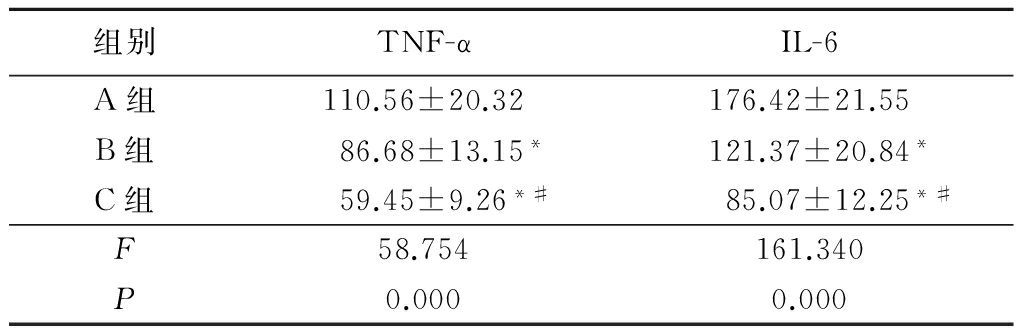
*P<0.05与A组比较 #P<0.05与B组比较(SNK-q检验)
脑卒中是指急性起病,由于脑局部血液循环障碍所导致的神经功能缺损综合征,按照脑的病理改变可分为缺血性卒中和出血性卒中。缺血性脑损伤是危害人类健康和生命安全的常见的难治性疾病,因为其高发病率、高致残率及高致死率,给患者及其家庭带来极大的负担,严重降低了存活患者的生活质量。因此,积极治疗和预防脑血管病,对降低缺血性脑损伤的发病率和病死率有重要意义,缺血性脑损伤的治疗与预防水平急需提高。目前对缺血性脑损伤的早期治疗主要是通过2个途径实现的,即溶栓治疗和脑保护治疗,但溶栓治疗有严格的时间窗及适应证,故仍有很大一部分患者需要采用包括神经保护剂在内的其他方法进行治疗。
TNF-α在中枢神经系统中,由神经元、星形细胞和胶质细胞产生,它在神经-内分泌-免疫调节系统中发挥很重要的作用。神经功能缺损与TNF-α有关,脑组织的病变越严重,相应的炎症反应也就越严重,同时TNF-α也随之升高,提示TNF-α与疾病的严重程度可能有关。IL-6主要由血管内皮细胞、单核巨噬细胞等产生,在中枢神经系统的脑缺血损伤时其迅速表达,缺血缺氧后24 h可迅速升高。脑缺血缺氧损伤的病理机制是炎症反应和血脑屏障通透性增高,脑缺血损伤后小胶质细胞被激活并分泌大量促炎因子,其中TNF-α和IL-6等细胞因子作为重要的炎症介质参与机体的炎症反应,在病理状态下TNF-α和IL-6的表达增加加重了组织细胞损伤,二者表达水平的高低与疾病的严重程度以及预后密切相关,同时与多种肿瘤的发生、发展及转移密切相关[4-5],可以作为药物治疗的靶点。
白藜芦醇是存在于葡萄科、蓼科等植物中的抗毒素,首次从毛叶藜芦的根部提取得到,其中以虎杖、葡萄、花生中含量最高[6],具有广泛的生物学活性,如具有抗炎、抑制血小板聚集、免疫调节以及抗氧化、抗凋亡等作用,已被证实在多种组织或器官的缺血损伤过程中发挥对抗作用[7],同时具有保护心脑血管、抗肿瘤、抗感染等多种药理作用[8-10]。此外,白藜芦醇还具有抗肝纤维化、治疗休克、抗衰老、减肥、美容等多种功效,白藜芦醇目前已经被美国、日本、加拿大等国列为保健品。研究表明,白藜芦醇可显著性降低缺血脑组织中TNF-α和IL-6水平,缩小梗死体积[11]。
脑缺血时可触发脑实质内的炎症反应并进一步加重组织损伤。脑缺血后数小时,血管内皮细胞即表达多种黏附分子,并介导与白细胞的相互作用,白细胞与内皮细胞黏附并从血液中迁移至脑实质[12]。脑缺血后的细胞分泌大量促炎因子,这些促炎因子的蓄积会导致细胞损伤[13]。脑缺血后数分钟,部分转录因子表达一过性上调;脑缺血后1~2 h,热休克蛋白表达增加;脑缺血后12~24 h,趋化因子和细胞因子,如IL-1、IL-6、IL-8、TNF-α等表达上调[12]。研究显示白藜芦醇可抑制脑缺血后的炎症反应。白藜芦醇在治疗心脑血管疾病方面具有明显的抗心率失常、抗血栓形成、抗缺血-再灌注损伤后的内皮细胞损伤、抗动脉粥样硬化治疗作用,还有对抗阿尔茨海默病、亨廷顿病等老年病的治疗作用,故在患者发生上述疾病时,白藜芦醇可以作为安全的首选药[14-16]。本研究主要探讨白藜芦醇对脑缺血性损伤的干预和减轻作用。
神经细胞在完全缺血、缺氧后十几秒即出现电位变化,20~30 s后大脑皮质的生物电活动消失,脑动脉血流中断持续5 min,神经细胞就会发生不可逆性损害,出现脑梗死,严重缺血的脑组织能量很快耗竭,能量依赖性神经细胞膜的泵功能衰竭,脑缺血引起膜去极化和突触前兴奋性递质的大量释放,细胞外液中的Ca2+通过电压门控通道和N-甲基-D-天冬氨酸受体门控通道进入细胞内,细胞内还由于三磷酸腺苷供应不足和乳酸中毒,使细胞内的结合Ca2+大量释放,细胞内Ca2+稳态失调在神经细胞缺血损害中起重要作用,受Ca2+调节的多种酶类被激活,导致膜磷脂分解和细胞骨架破坏,大量自由基生成,细胞产生不可逆性损伤,在这个过程中还包括转录因子的合成及炎性介质的产生等参与,白藜芦醇对脑缺血后的神经保护作用与其本身的抗炎功效及调节多种神经递质的作用有关[17]。本研究在造模后5 d,根据生物化学指标及未治疗组大鼠病程发展过程中生命体征的变化,进一步验证了模型的真实性与可靠性,白藜芦醇治疗组TNF-α和IL-6表达水平明显下降,随着白藜芦醇浓度加大,TNF-α和IL-6的表达水平下降,白藜芦醇50 mg/kg组大鼠脑组织中TNF-α和IL-6水平低于白藜芦醇25 mg/kg组,而未治疗组大鼠脑组织中TNF-α和IL-6水平远远高于治疗组。表明白藜芦醇能通过抑制TNF-α和IL-6的表达水平,减轻脑缺血后的炎症反应,且这种作用具有一定的浓度依赖性。
脑缺血后,多条信号级联反应被激活,一部分对缺血脑组织发挥保护作用,而另一部分则产生有害作用,这些信号级联反应互相重叠且相互影响。脑缺血后数分钟即可引发炎症反应和氧化应激。白藜芦醇可靶向缺血性脑损伤的多条信号通路和环节,从而发挥神经保护作用[18]。本研究通过建立大鼠脑缺血模型,证实白藜芦醇具有减轻脑缺血组织神经功能损伤的积极作用。对于脑组织缺血性损伤的研究,人们一直不断探索其发病原因及发病机制,现有的发病机制和药物治疗只针对脑组织缺血性损伤的某一阶段发挥特定的作用,无法在缺血性损伤的每个阶段发挥作用,故探讨一种阻断脑组织缺血性损伤发展的多靶点药物有更重要的临床意义。在脑缺血损伤的早期,脑组织改变不明显,肉眼可见的变化要在数小时后才能辨认。缺血中心区发生肿胀、软化,灰白质分界不清,大面积脑梗死时,脑组织高度肿胀,可向对侧移位,导致脑疝形成。镜下可见神经元出现急性缺血性改变,如皱缩、深染及炎细胞浸润等,胶质细胞破坏,神经轴突和隧桥崩解,小血管坏死,周围有红细胞渗出及组织间液的积聚。在发病的4~5 d脑水肿达高峰;7~14 d脑梗死区液化成蜂窝状囊腔;3~4周后小的梗死灶可被肉芽组织区取代,形成胶质瘢痕,大的梗死灶中央液化成囊腔,周围由增生的胶质纤维包裹,变成中风囊。而白藜芦醇是一种非常有希望的神经保护药,可用于缺血性卒中的预防和治疗,加上白藜芦醇本身来源于各种植物及食物,有必要将其作为神经保护药在临床试验中加以验证。
综上所述,白藜芦醇通过抑制脑部TNF-α、IL-6表达水平,可减轻脑部炎症程度、改善脑缺血,值得临床推广应用。
[参考文献]
[1] 张成岗,李伟光,孙长青,等.氧化应激调控网络在缺血缺氧性脑损伤干预治疗中的作用[J].中国药理通讯,2012,29(3):19-20.
[2] 牛丽辉.白藜芦醇在脑缺血中的神经保护机制[J].国际脑血管病杂志,2014,22(3):214-217.
[3] 高倩.白藜芦醇抗肿瘤作用机制研究进展[J].中华实用诊断与治疗杂志,2016,30(9):845-847.
[4] 邹福兰,骆娟,黄蓉,等.IκBα在NF-κB信号通路中的作用及临床意义[J/CD].中华临床医师杂志:电子版,2014,3(8):513-516.
[5] 陈宁宁,王建平,刘恒方,等.白藜芦醇对脑梗死大鼠缺血半暗带内COX-2、IL-6表达及脑损伤程度的影响[J].中国农村卫生,2013,(z2):105-107.
[6] 李扬,苏军华,杨丽娟,等.白藜芦醇对人食管癌EC9706细胞生物学行为的影响及其作用机制[J].河北医科大学学报,2017,38(1),11-15,19.
[7] 沈佳佳,黄瑛,祁炜罡,等.白藜芦醇通过促进自噬减轻糖尿病大鼠心肌缺血再灌注损伤的实验研究[J].中国临床医学,2015,22(2):151-155.
[8] 王风光.白藜芦醇衍生物及类似物的药理活性与分析方法研究[J].当代医药论丛,2014,12(2):280-281.
[9] 曹烨,关新强,徐志懿.白藜芦醇对心血管保护作用的研究进展[J].医学综述,2013,19(23):4235-4237.
[10] 郭倩,余音,潘乾广,等.白藜芦醇保护脑缺血/再灌注损伤与自噬关系的研究[J].中国药理学通报,2013,29(7):995-998.
[11] 王保华.白藜芦醇对大鼠脊髓缺血再灌注损伤组织中TNF-α和IL-6水平的影响[J].中国实用神经疾病杂志,2016,19(12):100-101.
[12] 张洲,徐元宏,李涛,等.细胞因子IL-1β、IL-6、IL-8、TNF-a在细菌性血流感染中的诊断价值[J].安徽医科大学学报,2012,47(9):1079-1081.
[13] 张婧,邹玉安,董晓华.缺血预处理对脑缺血再灌注损伤保护作用的研究进展[J].神经药理学报,2015,5(5):57-65.
[14] 王晓飞,曹永兵,姜远英.白藜芦醇药理学研究进展[J].大家健康:下旬版,2013,7(8):204-205.
[15] 韩雪莲.白藜芦醇及其类似物和衍生物的药理学研究进展[J].化学与生物工程,2014,31(4):15-19.
[16] 安梅,周瑾,陈晓宇.白藜芦醇药理学作用的研究进展[J].肿瘤药学,2014,4(4):242-246.
[17] 徐海燕.动脉血栓性脑梗死的临床诊断[J].中外健康文摘,2012,9(38):240-241.
[18] 林正,曾博,尹康.Nrf2-ARE信号通路在外伤性脑损伤神经保护作用的机制研究[J],中国现代医生,2013,51(11):11-13.
(本文编辑:许卓文)
Effect of the resveratrol on TNF-α and IL-6 levels in rats with ischemic injury
GUO Yong1, YANG Qian2*, ZHANG Jie3, GUO Wei4, LI Jing2
(1.DepartmentofMedical,theFirstHospitalofShijiazhuang,HebeiProvinceShijiazhuang050011,China; 2.DepartmentofNeurology,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China; 3.DepartmentofClinicalLaboratory,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China; 4.DepartmentofClinicalLaboratory,theShenzhouHospital,HebeiProvince,Shenzhou053800,China)
[Abstract]ObjectiveToexploretheeffectoftheResveratrolontumornecrosisfactoralpha(TNF-α)andinterleukin6(IL-6)levelsinratswithischemicinjury.MethodsThirty-sixratsweredividedintogroupA,groupBandgroupC,with12ratsineachgroup.ThegroupAwasthecontrolgroupwithouttreatment,andthegroupBandthegroupCweregivenresveratrol25mg/kgandresveratrol50mg/kg.Thedouble-antibodysandwichenzymelinkedimmunosorbentassaymethodwasusedtodetermineTNF-αandIL-6levelsinthebraintissuehomogenate,andtodetectthecellproliferationinhibitionofresveratrol.ResultsTheTNF-αandIL-6levelsingroupBandgroupCweresignificantlylowerthanthoseingroupA,theTNF-αandIL-6levelsingroupCwerelowerthanthoseingroupB,thedifferencesweresignificant(P<0.05).ConclusionResveratrolinhibitsbraininflammationandimprovescerebralischemiabyinhibitingthelevelsofTNF-αandIL-6inthebrain,whichisworthyofclinicalapplication.
[Key words]brainischemia;resveratrol;cytokines;rats
[收稿日期]2017-03-30;
[修回日期]2017-04-25
[基金项目]河北省医学科学研究重点课题(20170978)
[作者简介]郭勇(1976-),男,河北石家庄人,河北省石家庄市第一医院副主任医师,从事临床外科及医务管理工作。
*通讯作者。E-mail:549147601@qq.com
[中图分类号]R743.31 [
文献标志码:] A [
文章编号:] 1007-3205(2017)09-0997-04
doi:10.3969/j.issn.1007-3205.2017.09.002