表1CD68、Ki-67在正常肺组织和NSCLC组织中的表达
Table1ExpressionofCD68andKi-67innormallungtissuesandNSCLCtissues(例数,%)
·论著·
魏宇森1,杨龙飞1,张小陆1,张洪珍1,2*
(1.河北医科大学研究生学院,河北 石家庄 050017;2.河北省人民医院肿瘤五科,河北 石家庄 050051)
[摘要]目的探讨肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)、肿瘤增殖因子(Ki-67)在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达及其与临床病理特征的关系,并研究其与预后的关系。方法采用免疫组织化学SP法检测68例NSCLC组织和17例癌旁正常肺组织中CD68(TAMs表面标志) 、Ki-67的表达情况。根据随访结果,应用Kaplan-Meier 生存分析和Cox回归法分析CD68、Ki-67与肺癌预后的关系。结果CD68、Ki-67在68例肺癌组织中的阳性率分别为66.2%(45/68)、61.8%(42/68),在正常肺组织中的阳性表达率分别为17.6%(3/17)、5.9%(1/17),差异均有统计学意义(P<0.05)。CD68、Ki-67在高TNM 分期、淋巴结转移、侵及胸膜的NSCLC 组织中的表达明显著增高(P<0.05)。低分化者Ki-67的表达明显增高(P<0.05)。NSCLC中CD68与Ki-67的表达呈正相关(r=0.461,P=0.000)。68例NSCLC患者1、3、5年生存率分别为86.76%、64.71%、16.18%。Cox多因素分析显示,分化程度低和淋巴结转移是预后不良的危险因素(P<0.05)。结论CD68、Ki-67阳性肺癌患者预后差。CD68、Ki-67在NSCLC的发展、浸润、转移中起一定作用,联合检测可作为临床诊断、辅助治疗的潜在靶点。
[关键词]癌,非小细胞肺;肿瘤相关巨噬细胞;细胞增殖因子
肿瘤的复发、转移已成为影响肺癌患者生存期的重要原因。肿瘤相关巨噬细胞(tumorassociatedmacrophages,TAMs)是浸润在肿瘤组织中的巨噬细胞,是肿瘤微环境中最多的免疫细胞,可以分泌多种细胞因子,在肿瘤发生初期能够识别并清除肿瘤细胞,但随着肿瘤的发生发展,又对肿瘤的生长、侵袭、转移起着关键作用。在肿瘤的发生发展中TAMs发挥着“双刃剑”的作用。CD68是常见的巨噬细胞标志物[1]。Ki-67是反映细胞增殖活性的指标,与肿瘤的发展、转移及预后存在密切的关系[2]。本研究采用免疫组织化学SP法检测非小细胞肺癌(non-smallcelllungcancer,NSCLC)组织中CD68、Ki-67的表达,分析其表达与临床病理特征的关系,进而探讨二者对NSCLC发生、发展、预后的影响。
1.1 一般资料 选取2009年12月—2013年12月经河北省人民医院胸外科手术切除、有明确组织学病理诊断的68例NSCLC患者组织蜡块。另收集17例癌旁正常肺组织行对照研究。17例正常肺组织中男性12例,女性5例,年龄45~73岁,中位年龄61岁。68例NSCLC患者中男性50例,女性18例,年龄48~79岁,中位年龄65岁;病理类型:腺癌32例,鳞癌26例,其他类型癌10例;分化程度:高分化17例,中分化30例,低分化21例;有淋巴结转移者43例,无淋巴结转移者25例;TNM病理分期:Ⅰ期9例,Ⅱ期20例,Ⅲ期39例。
研究中涉及的蜡块标本和临床资料均已征得患者家属同意,并报医院伦理委员会审查通过。
1.2 主要试剂 兔抗人Ki-67单克隆抗体购自美国Bioworld公司,鼠抗人CD68单克隆抗体、SP检测试剂盒、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学SP法 切片常规脱蜡至水,抗原修复,置入3%H2O2室温孵育15min,滴加一抗,置于试剂盒中4℃过夜;PBS冲洗,滴加辣根过氧化物酶标记的二抗,室温孵育30min;PBS冲洗后DAB显色,洗涤,苏木精复染,脱水,透明,中性树脂胶封片,镜下观察。阳性对照:Ki-67选择人乳腺癌阳性片,CD68选择人肝癌阳性片;阴性对照:用PBS代替一抗。
1.4 结果判定 染色后所有切片由病理科医生和研究者按双盲法进行读片并判断结果:CD68 标记的TAMs以细胞浆呈现棕黄色为阳性表达,判定标准[3]:在高倍镜下观察5个视野计数CD68阳性的巨噬细胞数目得平均值为最后结果。根据阳性表达数目分为2组,TAMs≤60个/HP为低表达组,TAM>60个/HP为高表达组。Ki-67以细胞核呈棕黄色颗粒为阳性表达,判断标准[4]:阳性指数>20%直接判定为阳性,阳性指数<15%为低表达,阳性指数≥15%为高表达。
1.5 生存指标 出院后每3个月随访1次。无进展生存期(progression-freesurvival,PFS)定义为手术治疗后至疾病进展或未进展死亡的时间。总生存期(overallsurvival,OS)定义为手术治疗后至死亡或末次随访时间。
1.6 统计学方法 应用SPSS21.0软件对数据进行统计学分析。计数资料比较采用χ2检验;相关性采用Spearman等级相关分析;生存期比较采用Kaplan-Meier法;危险因素确定采用Cox回归分析。P<0.05为差异有统计学意义。
2.1CD68、Ki-67在正常肺组织和NSCLC组织中的表达CD68在正常肺组织和NSCLC组织中阳性表达率分别为17.6%和66.2%,其差异有统计学意义。Ki-67在正常肺组织和NSCLC组织中阳性表达率分别为5.9%和61.8%,其差异有统计学意义(P<0.05)。 见表1和图1,2。
2.2 不同临床和病例特征NSCLC组织中CD68、Ki-67表达 不同性别、年龄、组织学类型及分化程度患者CD68阳性表达率差异无统计学意义(P>0.05);TNM分期Ⅲ期、有淋巴结转移、侵及胸膜患者CD68阳性表达率高于TNM分期Ⅰ+Ⅱ期、无淋巴结转移和无侵及胸膜患者,差异有统计学意义(P<0.05)。不同性别、年龄及组织学类型患者Ki-67阳性表达率差异无统计学意义(P>0.05);低分化程度、TNM分期Ⅲ期、有淋巴结转移和侵及胸膜患者Ki-67阳性表达率高于高分化和中分化程度、TNM分期Ⅰ+Ⅱ期、无淋巴结转移和无侵及胸膜患者,差异有统计学意义(P<0.05)。见表2。
表1CD68、Ki-67在正常肺组织和NSCLC组织中的表达
Table1ExpressionofCD68andKi-67innormallungtissuesandNSCLCtissues(例数,%)

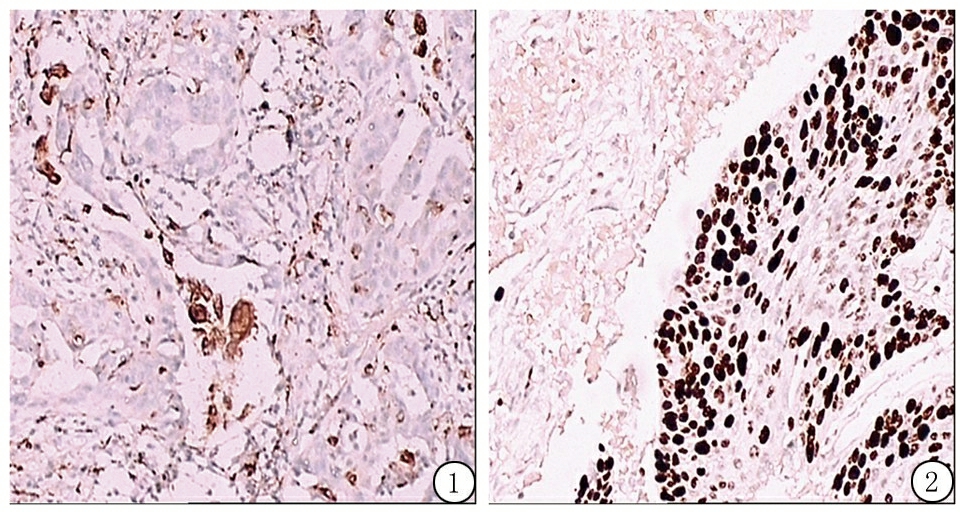
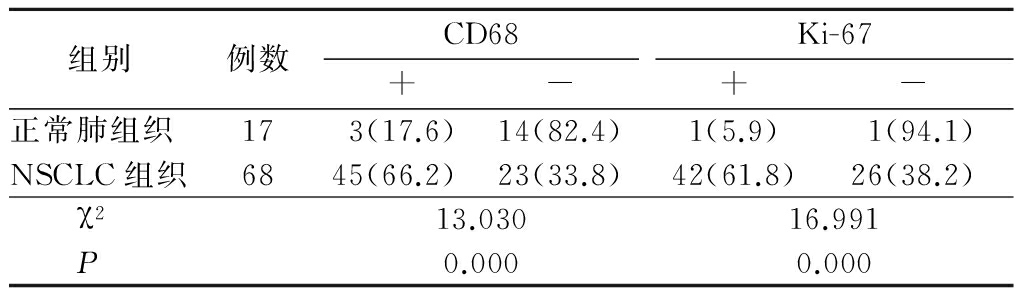
图1 CD68在NSCLC组织中的阳性表达(SP ×100)
Figure1ThepositiveexpressionofCD68inNSCLCtissues(SP×100)
图2Ki-67在NSCLC组织中的阳性表达(SP×100)
Figure2ThepositiveexpressionofKi-67inNSCLCtissues(SP×100)
表2 NSCLC组织中CD68、Ki-67表达与临床和病理特征之间的关系
Table2RelationshipofexpressionofKi-67andCD68withclinicalpathologicalfeaturesinNSCLCtissues(例数,%)
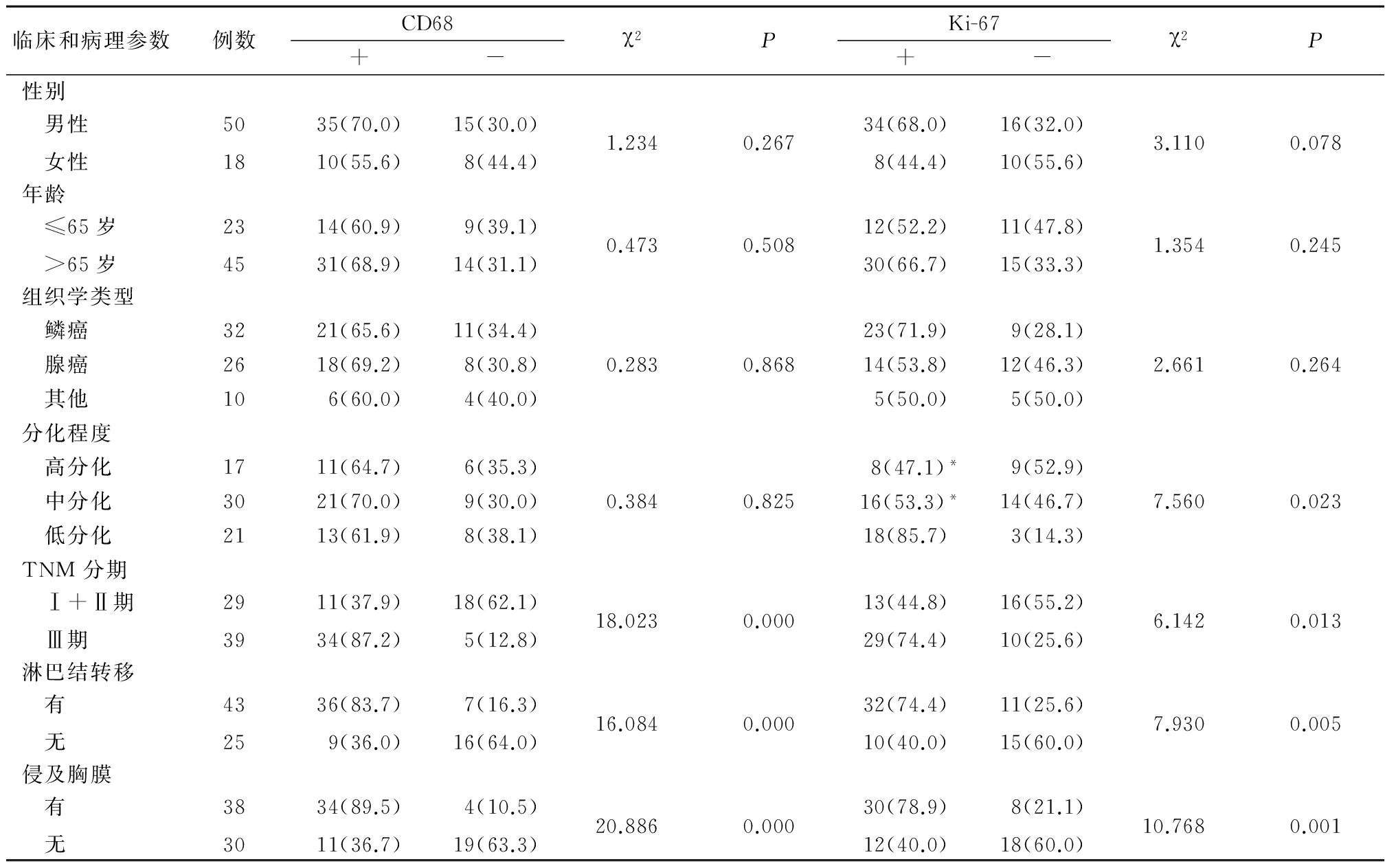
*P<0.05与低分化比较(χ2检验)
2.3 NSCLC组织中CD68、Ki-67表达的相关性 Spearman相关分析显示,68例NSCLC组织中CD68与Ki-67的阳性表达呈正相关(P=0.000),见表3。
2.4 NSCLC组织中CD68、Ki-67表达对生存期的影响 68例NSCLC中位生存时间为37.5个月,1、3、5年生存率分别为86.76%、64.71%、16.18%,见图3,4。
表3 NSCLC组织中Ki-67和CD68表达的相关性
Table3CorrelationbetweenexpressionofKi-67andCD68inNSCLCtissues(例数)
2.5 Cox回归分析 分别以OS和PFS为因变量,以分化程度、TNM分期和淋巴结转移为自变量,进行Cox回归分析,结果显示低分化程度和有淋巴结转移是OS和PFS生存预后不良的独立危险因素(P<0.05),见表4,5。
表4 OS多因素生存分析
Table4MultivariateanalysisofOS

表5 PFS多因素生存分析
Table5MultivariateanalysisofPFS

2.6 CD68、Ki-67表达与NSCLC患者生存率的关系 所有患者均随访至2016年12月31日,死亡57例,存活11例。Kaplan-Meier法生存分析显示,68例NSCLC中CD68表达阳性患者OS和PFS明显低于CD68表达阴性患者(P<0.05),Ki-67表达阳性患者OS和PFS明显低于Ki-67表达阴性患者(P<0.05),见图5~8。
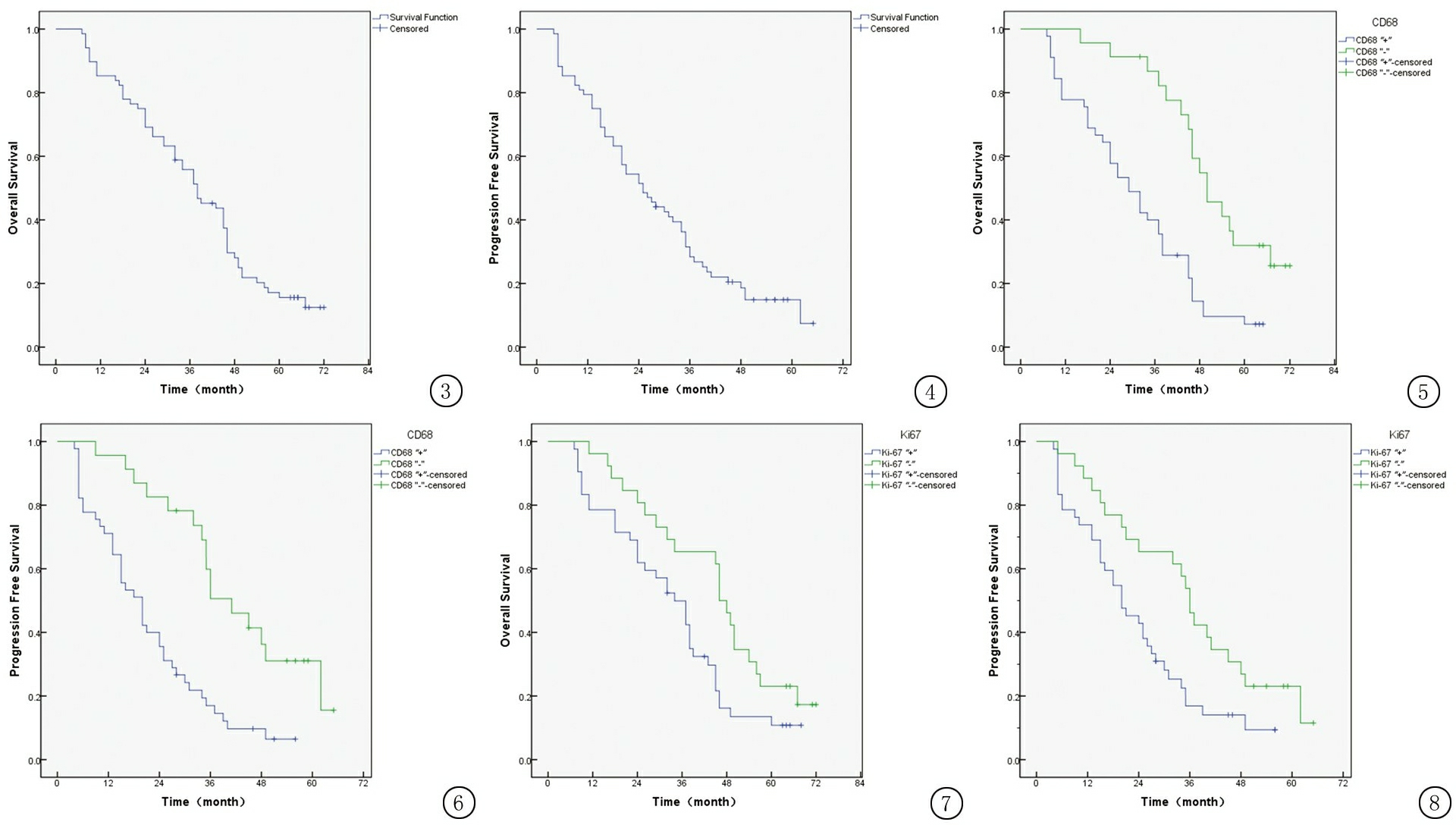
图3 68例NSCLC患者OS生存曲线
Figure3TheOScurveof68casesofpatientswithNSCLC
图4 68例NSCLC患者PFS生存曲线
Figure4ThePFScurveof68casesofpatientswithNSCLC
图5NSCLC患者中CD68表达水平与OS生存曲线关系
Figure5Kaplan-MeiersurvivalcurvesofOSaccordingtoCD68levelinNSCLCpatients
图6NSCLC患者中CD68表达水平与PFS生存曲线关系
Figure6Kaplan-MeiersurvivalcurvesofPFSaccordingtoCD68levelinNSCLCpatients
图7NSCLC患者中Ki-67表达水平与OS生存曲线关系
Figure7Kaplan-MeiersurvivalcurvesofOSaccordingtoKi-67levelinNSCLCpatients
图8NSCLC患者中Ki-67表达水平与PFS生存曲线关系
Figure8Kaplan-MeiersurvivalcurvesofPFSaccordingtoKi-67levelinNSCLCpatients
肿瘤的发生发展不但与肿瘤细胞有关,还与肿瘤细胞存在的内环境(即肿瘤微环境)密不可分。肿瘤微环境又分为免疫微环境、炎症微环境、缺氧微环境等。不同的微环境决定了巨噬细胞不同的活化类型,通常可分为M1型和M2型。前者称为经典活化型,可参与Th1型免疫应答,具有促进炎症反应、吞噬肿瘤细胞、保护机体的作用。后者又被称为替代活化型,参与Th2型免疫应答,其抗感染作用较弱,与肿瘤微血管形成有关,并促进肿瘤进展。肿瘤细胞可产生多种巨噬细胞趋化性因子,趋化外周循环中的单核细胞进入肿瘤组织,在肿瘤微环境诱导下分化为特定的表型。TAMs的生物学特性类似于M2型巨噬细胞[5],既是免疫抑制细胞的主要成员之一,又是肿瘤炎症微环境的重要组成部分[6],参与并促进了肿瘤的发生、发展,并介导免疫逃逸。付玉等[7]研究发现,TAMs通过分泌表皮生长因子和肝细胞生长因子等多种生长因子促进肿瘤生长和增殖。CD68是TAMs的分子标志物之一。本研究结果显示,NSCLC组织中CD68阳性表达率显著高于正常肺组织,且CD68的表达与TNM分期、淋巴结转移、侵及胸膜有关。表明肿瘤的炎症浸润中存在大量的巨噬细胞,NSCLC微环境中的CD68可能参与了NSCLC的发生、发展过程。这与Almatroodi等[8]的研究报道一致。本研究生存分析显示,CD68阴性表达的NSCLC患者生存时间明显长于CD68阳性表达患者(P<0.05),即CD68表达越高,预后越差。这与多种实体肿瘤如胃癌、肝癌、星形胶质瘤中CD68高表达与生存期短呈正相关研究结果一致[9-11]。
Ki-67是增殖细胞核基质内抗原的一种,是目前较肯定的核增殖标志物[12]。Ki-67的表达影响着细胞的增殖周期,在G0期不表达,而在G1、G2、S、M期均有表达,尤以 G2期和M期表达最强,一旦增生期结束,细胞内表达的Ki-67会迅速降解[13]。因此,Ki-67可作为评估NSCLC[14]、乳腺癌[15]、前列腺癌[16]、基底细胞癌[17]等恶性肿瘤增殖的标志物。韩影等[18]发现,NSCLC中Ki-67与血管内皮生长因子表达密切相关,可作为肺癌生长、转移的一个可靠的生物学指标。本研究结果显示,Ki-67在NSCLC中的表达与组织分化程度、TNM分期和淋巴结转移有关(P<0.05)。表明Ki-67高表达是判断恶性肿瘤预后的一个有价值的指标。本研究生存分析显示,Ki-67阴性表达的NSCLC患者生存时间明显长于Ki-67阳性表达患者(P<0.05)。表明Ki-67阳性表达患者生存期较短,预后较差。本研究还显示分化程度、淋巴结转移是预后的独立因素。表明分化程度越低、有淋巴结转移,患者预后越差。
本研究结果显示CD68与Ki-67表达呈正相关性,表明在NSCLC患者中CD68阳性TAMs浸润可能促进了肺癌细胞的增殖。这与邢洲等[11]研究结果相似。有研究认为,肿瘤及其相关介质细胞可分泌多种趋化因子和细胞因子如单核细胞趋化蛋白1、集落刺激因子1等[19],可将巨噬细胞招募至肿瘤组织并诱导其向TAMs转化。TAMs可释放多种物质,诱导血管形成,进而促进肿瘤生长,即导致Ki-67高表达。本研究联合检测 CD68与Ki-67的表达情况,结果显示二者均过表达的患者其生存期更短。表明联合检测CD68与Ki-67蛋白表达水平可能会更好地预测NSCLC患者的预后。
综上所述,TAMs、Ki-67均参与了NSCLC的整个发生、发展过程,二者联合检测可作为临床诊断、辅助治疗的潜在靶点。
[参考文献]
[1] Mei J,Xiao Z,Guo C,et al. Prognostic impact of tumor-associated macrophage infiltration in non-small cell lung cancer:a systemic review and meta-analysis[J]. Oncotarget,2016,7(23):34217-34228.
[2] 李云,殷培伟,李东,等.非小细胞肺癌组织Ki-67与Cox-2表达相关性分析[J].中华肿瘤防治杂志,2014,21(5):364-367.
[3] 梁晓杰,王晋芬,白纬,等.CD68、cyclin D1蛋白和bcl-6基因在弥漫性大B细胞淋巴瘤中的表达及意义[J].中华病理学杂志,2015,44(8):559-564.
[4] 邬万新,张怡,郭志琴,等.Ki-67检测结果与乳腺癌临床病理指标的相关性分析[J].中华病理学杂志,2015,44(9):657-658.
[5] 张恩欣,周岱翰,侯超.益气除痰方抑制肿瘤相关巨噬细胞的抗肿瘤免疫功能研究[J].中华肿瘤防治杂志,2016,23(10):627-630,635.
[6] Tang X,Mo C,Wang Y,et al. Anti-tumour strategies aiming to target tumour-associated macrophages[J]. Immunology,2013,138(2):93-104.
[7] 付玉,贾晓阳,郝慧芳.黏着斑激酶与肿瘤微环境[J].中国生物化学与分子生物学报,2016,32(10):1091-1096.
[8] Almatroodi SA,McDonald CF, Darby IA,et al. Characterization of M1/M2 tumour-associated macrophages(TAMs) and Th1/Th2 cytokine profiles in patients with NSCLC[J]. Cancer Microenviron,2016,9(1):1-11.
[9] Zhang J,Yan Y,Yang Y,et al. High infiltration of tumor-associated macrophages influences poor prognosis in human gastric cancer patients,associates with the phenomenon of EMT[J]. Medicine (Baltimore),2016,95(6):e2636.
[10] 陈利君,陈静琦,曾波航.肝癌组织中CD68+肿瘤相关巨噬细胞数量与Ki-67蛋白表达及原发性肝癌预后的关系[J].肿瘤防治研究,2016,43(9):774-778.
[11] 邢洲,曾敏灵,张惠,等.肿瘤相关巨噬细胞与星形胶质瘤增殖的相关性[J].广东医学,2015,36(23):3638-3640.
[12] 贾振军,李其海,曲勇,等.Ki-67在癌前病变及胃腺癌中的表达及意义[J].河北医科大学学报,2015,36(8):915-917,925,封3.
[13] 云芬,贾永峰,韩昭,等.HIF-2α在非小细胞肺癌组织中的表达及其与微血管密度、Ki67和GST-π的关系[J].吉林大学学报:医学版,2016,42(5):954-957.
[14] Wen S,Zhou W,Li CM,et al. Ki-67 as a prognostic marker in early-stage non-small cell lung cancer in Asian patients:a meta-analysis of published studies involving 32 studies[J]. BMC Cancer, 2015,15:520.
[15] Stathopoulos GP,Malamos NA,Markopoulos C,et al. The role of Ki-67 in the proliferation and prognosis of breast cancer molecular classification subtypes[J]. Anticancer Drugs,2014,25(8):950-957.
[16] Desmeules P,Hovington H,Nguile-Makao M,et al. Comparison of digital image analysis and visual scoring of Ki-67 in prostate cancer prognosis after prostatectomy[J]. Diagn Pathol,2015,10:67.
[17] Zhao H,Cao Y,Wang G,et al. Expression of FOXC2,PinX1,Ki-67 and Cyclin D1 in cutaneous cell carcinoma[J]. Oncol Lett,2017,14(1):635-638.
[18] 韩影,刁文卓,陈萍,等.荧光原位杂交技术检测非小细胞肺癌EGFR基因状态及与VEGF、D2-40、Ki-67表达相关性临床意义研究[J].中国实验诊断学,2014,18(12):1926-1928.
[19] 吴婷,周武雄.肿瘤微环境中肿瘤相关巨噬细胞的研究进展[J].细胞与分子免疫学杂志,2016,32(2):265-267,271.
(本文编辑:许卓文)
ExpressionandprognosticsignificanceofTAMsandKi-67innonsmallcelllungcancer
WEIYu-sen1,YANGLong-fei1,ZHANGXiao-lu1,ZHANGHong-zhen1,2*
(1.GraduateSchoolofHebeiMedicalUniversity,Shijiazhuang050017,China; 2.The5thDepartmentofOncology,HebeiGeneralHospital,Shijiazhuang050051,China)
[Abstract]ObjectiveTo investigate the expression levels of tumor associated macrophages(TAMs), tumor proliferation factor(Ki-67) in non-small cell lung cancer(NSCLC) and their relationships with the clinical pathological features, and to study its relationship with prognosis.MethodsImmunohistochemical SP method was used to analyze the expressions of CD68(TAMs surface marker) Ki-67 and in 68 cases of NSCLC tissues and 17 cases of normal lung tissues. According to the results of follow-up, Kaplan-Meier survival analysis and Cox regression analysis of CD68, Ki-67 was used to study its relationship with lung cancer prognosis.ResultsThe positive rates of CD68 and Ki-67 in 68 cases of lung cancer were 66.2%(45/68) and 61.8%(42/68). The positive expression rates of CD68 and Ki-67 in normal lung tissues were 17.6%(3/17) , 5.9%(1/17), the difference was statistically significant(P<0.05). The expression of CD68 and Ki-67 in NSCLC tissues with high TNM stage, lymph node metastasis and invasion were significantly increased(P<0.05).In addition, the expression of Ki-67 in poorly differentiated patients increased. There was a positive correlation between CD68 and Ki-67 expression in NSCLC(r=0.461,P=0.000). Sixty-eight patients with NSCLC 1, 3, 5-year survival rate were 86.76%, 64.71%, 16.18%. Cox multivariate analysis showed that the low degree of differentiation and lymph node metastasis are risky factors for adverse prognosis(P<0.05).ConclusionCD68, Ki-67-positive lung cancer patients with poor prognosis. CD68 and Ki-67 play a role in the development, invasion and metastasis of NSCLC, and combined detection of them provide a potential target for clinical diagnosis, adjuvant therapy of NSCLC.
[Key words]carcinoma,non-small-celllung;tumorassociatedmacrophages;Ki-67
[中图分类号]R734.2
[文献标志码]A
[文章编号]1007-3205(2017)10-1135-06
[收稿日期]2017-04-18;
[修回日期]2017-05-11
[基金项目]河北省医学科学研究重点课题计划(ZD20140479)
[作者简介]魏宇森(1990-),男,河北石家庄人,河北医科大学研究生学院医学硕士研究生,从事恶性肿瘤诊治研究。
*通讯作者。E-mail:hognzhenzhang456@sohu.com
doi:10.3969/j.issn.1007-3205.2017.10.005