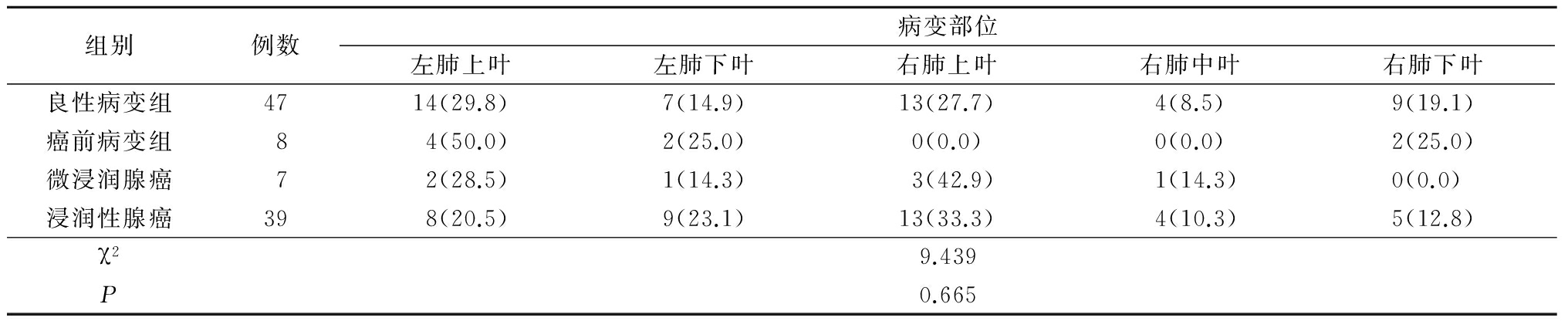
表1各病理类型组病变部位比较
Table1Comparisonofdiseasedregionamongdifferentpathologicgroups(例数,%)
·论著·
张晨光1,刘 浩2,李淑静1*,孙梦月1,朱振龙3,李建科4
(1.河北医科大学第一医院放射科,河北 石家庄 050031;2.河北医科大学第一医院核医学科,石家庄 050031;3.河北医科大学第一医院病理科 河北 石家庄 050031;4.河北医科大学第一医院胸外科, 河北 石家庄 050031)
[摘要]目的对不同病理类型的肺内单发亚实性结节(subsolid nodules,SSNs)与支气管及周围血管的关系进行分型,探讨其对此类结节良恶性的诊断价值。方法回顾性分析101例经临床、病理证实的肺内单发SSNs的CT图像。按照支气管与SSNs中实性或磨玻璃成分关系分为5型,按照供血血管是否扭曲扩张及其走行将SSNs与供血血管的类型分为4型,对不同病理类型SSNs与支气管及血管类型进行统计学分析。结果良性结节47例中,支气管分型以Ⅴ型和Ⅳ型为多(27/47,17/47),血管分型以Ⅱ型和Ⅲ型为多(28/47,13/47);浸润性腺癌组39例中,支气管分型以Ⅰ型为多(21/39),血管分型以Ⅲ和Ⅳ型为多(23/39,12/39);癌前病变组、微浸润腺癌组、浸润性腺癌组支气管分型均未表现为Ⅴ型;微浸润腺癌组、浸润性腺癌组血管分型均未表现为Ⅰ型。不同病理类型SSNs与病变大小、支气管分型、血管分型间差异均有统计学意义(P<0.01)。结论不同支气管及血管分型提示不同病理类型SSNs,其对良恶性结节的判定具有重要意义。
[关键词]结节病,肺;体层摄影术,螺旋计算机;诊断
亚实性结节(subsolidnodules,SSNs)指所有含有磨玻璃密度的肺结节[1]。近年来肺部CT对其检出率越来越高,且有研究表明持续存在的SSNs,其病理类型主要是浸润型肺腺癌及癌前病变[2]。但SSNs也可为良性病变如感染、机化性肺炎、局灶性纤维化、出血等[3]。有研究表明充气支气管征的分型可以预测小的肺腺癌的侵袭性[4],而磨玻璃结节与血管分型有助于病变良恶性的鉴别[5]。目前肺癌的主要治疗手段仍然是以手术为主的综合治疗,其预后与分期密切相关,早期诊断、早期治疗是提高肺癌患者生存率的关键[6-7]。本研究拟对SSNs与支气管及血管关系进行分析,以期提高诊断准确性。
1.1 一般资料 收集2010年1月—2016年12月河北医科大学第一医院手术病理证实或按照Fleischner学会2013版SSNs随诊推荐方案[8]证实的SSNs101例,男性41例,女性60例,年龄39~78岁,平均(58.73±8.98)岁。痰中带血4例,胸痛4例,咳嗽、咳痰12例,无症状查体发现87例。手术病理证实83例,其中良性结节29例(包括肺泡组织慢性炎症18例,胶原纤维组织增生5例,平滑肌组织瘤样增生3例,干酪样坏死2例,孤立性纤维性肿瘤1例),恶性结节(包括浸润前病变、微浸润腺癌及浸润性腺癌)54例(包括浸润性腺癌39例,微浸润腺癌7例,原位腺癌6例,不典型腺瘤样增生2例)。其余随访超过5年证实为良性结节18例。
1.2CT检查 应用GELightSpeed64层螺旋CT。患者仰卧,双手上举,于深吸气末屏气行螺旋CT扫描。扫描范围:胸廓入口至后肋膈角。扫描参数:管电压120kV,管电流为噪声系数为8的智能毫安自动控制,螺距0.938,所有患者均行层厚1.25mm、间隔1.25mm高分辨肺算法重建。
1.2.1SSNs测量 用平均直径进行量化,即病灶最大层面最大径与垂直径之和除以2[9],按病变平均直径大小将其分为<1.0cm、1.0~2.0cm、>2.0cm3种大小的病灶
1.2.2SSNs与支气管 根据SSNs与支气管的关系分为5型:Ⅰ型(支气管在实性成分中截断)及Ⅱ型(支气管无扭曲扩张及截断)SSNs的支气管在其实性成分走行,Ⅲ型(伴有支气管扭曲扩张)及Ⅳ型(不伴支气管扭曲扩张)SSNs的支气管在其磨玻璃成分中走行,Ⅴ型(支气管在SSNs旁绕行)。
1.2.3SSNs与供血血管 根据SSNs与供血血管的关系分为4型:Ⅰ型(血管在SSNs旁绕行),Ⅱ型(无扭曲扩张的血管穿过SSNs),Ⅲ型(血管在SSNs内扭曲扩张),Ⅳ型(其他复杂的血管征象)。
1.3 病理诊断 病理诊断采用2011年国际肺癌研究协会、美国胸科学会、欧洲呼吸学会分类标准[10]。手术切除后肉眼可见的病灶全部取材,HE染色及免疫组织化学染色。所有病理诊断均由2名具有高级职称的病理医师讨论后确定。
1.4 统计学方法 应用SPSS19.0统计软件分析数据。计量资料比较采用χ2检验。P<0.05为差异有统计学意义。
2.1 不同病理类型SSNs与病变部位比较 各病理类型组的病变部位分布差异无统计学意义(P>0.05),见表1。
表1各病理类型组病变部位比较
Table1Comparisonofdiseasedregionamongdifferentpathologicgroups(例数,%)

2.2 不同病理类型SSNs与病灶大小比较 各病理类型组病灶大小差异有统计学意义(P<0.05),良性病变的病灶偏小,随着病灶逐渐变大,病变恶性度增加,见表2。
2.3 不同病理类型SSNs与支气管分型比较 各病理类型组支气管分型分布差异有统计学意义(P<0.05),良性病变组支气管分型多在Ⅲ型以上(见图1),随着病变恶性度的增高,支气管分型多在Ⅲ型以下(见图2~4),见表3。
2.4 不同病理类型SSNs与血管分型比较 各病理类型组血管分型分布差异有统计学意义(P<0.05),良性病变组血管分型以Ⅱ型和Ⅲ型最多(见图1),随着恶性程度的增加,浸润型腺癌组发展到以Ⅲ型和Ⅳ型分布最多(见图3,4),见表4。
表2不同病理类型SSNs与病灶大小比较
Table2Comparisonoffocussizeamongdifferentpathologicgroups(例数,%)
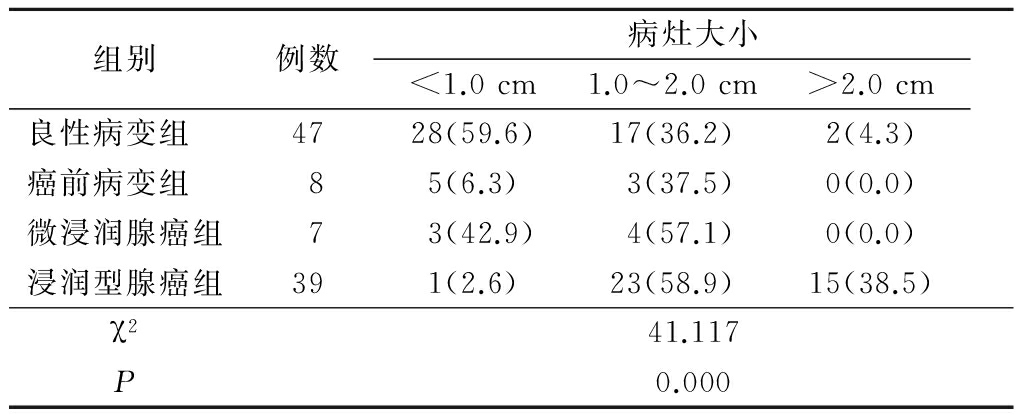
表3不同病理类型SSNs与支气管分型比较
Table3Comparisonofbronchotypingamongdifferentpathologicgroups(例数,%)
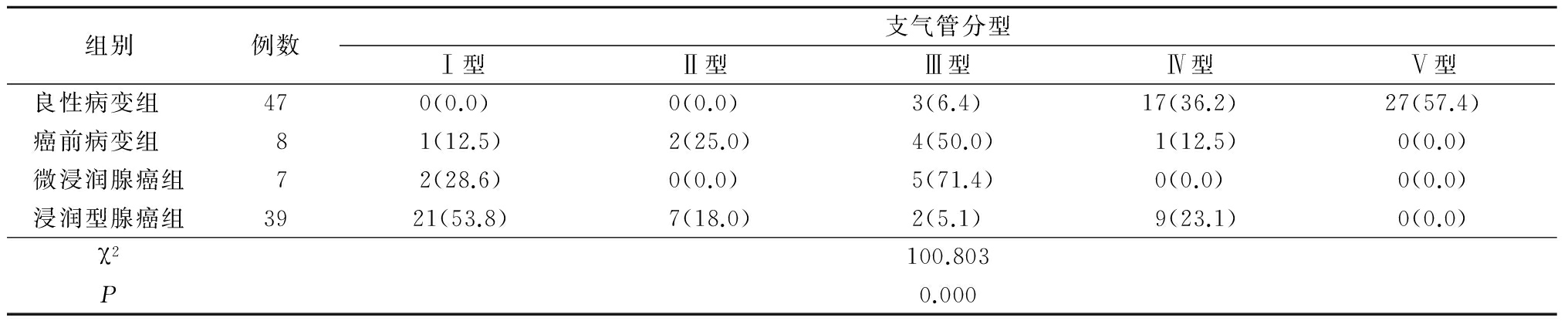
表4不同病理类型SSNs血管分型比较
Table4ComparisonofSSNstypesindifferentpathologicaltypes(例数,%)
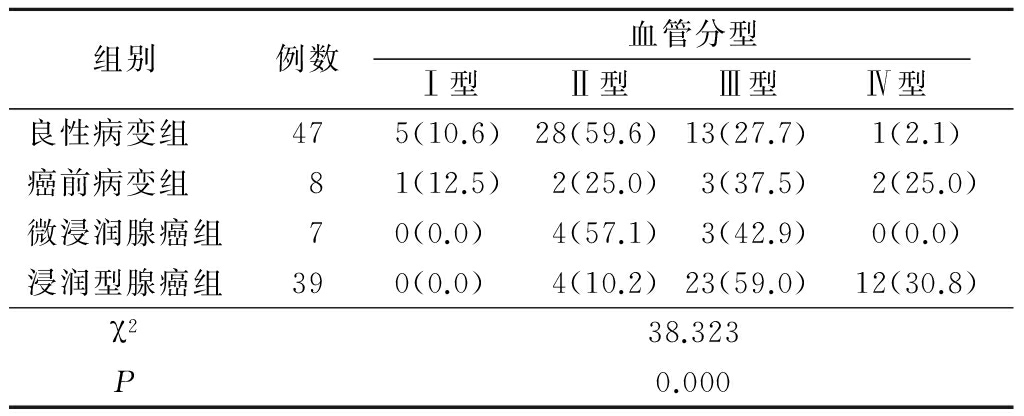
本研究结果显示不同病理类型SSNs与病变大小分布之间差异有统计学意义(P<0.01)。Eguchi 等[11]对101例肺内磨玻璃结节(其中原位腺癌47例,微浸润腺癌30例,浸润型肺腺癌24例)进行回顾性研究,发现微浸润腺癌及浸润型肺腺癌组病灶大小明显大于原位腺癌组;侵袭性肺腺癌组CT值明显高于微浸润腺癌组及癌前病变组,受试者工作特征(recelver operaing characteristic,ROC)曲线分析显示肿瘤大小(11 mm)的灵敏度和特异度分别为95.8%和46.8%,CT值(2 680 Hu)的灵敏度和特异度分别为95.8%和35.1%。联合肿瘤大小及CT值,其灵敏度和特异度分别为91.7%和71.4%;认为肿瘤病灶大小及CT值可以预测病变侵袭性。Takahashi等[9]对502例临床分期为ⅠA期肺腺癌进行了研究,发现肿瘤整体大小及实性成分大小分别为(1.97 ± 0.59) cm 和(1.20±0.88 ) cm。多元回归分析显示肿瘤实性成分大小和肿瘤最大摄取值是预测肿瘤恶性程度的独立预测因素(分别为风险比2.30、 95%可信区间1.46~3.63、P<0.01,风险比1.08、95%可信区间1.00~1.17、P<0.05)。Mao等[12]对209个肺内结节进行了研究,将其分为癌前病变组(102个,其中25个不典型腺瘤样增生,77个原位腺癌)和侵袭性腺癌组(107个,其中78个微浸润腺癌,29个浸润性腺癌),结果显示2组结节在形态、大小和不同窗宽病变差异均有统计学意义(分别为χ2=8.142、P=0.004、χ2=-4.571、P=0.000、χ2=-6.297、P=0.000),认为当病变大小超过8.9 mm且形态不规则,在窗宽<1 250 Hu时未见显示,提示病变更倾向于侵袭性肺癌。 Katami等[13]对78例纯磨玻璃结节(pure ground glass nodule, pGGN)患者进行回顾性研究,发现所有最大径 ≤10 mm、CT值≤-600 Hu为非侵袭性病变,而最大径>10 mm 和 CT值>-600 Hu多为侵袭性病变(21/26,81%);进一步对组织学类型进行统计学分析,当pGGN最大径≤10 mm、CT值≤-600 Hu时,组织学类型为非典型腺瘤样增生的特异度为90%,灵敏度和阴性预测值均为100%,组织学类型为微浸润腺癌和侵袭性腺癌的特异度为58%,灵敏度和阴性预测值为0%;认为对于最大径 ≤10 mm 和 CT值≤-600 Hu的pGGN更多为癌前病变,应慎重手术。
本研究结果显示,良性结节47例中支气管类型为Ⅴ型27例(57.4%),Ⅳ型17例(36.2%),未见Ⅰ型和Ⅱ型;而浸润性腺癌39例中,支气管类型为Ⅰ型21例(53.8%),Ⅱ型7例(18.0%),Ⅳ型9例(23.1%);癌前病变组及微浸润腺癌组支气管类型最多均为Ⅲ型,分别为4例(50.0%)及5例(71.4%);癌前病变组、微浸润腺癌组及浸润性腺癌组均未见Ⅴ型。不同病理类型与支气管分型比较差异有统计学意义(χ2=100.803,P<0.01)。笔者认为如SSNs与支气管类型为Ⅴ型,提示病变为良性可能性大;如为Ⅰ型或Ⅱ型,提示病变为恶性可能性大;如为Ⅲ型或Ⅳ型,则良恶性均有可能,但癌前病变及微浸润腺癌可能性增加。其可能原因为:肺腺癌多起源于支气管的黏膜上皮和腺上皮,可管外生长,管内生长,管内外同时生长,或沿支气管壁生长,肺腺癌多倾向于管外生长及附壁生长。各种生长方式均可导致支气管管壁增厚,走行迂曲,局部扩张;管内生长、管内外同时生长及沿管壁生长均可导致支气管管腔狭窄甚至闭塞。而当病变内未见支气管时则无病理上生长为肺腺癌的条件,故一般为良性病变。本研究所有表现为Ⅴ型SSNs均为良性结节,而Ⅰ型及Ⅱ型SSNs则均为恶性结节。
本研究结果显示,良性病变组47例中血管分型Ⅱ型最多为59.6%(28/47),Ⅰ型为10.6%(5/47)。而微浸润腺癌组、浸润型肺腺癌组均未表现为Ⅰ型;癌前病变组8例中1例表现为Ⅰ型;浸润性腺癌组39例中Ⅲ型最多为59.0%(23/39),Ⅳ型为30.8%(12/39);不同病理类型SSNs与血管分型比较差异有统计学意义(χ2=38.323,P<0.01)。笔者认为如SSNs与血管分型表现为Ⅰ型,提示病变为良性的可能性大;如为Ⅲ型或Ⅳ型,提示病变为恶性可能性大;而表现为Ⅱ型则良恶性均有可能,但即使为恶性病变,其更倾向于癌前病变或微浸润腺癌。其可能原因为一种称为血管生成拟态(vasculogenic mimicry,VM)的肺癌血液供应方式[13],此时尚未出现CT上肉眼可见的血管形态学改变,故癌前病变组8例中2例表现为Ⅱ型,微浸润腺癌组4例表现为Ⅱ型。Wu等[14]对305例肺癌患者的研究中发现VM阳性率为35.7%,且VM与肺癌临床分期、病理分期及淋巴结转移均呈正相关,平均生存时间相对较短。
总之,不同病理类型SSNs与周围血管及支气管分型不同,对SSNs性质的判定有一定帮助。SSNs与周围血管分型表现为Ⅰ型,与充气支气管分型为Ⅴ型时,提示良性可能性大;与周围血管分型为Ⅲ或Ⅳ型,与充气支气管分型为Ⅰ或Ⅱ型,提示恶性可能性大,提倡采用积极的干预措施。(本文图见封三)
[参考文献]
[1] Kim HY,Shim YM,Lee KS,et al. Persistent pulmonary nodular ground-glass opacity at thin-section CT:histopathologic comparisons[J]. Radiology,2007,245(1):267-275.
[2] Kim H,Park CM,Koh JM,et al. Pulmonary subsolid nodules:what radiologists need to know about the imaging features and management strategy[J]. Diagn Interv Radiol,2014,20(1):47-57.
[3] Seidelman JL,Myers JL,Quint LE. Incidental,subsolid pulmonary nodules at CT:etiology and management[J]. Cancer Imaging,2013,13(3):365-373.
[4] Zhang Y,Qiang JW,Shen Y,et al. Using air bronchograms on multi-detector CT to predict the invasiveness of small lung adenocarcinoma[J]. Eur J Radiol,2016,85(3):571-577.
[5] Gao F,Li M,Ge X,et al. Multi-detector spiral CT study of the relationships between pulmonary ground-glass nodules and blood vessels[J]. Eur Radiol,2013,23(12):3271-3277.
[6] Fukui T,Mitsudomi T. Small peripheral lung adenocarcinoma:clinicopathological features and surgical treatment[J]. Surg Today,2010,40(3):191-198.
[7] Tsutani Y,Miyata Y,Nakayama H,et al. Appropriate sublolar resection choice for ground glass opacity-dominant clinical stage ⅠA lung adenocarcinoma:wedge resection or segmentectomy[J].Chest,2014,145(1):66-71.
[8] Naidich DP,Bankier AA,MacMahon H,et al. Recommendations for the management of subsolid pulmonary nodules detected at CT:a statement from the Fleischner Sociery[J]. Radioligy,2013,266(1):304-317.
[9] Takahashi S,Tanaka N,Okimoto T,et al. Long term follow-up for small pure ground-glass nodules:implications of determining an optimum follow-up period and high-resolution CT findings to predict the growth of nodules[J]. Jpn J Radiol,2012,30(3):206-217.
[10] Travis WD,Brambilla E,Noguchi M,et al. International association for the study of lung cancer/american thoracic Society/european respiratory society international mutidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol,2011,6(2):244-285.
[11] Eguchi T,Kondo R,Kawakami S,et al. Computed tomography attenuation predicts the growth of pure ground-glassnodules[J]. Lung Cancer,2014,84(3):242-247.
[12] Mao H,Labh K,Han F,et al. Diagnosis of the invasiveness of lung adenocarcinoma manifesting as ground glass opacities on high-resolution computed tomography[J]. Thorac Cancer, 2016,7(1):129-135.
[13] Katami A,Sano F,Hayashi S,et al. Correlation between histological invasiveness and the computed tomography value in pure ground glass nodules[J]. Surg Today,2016,46(5):593-598.
[14] Wu S,Yu L,Cheng Z,et al. Expression of maspin in non-small cell lung cancer and its relationship to vasculogenic mimicry[J]. J Huazhong Univ Sci Technolog Med Sci,2012,32(3):346-352.
(本文编辑:许卓文)
Diagnosticstudyofdifferentpathologicaltypesofnodularnoduleswithvascularandbronchialclassification
ZHANGChen-guang1,LIUHao2,LIShu-jing1*,SUNMeng-yue1,ZHUZhen-long3,LIJian-ke4
(1.DepartmentofMedicalImaging,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China; 2.DepartmentofNuclearMedicine,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China; 3.DepartmentofPathology,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China; 4.DepartmentofThethocicSurgery,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China)
[Abstract]ObjectiveTo classify the relationship between the subsolid nodules(SSNs) and the bronchi and the surrounding vessels in different pathological types, and to investigate the diagnostic value of benign and malignant nodules.MethodsMulti-slice spiral CT imaging of 101 subsolid nodules were retrospectively reviewed. According to the relationships between bronchus and the component of subsolid nodules, the types between subsolid nodules and bronchi were divided into five types. Depending on the vasculars' expansion or not and their tracks, the types between subsolid nodules and vasculars were categorized into four types. Statistical analysis was performed on the relationship between the types of vascular and brochi and subsolid nodules.ResultsOf 47 benign subsolide nodules, brochus type Ⅴ and Ⅳ(27/47, 17/47) were the main relationships and the vascular type Ⅱ and Ⅲ(28/47,13/47) were the main relationships. Of 39 invasive adenocarcinomas, brochus type Ⅰ(21/39) was the main relationship and the vascular type Ⅲ and Ⅳ(23/39,12/39) were the main relationships. All of the nodules of premalignant group, micro-invasive adenocarcinoma group and invasive adenocarcinoma group were not the brochus type Ⅴ and all of the nodules of micro-invasive adenocarcinoma group and invasive adenocarcinoma group were not the vascular typeⅠ. There was significant statistic significance between the different pathology patterns of subsolid nodules and the lesion sizes, the types of brochi and vascular(P<0.01).ConclusionDifferent types of bronchi and vascular predict different pathology patterns of subsolid nodules. It is important to predict the malignant and benign of subsolid nodules.
[Key words]sarcoidosis,pulmonary;tomography,spiralcomputed;diagnosis
[中图分类号]R563
[文献标志码]A
[文章编号]1007-3205(2017)10-1184-06
[收稿日期]2017-08-02;
[修回日期]2017-08-31
[基金项目]河北省医学科学研究重点课题(20160685)
[作者简介]张晨光(1977-),男,河北唐山人,河北医科大学第一医院主治医师,医学学士,从事医学影像诊断研究。
*通讯作者。E-mail:lishujing1976@126.com
doi:10.3969/j.issn.1007-3205.2017.10.016