表1多重耐药鲍曼不动杆菌REP-PCR分类
Table1TheREP-PCRclassificationofmultidrugresistanceAcinetobacterbaumannii
·论著·
李 帅1,张鲁涛1,李海涛1,王伯丽1,史晶晶2
(1.河北医科大学第二医院呼吸内一科,河北 石家庄 050000;2.石家庄信息工程职业学院,河北 石家庄 050035)
[摘要]目的研究群体感应系统基因簇在菌体生物被膜状态的独特表达。方法收集河北医科大学第二医院临床检验科细菌室,分离培养的多重耐药鲍曼不动杆菌;比较同一菌株在不同生长状态,即快速生长期和生物被膜状态下,群体感应系统基因簇的不同表达。结果同一菌体在快速生长期和生物被膜包埋期有着显著不同的基因表达,表达差异基因最显著的集中于菌体外膜蛋白的表达和细胞内通路的因子调控。菌株在生物被膜状态下,表达差异的基因在生物被膜形成和形态维持过程中,起到了至关重要的作用。其中,群体感应系统基因簇是重要的调控因子之一。在细菌生物被膜状态下,表达显著升高。结论细菌生物被膜的形成,可以使鲍曼不动杆菌长期存活在生物或非生物的表面;在生物被膜中,细菌菌株得到持续的保护,造成了菌株耐药性的增加和院内感染的反复发生。菌体生物被膜的生成和形态维持,其中很重要的调控因子是群体感应系统基因簇。它可能参与调控生物被膜内各个菌落间生物行为和联系,使得生物被膜整体维持平衡。
[关键词]鲍氏不动杆菌;抗药性,多药;生物被膜形成
doi:10.3969/j.issn.1007-3205.2017.11.001
鲍曼不动杆菌是一种革兰阴性杆菌,其致病力强,常常引起广泛而严重的院内感染。近年来,多重耐药鲍曼不动杆菌越来越受到全世界临床医师的广泛关注;究其原因,是由于其卓越广泛的耐药性和超强的形成细菌生物被膜的能力[1-2]。多重耐药鲍曼不动杆菌难以治疗,已经成为目前亟待解决的临床难题;其对目前大多数抗生素治疗均是耐药的,造成了治疗的极大困难。有研究表明,鲍曼不动杆菌的耐药性,主要是由于菌体生物被膜的产生;过去曾认为特殊的耐药基因或许并不是主要原因[3]。菌体生物被膜的形成,被认为是其致病力的重要特点;尤其是对于危重症患者来说,细菌生物被膜的形成,可以使其长期存活在生物或非生物的表面;可以使其在不利的外环境下,在宿主的免疫攻击下,仍可以长期存活[4]。细菌生物被膜,为菌体提供持续的保护,造成了菌株耐药性的增加和院内的反复感染的发生。本研究通过转录组学研究,试图揭示群体感应系统基因簇在生物被膜形成和维持过程中的表达变化。现报告如下。
1.1 菌株筛选 试验用菌株选自河北医科大学第二医院临床检验科细菌室。筛选2016年我院多重耐药鲍曼不动杆菌。将所有筛选菌株,再次进行药物敏感检测,剔除非鲍曼不动杆菌以及非多重耐药菌株。多重耐药菌株入选标准是所筛选菌株对所有抗生素有3种或3种以上耐药。
1.2 菌株分型 采用重复序列聚合酶链反应(repetitive extragenic palindromic polymerase chain reaction,REP-PCR)方法将收集入选的菌株608株提取DNA,分析菌株亚型。在离心管中配置0.7麦氏浊度菌悬液,向菌体沉淀中加入溶菌酶,37 ℃处理45 min,再向管中加入蛋白酶K。70 ℃放置10 min,加入无水乙醇,反复洗涤,吸附,洗脱,得到菌株基因组DNA。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性1 min,退火温度45 ℃,1 min循环35次,72 ℃延伸10 min。用凝胶成像系统观察结果。
1.3 样本制备 选取PCR分型数量最多优势菌株第5亚型多重耐药鲍曼不动杆菌株Acinetobacter baumannii BJAB0868,进行研究。制备2个不同生长状态,即快速生长期和生物被膜状态的样本。
菌株用无菌肉汤配制成0.7麦氏比浊浓度菌液,37 ℃恒温且持续摇晃的微量振荡器上培养7~8 h,获得快速生长期菌株,用酶标仪测定600 nm吸光度值(检测OD600=0.4)。
菌株用无菌肉汤配制成0.7麦氏比浊浓度菌液,培养在50 mL微发酵罐内,持续培养在37 ℃恒温无菌培养箱内,培养96 h。96 h后,用PBS液清洗3次,无菌环境中常温风干,加入1%结晶紫2 mL,染色30 min。再用PBS反复清洗,95%乙醇,脱色15 min,用酶标仪测定600 nm吸光度值,为空白对照的2倍以上者为生物膜形成阳性。用电子显微镜观察细菌生物被膜生长情况。选取生物被膜,应用细胞刮刀,轻轻刮下,悬浮于无菌肉汤中。
1.4 2个样本RNA提取和高通量测序分析 比较同一菌株不同生长状态,即快速生长期和生物被膜状态,2个样本转录组基因的表达。
取2个样本0.7麦氏比浊浓度菌液200 μL,离心(3 500 r/min,10 min,37 ℃),得到细菌混悬液。
分别提取上述2个样本的细菌总RNA:应用RNAprotect Bacteria Reagent和RNeasy Mini Kit试剂盒,进行高通量测序分析;应用life-tech Ribominus系列试剂盒提取。将上述2个样本进行mRNA的纯化,再将纯化后的样本打断,然后进行反转录、末端修复;之后进行PCR扩增。随后,进行样本的基因测序,高通量测序分析转录组基因的表达。测序基因序列比对至公共数据库,进行基因功能注释。
1.5 统计学方法 应用R version 3.3.0统计学软件分析数据。两个样本间基因表达比较采用Fisher精确检验方法。P<0.05为差异有统计学意义。
2.1 菌株亚型REP-PCR分型 所有菌株大体分为7个亚型,数量最多的优势菌株为第5亚型多重耐药鲍曼不动杆菌株Acinetobacter baumannii BJAB0868,见表1。
表1多重耐药鲍曼不动杆菌REP-PCR分类
Table1TheREP-PCRclassificationofmultidrugresistanceAcinetobacterbaumannii
2.2 检测基因质量评估 对检测出的基因序列进行评估,用RSEM软件评估转录组测序时对RNA的打断是否随机,若不随机则可能对后续的分析产生较大偏倚。根据转录组基因序列的特点,转录组基因测序序列距离转录本的5′端和3′端越近,测序深度越低,但总体的均一化程度就会越高。统计学分析结果显示,所测序的基因序列符合上述特点,判定为合格的转录组测序,可行进一步分析。横坐标为距离转录本5′端的相对位置(以百分比表示),纵坐标为覆盖深度的平均值,可知本研究2个样本基因测序序列符合正常RNA测序特点,为合格测序。见图1。
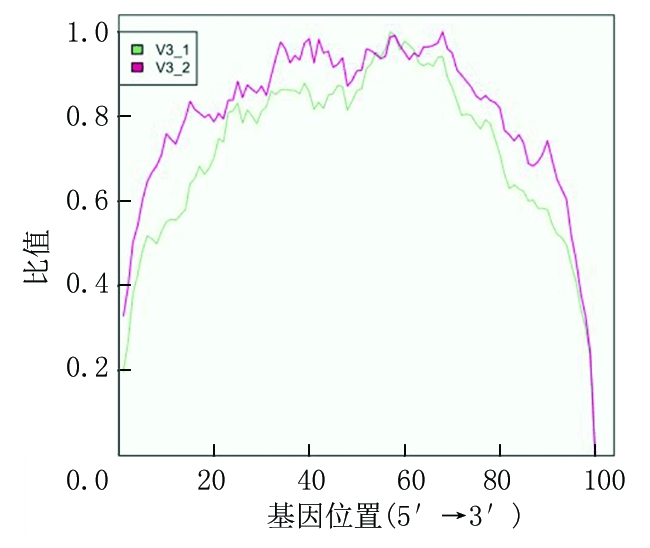
图1 2个样本基因测序均一化分布曲线
Figure1Theuniformdistributioncurveoftwosamplegene
2.3 多重耐药鲍曼不动杆菌不同状态的转录组基因表达不同 同一菌株在2种不同的状态下,生物被膜状态与快速生长期的细菌相比,基因表达存在显著差异。相对于快速生长期的细菌,生物被膜状态下,有106个基因表达上调,92个基因表达下调。细菌的生物被膜状态,不仅仅是细菌菌体的简单堆叠,更是一种独特的存在方式。
2.4 群体感应系统基因簇在生物被膜状态显著表达 鲍曼不动杆菌生物被膜的形成,一直以来被广泛认为是细菌慢性感染和定植的首要原因。本研究发现同一菌体在快速生长期和生物被膜包埋期不同的基因表达,以至于会出现不同的蛋白质表达。表明处于生物被膜状态的鲍曼不动杆菌处于独特的生长状态和蛋白质的表达。
调控因子在生物被膜形成和形态维持过程中,起到了至关重要的作用。其中,群体感应系统基因簇(quorum sensing,QS)是其中重要的调控因子之一。在细菌生物被膜状态下,表达显著升高,说明其可能与生物被膜生成和形态维持过程关系密切。见表2。
表2群体感应系统基因簇在2种状态表达差异
Table2Quorumsensingexpressionintwostates
过去认为菌体的生物被膜是一团菌落的组合、堆叠,不可逆地黏附于生物或非生物的表面。近期通过蛋白质组学分析以及转录组研究发现,生物被膜不单单只是细菌在不同生长阶段的简单混合物,而是一种特殊的生长期;不同于细菌的浮游状态,有着自己独特的蛋白质表型和基因表达[5]。在生物被膜中细菌菌株可以更加耐多种抗生素,耐干燥,耐各种环境的压力,甚至耐紫外线的照射。细菌生物被膜为菌体提供持续的保护,造成了菌株耐药性的增加和院内的反复感染。
细菌生物被膜的形成过程主要分为3个阶段。开始是菌体初始黏附的形成,菌体会黏附于生物或非生物的表面。细菌的菌体与黏附表面之间,依靠相互的物理或化学作用,借助非特异性静电引力、表面张力或疏水作用力等,相互黏附的过程。这个阶段是可逆的[6]。随后,进入聚集阶段。这是细菌菌体与黏附表面之间的牢固结合的过程。聚集的菌落内菌体分泌大量的细胞外基质,黏附的表面与细菌菌体表面的外膜蛋白、菌毛等结构发生特异性的结合,使得整个生物被膜趋于成熟,这个阶段黏附稳固而牢靠,黏附不再可逆[7]。细菌与黏附表面牢固而不可逆的结合后,生物被膜内的菌体会分泌大量的细胞外基质,包括细胞外多糖、细胞外遗传物质等,使得整个生物被膜各个菌落趋于整体化;生物被膜成为动态稳固结构,会从外环境吸收有机或无机营养物质,维持整个被膜形态并不断增长[8]。随着生物被膜不断增长,被膜内各菌落间以及菌落内的细菌间均会通过特定的信号通路,信号因子进行整体的调节,以适应生存和形态维持[9]。细菌菌体通过特定基因表达,表达不同信号因子,调控生物被膜动态稳定、内环境的平衡[10]。
在细菌生物被膜形成和形态维持过程中,各种特异调控基因均会发挥作用,很重要的一种是群体感应系统。QS介导细菌释放特定信号因子,进行细菌菌体内部和菌落内菌体之间的信息交流,调控被膜内基因及蛋白表达的整体行为[11-13]。本研究通过转录组学基因表达分析发现,QS在生物被膜形成和维持过程中特异表达。菌体生物被膜的生成和形态维持,很重要的是依赖于QS的调控[14-15]。QS是一种菌落密度依赖性启动表达。当菌体不断黏附聚集,达到其密度依赖阈值就会显著表达,激活相关转录调控因子。这些激活调控因子促使相关基因显著表达,从而调控整个生物被膜协调菌落间生物行为,使得生物被膜整体维持平衡[16]。
总这,QS可介导细菌释放特定信号因子,进行细菌菌体内部和菌落内菌体之间的信息交流,调控基因及蛋白表达的整体行为。抑制QS的表达会显著减少菌体生物被膜生成的密度,还会降低鲍曼不动杆菌的致病力,使其较容易受到抗生素和宿主攻击。本研究通过转录组学分析发现,QS在菌体生物被膜状态下确实显著表达。与上述观点吻合。进一步研究抑制QS的治疗,会为多耐药鲍曼不动杆菌感染提供新的治疗方向。
[参考文献]
[1] Azizi O,Shahcheraghi F,Salimizand H,et al. Molecular analysis and expression of bap gene in biofilm forming multidrug resistant Acinetobacter baumannii[J]. Rep Biochem Mol Biol,2016,5(1):62-72.
[2] 孙静娜,刘青松,刘泽世,等.多重耐药及泛耐药鲍曼不动杆菌外排泵基因adeB的研究[J].河北医科大学学报,2014,35(10):1166-1169.
[3] Lin MF,Lan CY. Antimicrobial resistance in Acinetobacter baumannii:from bench to bedside[J]. World J Clin Cases,2014,2(12):787-814.
[4] McConoughey SJ,Howlin R,Granger JF,et al. Biofilm in periprosthetic orthopedic infections[J]. Future Microbiol,2014,9(8):987-1007.
[5] Badave GK,Kulkarni D. Biofilm producing multidrug resistant Acinetobacter baumannii:an emerging challenge[J]. J Clin Diagn Res,2015,9(1):8-10.
[6] Thummeepak R,Kongthai P,Leungtongkam U,et al. Distribution of virulence genes involved in biofilm formation in multidrug resistant Acinetobacter baumannii clinical isolates[J]. Int Microbiol,2016,19(2):121-129.
[7] Duarte A,Ferreira S,Almeida S,et al. Clinical isolates of Acinetobacter baumannii from a Portuguese hospital:PFGE characterization,antibiotic susceptibility and biofilm-forming ability[J]. Comp Immunol Microbiol Infect Dis,2016,45:29-33.
[8] Inchai J,Liwsrisakun C,Theerakittikul T,et al. Risk factors of multidrug resistant,extensively drug-resistant and pandrug-resistant Acinetobacter baumannii ventilator-associated pneumonia in a Medical Intensive Care Unit of University Hospital in Thailand[J]. J Infect Chemother,2015,21(8):570-574.
[9] Liu Q,Li W,Du X,et al. Risk and prognostic factors for multidrug resistant Acinetobacter baumannii complex bacteremia:a retrospective study in a tertiary hospital of west China[J]. PLoS One,2015,10(6):e0130701.
[10] Qi L,Li H,Zhang C,et al. Relationship between antibiotic resistance,biofilm formation,and biofilm specific resistance in Acinetobacter baumannii[J]. Front Microbiol,2016,7:483.
[11] Smani Y,F brega A,Roca I,et al. Role of OmpA in the multidrug resistance phenotype of Acinetobacter baumannii[J]. Antimicrob Agents Chemother,2014,58(3):1806-1808.
brega A,Roca I,et al. Role of OmpA in the multidrug resistance phenotype of Acinetobacter baumannii[J]. Antimicrob Agents Chemother,2014,58(3):1806-1808.
[12] Zhang D,Xia J,Xu Y,et al. Biological features of biofilm forming abiliry of Acinetobacter baumannii strains derived from 121 elderly patients with hospital-acquired pneumonia[J]. Clin Exp Med,2016,16(1):73-80.
[13] Gala VC,John NR,Bhagwat AM,et al. Attenuation of quorum sensing regulated behavior by tinospora cordifolia extract & identification of its active constituents[J]. Indian J Med Res,2016,144(1):92-103.
[14] Kostoulias X,Murray GL,Cerqueira GM,et al. Impact of a cross kingdom signaling molecule of candida albicans on Acinetobacter baumannii physiology[J]. Antimicrob Agents Chemother,2015,60(1):161-167.
[15] Kandi V. Biofilm production correlating with multidrug resistance among clinical isolates of Acinetobacter baumannii[J]. J Clin Diagn Res,2015,9(6):DJ02.
[16] He X,Lu F,Yuan F,et al. Biofilm formation caused by clinical Acinetobacter baumannii isolates is associated with overexpression of the AdeFGH efflux pump[J]. Antimicrob Agents Chemother,2015,59(8):4817-4825.
LI Shuai1, ZHANG Lu-tao1, LI Hai-tao1, WANG Bo-li1, SHI Jing-jing2
(1.FirstDepartmentofRespiratoryMedicine,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 2.ShijiazhuangInformationEngineeringVocationalCollege,HebeiProvince,Shijiazhuang050035,China)
[Abstract]]ObjectiveTo study the unique expression of the quorum sensing in the bacteria biofilm formation.MethodsWe selected multidrug resistant Acinetobacter baumannii strains. Then we compared the two genomes in the rapid growth phase and biofilm state.ResultsIn the same cell, the expressions of genes in the rapid growth phase and biofilm stage were different. The most significant factors in the expression of genes were the outer membrane proteins and the regulation of intracellular pathways. In the biofilm state, these regulators played a crucial role in the formation and maintains. Among them, the quorum sensing was one of the most important regulatory factors. It was significantly increased in the biofilm state.ConclusionThe formation of bacteria biofilm could cause the long term survival of Acinetobacter baumannii. In the biofilm, the bacterial strain was continuously protected, resulting in increased resistance to the strain and repeated chronic infection in the hospital. The formation and morphology of the biofilm were relied on the regulation of quorum sensing. It may be involved in the regulation of biological behavior and contact among colonies in biofilms, so that the biofilm can be maintained as a whole.
[Key words]Acinetobacter baumannii; drug resistance, multiple; bioflim formation
[收稿日期]2017-04-07;
[修回日期]2017-05-25
[基金项目]河北省医学科学研究重点课题(ZL20140206,20130503)
[作者简介]李帅(1981-),女,河北石家庄人,河北医科大学第二医院副主任医师,医学硕士,从事呼吸疾病诊治研究。
[中图分类号]R378.79
[文献标志码]A
[文章编号]1007-3205(2017)11-1241-04
(本文编辑:赵丽洁)