Table1Comparisionofbodymassandbloodglucoseinfivegroupmice
郑坤杰1,武 革2*,耿建林1,吴美芬2,方 烁2
(1.哈励逊国际和平医院内分泌科,河北 衡水 053000;2.广东医科大学附属医院内分泌科,广东 湛江 524001)
[摘要]目的观察不同降糖药物对2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠胰岛β细胞凋亡与再生作用的影响。方法将SD大鼠随机分为正常对照组、T2DM未治疗组、利拉鲁肽组、西格列汀组、罗格列酮组各20只。正常对照组给予普通饲料,其余各组给予高脂饲料喂养8周后以链脲佐菌素30 mg/kg腹腔注射,成模后分别给予上述三药治疗4周。其余2组给予等量生理盐水皮下注射。于治疗前后分别取大鼠血清,以苏木精-伊红染色观察胰岛细胞组织学改变,以原位末端标记法检测胰岛β细胞凋亡,以实时荧光定量逆转录-聚合酶链反应法检测胰岛细胞胰腺十二指肠同源盒-1(pancreatic duodenal homeobox-1,PDX-1)基因的表达。结果利拉鲁肽组、罗格列酮组及西格列汀组治疗后空腹血糖较T2DM组及治疗前均明显降低(P<0.05)。胰岛结构及胰岛细胞数量均明显好于未治疗组,胰岛β细胞凋亡率明显降低(P<0.05)。结论利拉鲁肽、罗格列酮及西格列汀均可改善T2DM大鼠血糖,利拉鲁肽对减少体质量优于西格列汀及罗格列酮,3种药物均可增加胰岛β细胞数量、减少β细胞凋亡,其机制可能与增加胰岛β细胞PDX-1基因的表达有关,以利拉鲁肽作用更优。
[关键词]糖尿病,2型;细胞凋亡;大鼠
doi:10.3969/j.issn.1007-3205.2017.11.005
在2型糖尿病(type 2 diabetes mellitus,T2DM)的药物治疗中,除良好的血糖控制,减少胰岛β细胞凋亡、延缓β细胞衰竭,是T2DM治疗面临的困惑和挑战。与传统的格列酮类增敏剂对β细胞功能改善作用相比,新型肠促胰素类药物对胰岛β细胞凋亡及再生作用是否更具优势?本研究通过建立T2DM大鼠模型,观察利拉鲁肽、罗格列酮及西格列汀对T2DM大鼠血糖及胰腺β细胞凋亡、再生作用的影响,并探讨其对胰岛β细胞增殖与再生的作用的可能机制。
1.1 实验动物 选取60只健康雄性SD大鼠(SPF级),体质量为180~220 g, 购自广东医学院实验动物中心,许可证号:SCXK(粤)2008-0008。
1.2 主要试剂及仪器 STZ购自Sigma公司,原位胰岛细胞胰腺十二指肠同源盒-1(pancreatic duodenal homeobox-1,PDX-1)购自Roche公司,Recombinant DNase Ⅰ(RNase-free)购自日本TAKARA公司,Real-time PCR 试剂盒购自日本TOYOBO公司,反转录试剂盒购自美国Promega公司,利拉鲁肽购自诺和诺德公司,西格列汀购自默沙东公司,罗格列酮购自重庆太极集团,血糖仪及血糖检测试纸条购自德国罗氏公司。
1.3 动物模型的建立、分组及给药 雄性SD大鼠适应性喂养1周后,按随机数字表法分为正常对照组、糖尿病未治疗组、利拉鲁肽组、西格列汀组、罗格列酮组各20只。正常对照组给予普通饲料喂养,其余各组给予高脂饲料喂养8周。实验组大鼠腹腔注射链脲佐菌素30 mg/kg,正常对照组注射同等体积的柠檬酸-柠檬酸钠缓冲液。72 h后测随机尾静脉血糖。以2次随机血糖≥16.7 mmol/L为造模成模,利拉鲁肽组给予利拉鲁肽200 μg/kg皮下注射、2次/d,西格列汀组给予西格列汀100 mg/kg灌胃、1次/d,罗格列酮组给予罗格列酮4 mg/kg灌胃、1次/d,共4周。正常对照组和未治疗组组给予相同体积生理盐水皮下注射。
1.4 检测指标及方法
1.4.1 血糖、体质量测定 药物治疗前和药物治疗后监测小鼠的体质量和血糖。
1.4.2 苏木精-伊红(hematoxylin-eosin staining,HE)染色观察胰岛细胞组织学改变 将固定于10%甲醛中的胰岛脱水后常规石蜡包埋,切片。将切片二甲苯脱蜡、梯度乙醇化,伊红染色,苏木精复染,梯度脱水,二甲苯透明,中性树脂胶封片。光镜下观察,进行病理学分析。
1.4.3 TUNEL检测胰岛细胞凋亡 按试剂盒说明操作。结果判断:凋亡细胞核着染深棕色,同时对照连续切片中胰岛素染色阳性的细胞定为凋亡的β细胞。每个视野中β细胞的凋亡率=每个视野中β细胞的凋亡数÷该视野中β细胞的总数×100%,每张切片随机选择3个视野,分别计算凋亡率后取平均值作为该样本胰岛β细胞的凋亡率。
1.4.4 Real-Time RT-PCR法检测胰腺组织PDX-1 mRNA的表达 Trizol 一步法提取总RNA。取2 μg mRNA逆转录为cDNA,进行PCR扩增(反应条件:95 ℃ 5 min、95 ℃ 15 s、62 ℃ 30 s,40个循环,62 ℃ 30 s收集荧光信号);融解曲线分析:温度60~95 ℃。PDX-1 mRNA的引物由南京金斯瑞科技有限公司合成,上游引物5′-GCGAGATGCTGGCAGACC TCT-3′,下游引物5′-GGCAGACCTGGCGGTTCACAT- 3′,片段长度94 bp;以18 sRNA为内参,上游引物5′-GAATTCCCAGTAAGTGCGGGTCATA- 3′,下游引物5′-CGAGGGCCTCACTAAACCATC-3′,片段长度108 bp;PCR反应条件:95 ℃ 5 min、95 ℃ 15 s、62 ℃ 30 s,40个循环,62 ℃ 30 s收集荧光信号;融解曲线分析:温度60~95 ℃。DNA扩增仪自动分析并计算结果。
1.5 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较分别采用配对t检验、F检验及SNK-q检验。P<0.05为差异有统计学意义。
2.1 各组大鼠体质量及血糖情况 治疗后的糖尿病未治疗组、西格列汀组及罗格列酮组体质量较治疗前增加,与正常对照组比较差异均有统计学意义(P<0.05);利拉鲁肽组体质量与正常对照组差异无统计学意义(P>0.05);利拉鲁肽组体质量低于糖尿病未治疗组、西格列汀组及罗格列酮组,差异有统计学意义(P<0.05)。治疗前糖尿病未治疗组、利拉鲁肽组、西格列汀组及罗格列酮组血糖高于正常对照组(P<0.05);治疗后利拉鲁肽组、西格列汀组及罗格列酮组血糖明显降低,且均低于糖尿病未治疗组(P<0.05);利拉鲁肽组血糖低于西格列汀组及罗格列酮组(P<0.05);西格列汀组血糖与罗格列酮组差异无统计学意义(P>0.05)。见表1。
表1各组大鼠治疗前后体质量及血糖比较
Table1Comparisionofbodymassandbloodglucoseinfivegroupmice![]()
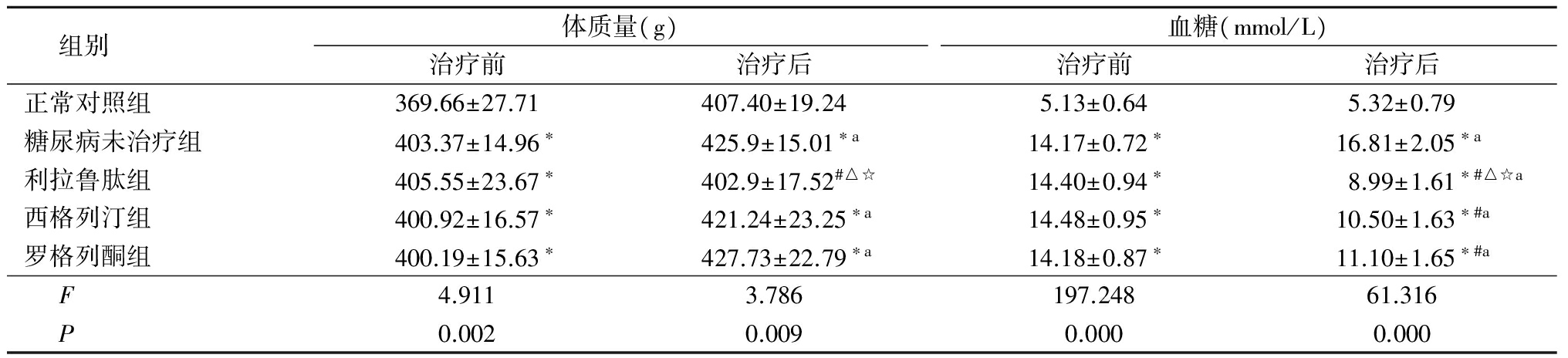
*P<0.05与正常对照组比较 #P<0.05与糖尿病未治疗组比较 △P<0.05与罗格列酮组比较 ☆P<0.05与西格列汀组比较(SNKq检验) aP<0.05与同组治疗前比较(配对t检验)
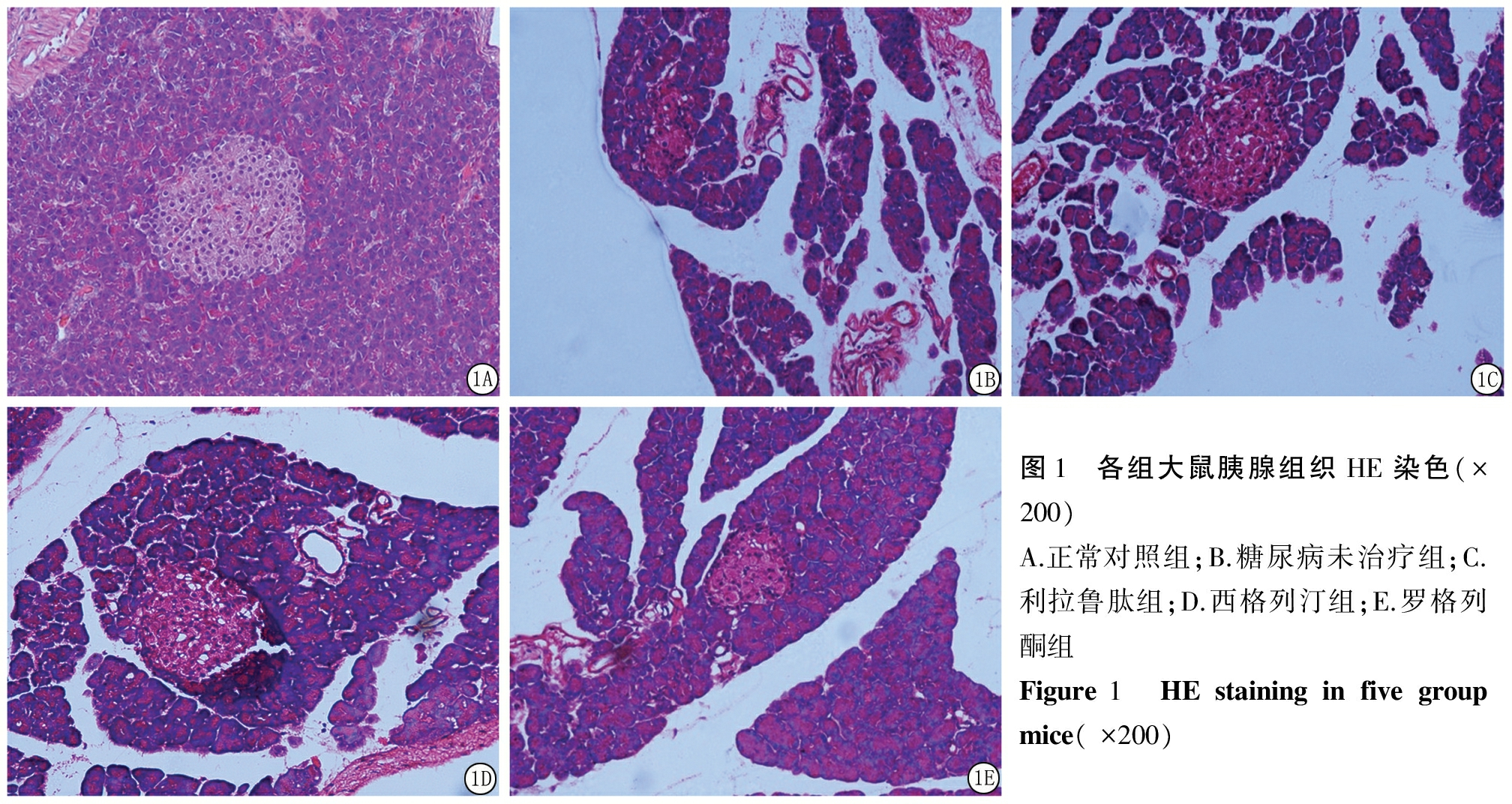
2.2 各组大鼠胰腺组织HE染色 正常对照组:胰岛呈圆形或卵圆形,分布均匀,形状规则、界限清楚,胰岛细胞数量多。糖尿病未治疗组:胰岛体积变小,分布弥散,部分胰岛排列、形状不规则,结构不清,胰岛细胞数量减少,部分可见细胞核固缩。利拉鲁肽组、西格列汀组和罗格列酮组:胰岛形状偶可见不规则,界限稍模糊,胰岛细胞数量较糖尿病未治疗组增多,而3组间差异不明显。见图1。
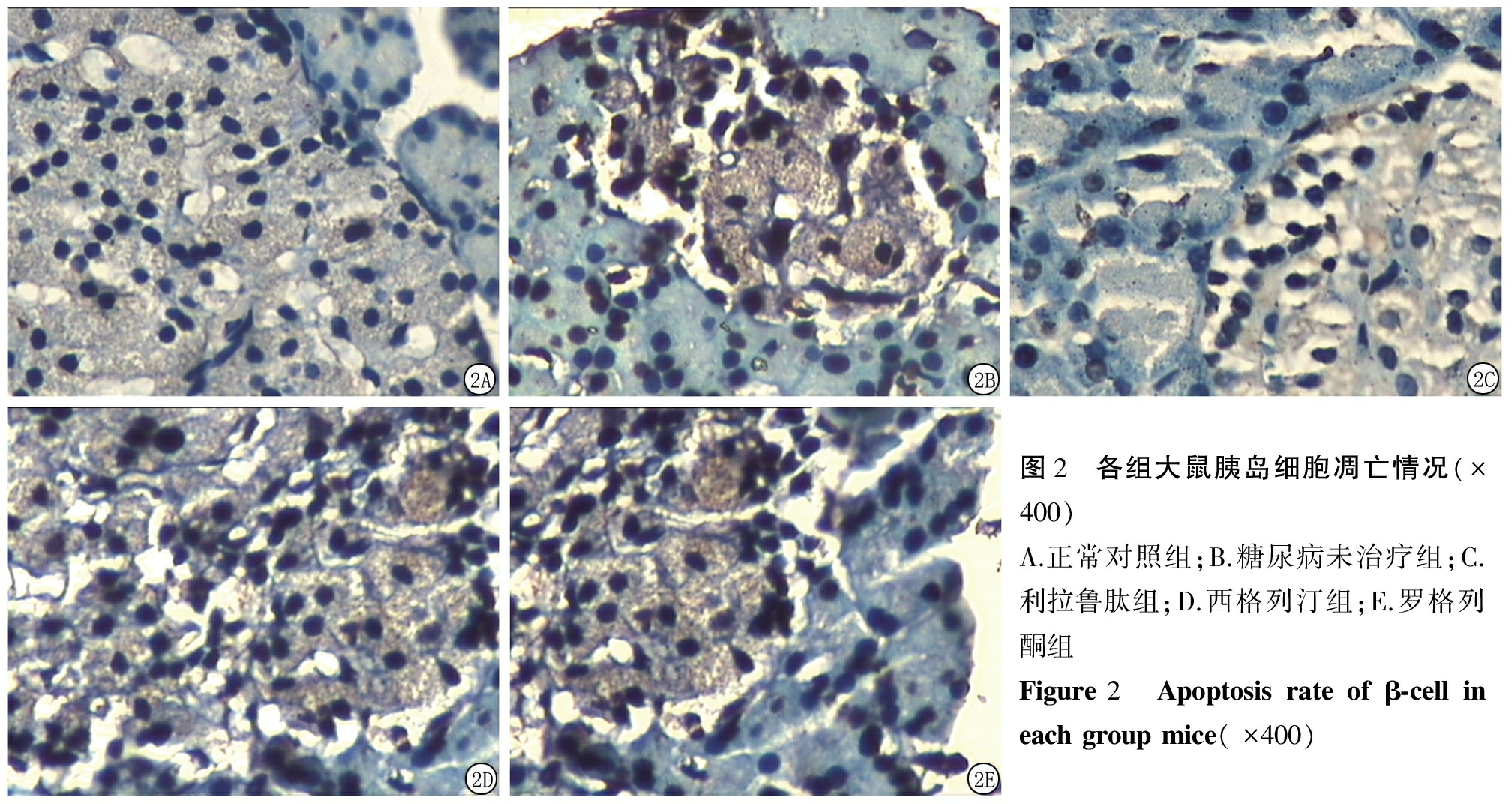
2.3 各组大鼠胰岛β细胞凋亡率 与正常对照组比较,实验组胰岛β细胞凋亡率均明显增高(P<0.05);与糖尿病未治疗组比较,利拉鲁肽组、西格列汀组及罗格列酮组凋亡率均降低(P<0.05);利拉鲁肽组凋亡率低于西格列汀组和罗格列酮组(P<0.05);西格列汀组凋亡率与罗格列酮组差异无统计学意义(P>0.05)。见表2,图2。
表2各组大鼠胰岛β细胞凋亡率比较
Table2Comparisionofisletbetacellapoptosisrateinfivegroupmice![]()
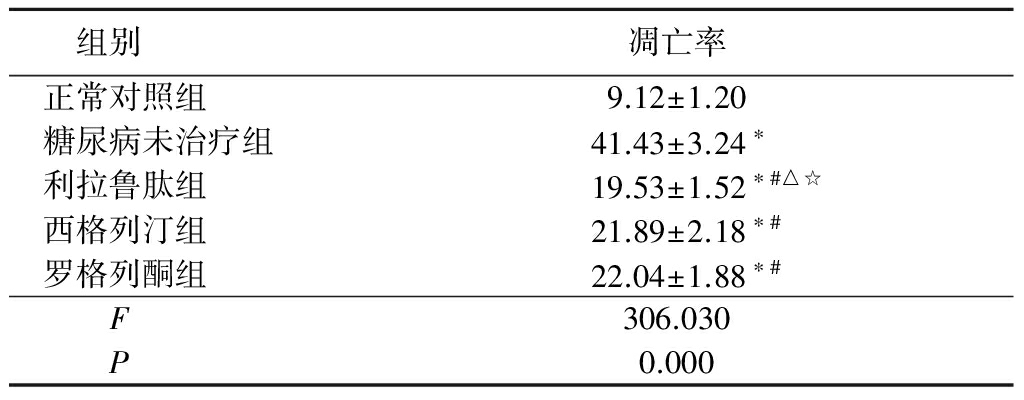
*P<0.05与正常对照组比较 #P<0.05与糖尿病未治疗组比较 △P<0.05与罗格列酮组比较 ☆P<0.05与西格列汀组比较(SNK-q检验)
2.4 各组大鼠胰腺组织PDX-1 mRNA的表达 与正常对照组比较,实验组PDX-1 mRNA的表达量均明显降低(P<0.05);与糖尿病未治疗组比较,利拉鲁肽组、西格列汀组和罗格列酮组PDX-1 mRNA的表达量明显增高,作用强度依次为利拉鲁肽组>西格列汀组>罗格列酮组(P<0.05)。见表3。
表3各组大鼠胰腺组织PDX-1mRNA表达量比较
Table3ComparisionoftheexpressionofPDX-1mRNAinfivegroupmice![]()
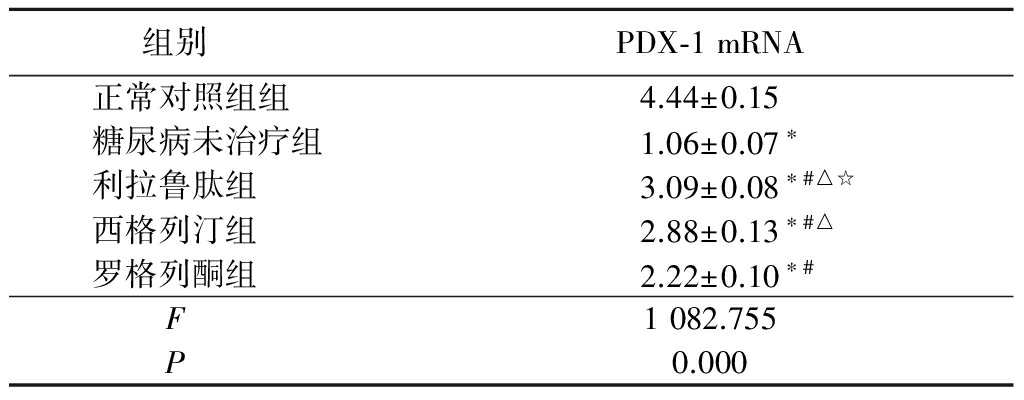
*P<0.05与正常对照组比较 #P<0.05与糖尿病未治疗组比较 △P<0.05与罗格列酮组比较 ☆P<0.05与西格列汀组比较(SNK-q检验)
人类PDX-1在出生及成年后呈特异性表达于90%的β细胞和少量的(10%)δ细胞。近年来,由于PDX-1基因在胰岛素分泌过程中不可缺少,PDX-1在胰腺发育、分化、再生及胰岛素分泌过程中的作用受到关注[1-3]。因此,越来越多的研究致力于利用PDX-1在β细胞分化发育中的关键作用,将胚胎干细胞、成体肝细胞或胰腺导管上皮细胞等非胰岛素分泌细胞诱导分化成为具有分泌胰岛素功能的细胞[4]。白立国等[5]发现PDX-1基因可促进人脂肪间充质干细胞分化为胰岛样细胞。但长期高血糖、脂代谢紊乱可以损伤PDX-1基因,使PDX-l表达下调,使胰岛素的分泌减少,导致β细胞功能逐渐衰退,进而加重糖脂代谢紊乱。本研究结果显示,糖尿病未治疗组大鼠空腹血糖较正常对照组明显增高,PDX-1 mRNA表达下降,胰腺组织HE染色显示胰岛细胞数量减少。表明糖毒性对T2DM大鼠胰岛β细胞具有损伤作用,导致胰岛β细胞数量减少,而T2DM大鼠胰腺PDX-1表达的减少,可能正是T2DM大鼠胰岛β细胞功能减弱的重要原因。
研究表明,利拉鲁肽及其类似物能够通过中枢神经系统和周围组织中的信号通路减缓胃肠道排空,抑制食欲,或改变饮食偏嗜,减轻体质量。本研究利拉鲁肽治疗后大鼠体质量较糖尿病未治疗组、西格列汀组及罗格列酮组均明显降低。吴嘉鸣等[6]亦发现利拉鲁肽可明显减轻2型糖尿病患者体质量指数,而西格列汀治疗前后大鼠体质量无明显变化。这与郭云飞等[7]研究结果显示DPP-4抑制剂总体上不增加体质量一致。
本研究利拉鲁肽、西格列汀及罗格列酮治疗后空腹血糖均较T2DM组明显降低(P<0.05),而利拉鲁肽较西格列汀、罗格列酮对空腹血糖下降的作用更为明显,西格列汀组空腹血糖与罗格列酮组差异无统计学意义。正如Yang等[8]的研究表明,高脂饮食联合脂联素基因敲除诱导INS抵抗小鼠模型,给予利拉鲁肽干预,可明显改善糖代谢及INS敏感性。还有研究表明,DPP-4抑制剂西格列汀可以通过提高GLP-1水平,降低胰高血糖素,降低肝脏及肠道内载TG脂蛋白的水平来影响TG水平以及改善血糖[9]。
本实验结果还显示,给予利拉鲁肽、西格列汀及罗格列酮治疗后,胰岛β细胞凋亡率均明显降低(P<0.05),胰岛β细胞数量增多,胰岛β细胞PDX-1 mRNA表达量均增高。表明这三类药物均可促进胰岛β细胞的再生,西格列汀与罗格列酮的差异并不显著,而利拉鲁肽更优一筹;而对于胰岛β细胞PDX-1基因的表达,利拉鲁肽亦更较西格列汀、罗格列酮显著。有文献报道,GLP-1类似物Exendin-4诱导的胰岛素分泌细胞和胰岛细胞在形态学上类似,在脂肪间充质干细胞的培养液中加入Exendin-4,PDX-1及胰岛素基因的表达明显增多,胰岛素阳性细胞的比例增加了4倍,胰岛素分泌量亦增加了2.5倍[10]。说明Exendin-4可通过增加PDX-1基因的表达来促进脂肪间充质干细胞向胰岛素分泌细胞转化。研究显示长期利拉鲁肽治疗可增加ZDF大鼠胰岛β细胞数量,促进胰岛素合成及分泌,并可减少α细胞数量[11]。此外,大量的研究均表明,利拉鲁肽可以通过影响自噬保护高血脂及高血糖诱导的胰岛β细胞凋亡,改善胰岛β细胞功能[12-13]。研究还发现,DPP-4抑制剂可增加β细胞分化和增殖,增强胰岛体系结构重塑并保持胰岛功能[14]。罗格列酮是过氧化物酶增殖物活化受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)的高亲和性配体,研究发现噻唑烷二酮类药物可通过激活PPARγ上调游离脂肪酸受体G蛋白偶联受体40(G-protein-coupled transmembrane receptor 40,GPR40)和GLUT2的表达,而GPR40活化可增加胰岛β细胞基因PDX-1和叉头框A2(forkhead box A2,FoxA2)的表达水平[15]。
综上所述,利拉鲁肽、西格列汀及罗格列酮均参与及调控了PDX-1基因的表达,促进了胰岛β细胞增殖,使胰岛β细胞凋亡减少。在降低T2DM大鼠空腹血糖、减轻体质量、增加胰岛β细胞PDX-1 mRNA表达方面,利拉鲁肽更优于西格列汀及罗格列酮。
[参考文献]
[1] 汪珊珊,陈明卫.PDX-1基因克隆载体的体外构建[J].山东医药,2016,56(4):31-33.
[2] 白国立,史光军.PDX-1基因提高脂肪间充质干细胞分化为胰岛分泌细胞能力的研究前景[J/CD].临床普外科电子杂志,2014,2(4):45-49.
[3] Fujimoto K,Kenneth S. Pdx1 and other factors that regulate pan-creatic β-cell survival[J]. Diabetes Obes Metab,2009,11(4):30-37.
[4] Semache M,Ghislain J,Zarrouki B,et al. Pancreat-ic and duodenal homeobox-1 nuclear localization is regu-lated by glucose in dispersed rat islets but not in insulin-secreting cell lines[J]. Islets,2014,6(4):982 376.
[5] 白国立,谭雪莹,史光军.PDX-1在人脂肪间充质干细胞分化为胰岛分泌细胞中的作用[J].山东医药,2016,56(25):17-19.
[6] 吴嘉鸣,唐宏霞,董陆玲,等.利拉鲁肽与预混胰岛素治疗2型糖尿病的效果比较[J].河北医科大学学报,2015,36(11):1311-1314.
[7] 郭云飞,卢清玉,韩萍,等.2型糖尿病患者应用西格列汀的抗动脉粥样硬化效应[J].临床荟萃,2016,31(9):975-982.
[8] Yang M,Zhang L,Wang C,et al. Liraglutide Increases FGF-21 Activity and Insulin Sensitivity in High Fat Diet and Adiponectin Knockdown Induced Insulin Resistance[J]. PLoS One,2012,7(11):e48392.
[9] Xiao C,Dash S,Morgantini C,et al. Sitagliptin,a dipeptidyl pepti-dase-4 inhibitor,acutely inhibits intestinal lipoprotein particle se-cretion in healthy humans[J]. Diabetes,2014,63(7):2394-2401.
[10] Khorsandi L,Saremy S,Khodadadi A,et al. Effects of Exendine-4 on The Differentiation of Insulin Producing Cells from Rat Adipose-Derived Mesenchymal Stem Cells[J]. Cell J,2016,17(4):720-729.
[11] Schwasinger-Schmidt T,Robbins DC,Williams SJ,et al. Long-term liraglutide treatment is associated with increased insulin content and secretion in β-cells,and a loss of α-cells in ZDF rats[J]. Pharmacological Research,2013,76:58-66.
[12] Wang J,Wu J,Wu H,et al. Liraglutide protects pan-creatic beta-cells against free fatty acids in vitro and affectsglucolipid metabolism in apolipoprotein E-/-mice by activa-ting autophagy[J]. Mol Med Rep,2015,12(3):4210-4218.
[13] Tamura K,Minami K,Kudo M,et al. Liraglutide im-proves pancreatic beta cell mass and function in alloxan-in-duced diabetic mice[J]. PLoS One,2015,10(5):e0126003.
[14] Zhang X,Wang Z,Huang Y,et al. Effects of chronic administration of alogliptin on the development of diabetes and beta-cell function in high fat diet/streptozotocin diabeticmice[J]. Diabetes Obes Metab,2011,13(4):337-347.
[15] Kim HS,Hwang YC,Koo SH,et al. PPAR-c Activation Increases Insulin Secretion through the Up-regulation of the Free Fatty Acid Receptor GPR40 in Pancreatic β-Cells[J]. PLoS One,2013,8(1):e50128.
ZHENG Kun-jie1,WU Ge2*,GENG Jian-lin1,WU Mei-fen2,FANG Shuo2
(1.DepartmentofEndocrinology,HarrisonInternationalPeaceHospitalofHengshuiCity,HebeiProvince,Hengshui053000,China; 2.DepartmentofEndocrinology,AffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang524001,China)
[Abstract]ObjectiveTo observe the role of different drugs on proliferation and regeneration of islet beta cells in type 2 diabetes mellitus(T2DM) rats.MethodsSprague-Dawley rats were randomly divided into normal control group, T2DM group,liraglutide group, sitagliptin group and rosiglitazone group,20 in each group.Normal control group was given normal diet and the other experimental groups were given high fat diet. After eight weeks,the high fat diet group was intraperitoneally injected with streptozotocin 30 mg/kg,and the liraglutide group, the sitagliptin group and the rosiglitazone group were treated for 4 successive weeks. The other groups were treated with normal saline by subcutaneous injection. The blood sample was collected before and after 4 weeks of treatment. Hematoxylin-eosin staining was used to observe the islet cell histology change. TdT-mediated dUTP nick end labeling was used to detect apoptosis of islet cells. Real-time fluorescent quantitative reverse transcription polymerase chain reaction was used to detect the expression of pancreatic duodenal homeobox-1(PDX-1) gene in rat pancreatic islet cells.ResultsAfter treatment, compared with the T2DM group and that before treatmemt, the level of fasting blood glucose in the liraglutide group,sitagliptin group and rosiglitazone group was distinctly lower(P<0.05), the structure and the number of islets were significantly better, the level of apoptosis rate was lower(P<0.05).ConclusionLiraglutide, sitagliptin and rosiglitazone could significantly improve the glucose. The effect of liraglutide on decreasing the body weight was better than that of rosiglitazone and Sitagliptin. Liraglutide, sitagliptin and rosiglitazone could significantly increse the number of pancreatic islet beta cells and decrease the islet cell apoptosis rate, the effect may be associated with an increased expression of PDX-1 gene, the effect of liraglutide was better than that of rosiglitazone and Sitagliptin.
[Key words]diabetes mellitus, type 2; apoptosis; rats
·论著·
[收稿日期]2016-10-11;
[修回日期]2016-10-23
[基金项目]广东省科技计划项目(2011B031800231)
[作者简介]郑坤杰(1986-)女,河北衡水人,哈励逊国际和平医院住院医师,医学硕士,从事内分泌疾病诊治研究。
*通讯作者。E-mail:wuge427427@126.com
[中图分类号]R587.1
[文献标志码]A
[文章编号]1007-3205(2017)11-1260-05
(本文编辑:刘斯静)