Table1ExpressionlevelofSurvivinandPCNAproteinonrenalcancercellline786-O
·论著·
徐芝立,张丽红,张 翼,梁长春,马志强
(河北省石家庄市第三医院泌尿外科,河北 石家庄 050011)
[摘要]目的探讨肾癌786-O细胞Survivin基因对肾癌增殖能力的影响。方法采用RNA干扰技术转染肾癌786-O细胞,靶向沉默Survivin基因表达,通过RT-PCR和Western blot实验检测沉默效率,并测定增殖细胞核抗原PCNA蛋白表达变化,通过MTS实验测定细胞增殖活性。结果干扰组Survivin mRNA、Survivin蛋白及PCNA蛋白表达水平明显低于对照组和空白组,差异均有统计学意义(P<0.05)。对照组与空白组Survivin mRNA、Survivin蛋白及PCNA蛋白相对表达量差异均无统计学意义(P>0.05)。3组786-O细胞增殖活力均呈升高趋势,干扰组786-O细胞增殖活力明显低于对照组和空白组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。结论RNA干扰Survivin基因能显著下调肾癌786-O细胞的Survivin基因表达,并降低细胞增殖活力,揭示出Survivin基因影响肾癌细胞恶性增殖的潜在分子机制。
[关键词]肾肿瘤;RNA干扰;细胞增殖
doi:10.3969/j.issn.1007-3205.2017.11.010
肾癌发病率逐年提高,是最常见的肾实质恶性肿瘤,占肾脏恶性肿瘤的80%~90%,约占成年人全身恶性肿瘤的3%,透明细胞癌是其主要的病理类型。 Survivin是凋亡抑制蛋白家族的重要成员,除了胸腺、睾丸、血管内皮细胞等组织之外几乎所有成熟分化组织中均不表达,而在胃癌、结肠癌等大多数恶性肿瘤中呈高表达[1-3]。Survivin是排名第五位的肿瘤特异性基因,具有抑制细胞凋亡、调控细胞增殖和促进肿瘤血管生成等作用,并与肿瘤不良预后、恶性增殖、高复发率以及治疗抵抗密切相关[4]。由于Survivin基因在人体癌组织与正常组织中的表达存在显著差异,使其成为肿瘤基因靶向治疗的理想靶点。本研究采用RNA干扰技术靶向沉默肾癌786-O细胞的Survivin基因表达,通过Western blot实验测定增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达,并通过MTS实验测定786-O细胞增殖变化情况,旨在进一步探讨Survivin基因表达对肾癌786-O细胞肾癌增殖能力的分子机制。现报告如下。
1.1 一般资料 人肾癌786-O细胞株由河北省肿瘤研究所冻存惠赠。以HuSH pGFP-V-RS为载体构建发夹结构Survivin沉默质粒,简称Survivin siRNA,空载体质粒中没有Survivin shRNA基因序列的嵌入,又称control siRNA,购自ORIGENE公司。美国Invitrogen公司设计合成cDNA引物:Survivin上游引物序列5′-CACCGCATCTCT-ACATTCAA-3′;下游引物序列5′-CACTTTCTTCGCAGTTTCCT-3′;扩增产物片段为345 bp。内参β-actin:上游引物5′-CCAAGGCC-AACCGCGAGAAGATGAC-3′;下游引物5′-AGGGTACATGGTGGTGCCGCCAGAC-3′;扩增片段为 587 bp。Survivin抗体、PCNA分子抗体均购自美国Abcam公司。第一链cDNA反转录合成试剂盒购自Thermo公司。
1.2 试验方法
1.2.1 细胞培养与转染 人肾癌细胞株786-O接种于含10%胎牛血清的RPMI 1640混合培养基中,收集对数生长期的细胞,分成Survivin siRNA/786-O组(干扰组)、control siRNA/786-O组(对照组)和non-siRNA/786-O组(空白组),按照Lipofectamine 2000转染试剂盒的要求进行转染实验,成功转染干扰或对照质粒的细胞均可以表达绿色荧光。
1.2.2 RT-PCR实验 分别取转染后48 h对数生长期的干扰组、对照组和空白组细胞裂解后,按照TriQuick总RNA提取试剂说明书提取总RNA,进行浓度、纯度及完整性检测。两步法进行RT-PCR反应。第一步:用Thermo公司的第一链cDNA反转录合成试剂盒进行从RNA到DNA的制备,细胞总RNA于42 ℃ 65 min、70 ℃ 5 min合成cDNA。第二步:将反应产物cDNA适度稀释后用于PCR扩增,反应条件为Survivin 95 ℃ 5 min、95 ℃ 1 min、58 ℃ 1 min、72 ℃ 90 s,30个循环;72 ℃ 5 min、4 ℃终止。β-actin:94 ℃ 5 min、94 ℃ 30 s、58 ℃ 30 s、72 ℃ 60 s,40个循环;72 ℃ 5 min、4 ℃终止。分别取各目的基因的PCR扩增产物于琼脂糖凝胶中电泳,紫外凝胶成像系统进行扫描,采用Gel-Pro Analyzer 3.1分析软件检测条带灰度值,mRNA表达相对值=目的片段灰度值/GAPDH灰度值。
1.2.3 Western Blot实验 取转染后48 h对数生长期的干扰组、对照组和空白组细胞裂解,提取总蛋白,定量。适量蛋白样品加入SDA-PAGE凝胶中电泳分离蛋白分子,转膜,滴加一抗,4 ℃过夜,滴加二抗,孵育,洗涤,Odyssey双色红外荧光扫描系统分析结果。
1.2.4 MTS实验 将各组对数生长期细胞分别接种在96孔板中。每个样本组按0、24、48、72 h 4个检测时点分别设置4个复孔,每孔接种1.0×104个细胞。每组单独另设3个无细胞对照复孔,检测背景吸光度光密度(optical density,OD)值。在预设检测时点加入MTS溶液(5 g/L) 20 μL继续培养4 h,终止。在酶联免疫检测仪上490 nm波长测定各孔OD值,并减去无细胞对照复孔所代表的背景OD值作为A值,取相同检测时点及转染相同重组慢病毒的A值均值作为该组细胞某天的A值,绘制增殖曲线进行比较。
1.3 统计学方法 应用SPSS 19.0统计学软件分析数据。计量资料比较分别采用F检验、q检验和重复测量的方差分析。P<0.05为差异有统计学意义。
2.1 细胞转染效果 荧光显微镜下可以观察到成功转染干扰质粒载体的Survivin siRNA/786-O细胞、control siRNA/786-O细胞均表达绿色荧光。
2.2 3组肾癌786-O细胞Survivin mRNA、Survivin蛋白及PCNA蛋白表达水平比较 干扰组Survivin mRNA、Survivin蛋白及PCNA蛋白表达水平明显低于对照组和空白组,差异有统计学意义(P<0.05)。对照组与空白组Survivin mRNA、Survivin蛋白及PCNA蛋白相对表达量差异无统计学意义(P>0.05)。见表1。
表1 3组肾癌786-O细胞SurvivinmRNA、蛋白及PCNA蛋白表达水平比较
Table1ExpressionlevelofSurvivinandPCNAproteinonrenalcancercellline786-O![]()
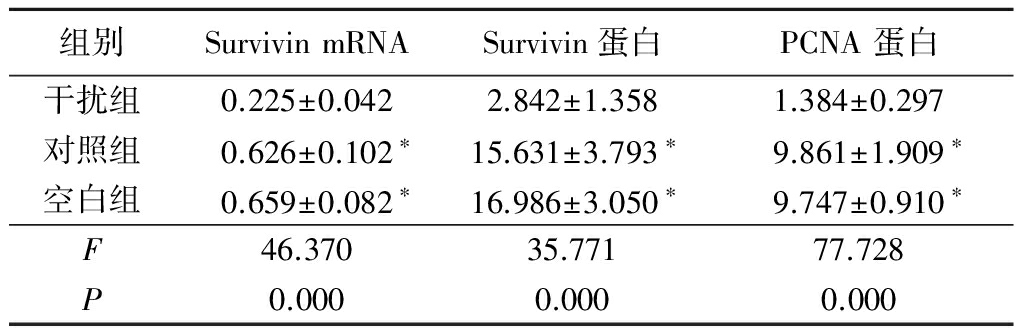
*P<0.05与干扰组比较(q检验)
2.3 3组肾癌786-O细胞增殖水平比较 3组786-O细胞增殖活力均呈升高趋势,但干扰组786-O细胞增殖活力均明显低于对照组和空白组,其组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表2。
表2 3组肾癌786-O细胞增殖活力水平比较
Table2Proliferationactivityofrenalcancercellline786-O![]() 值)
值)
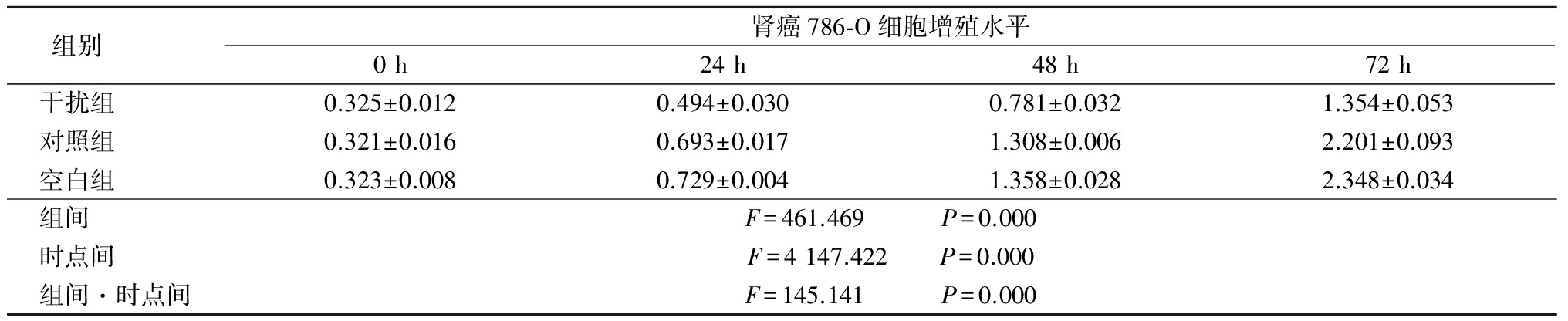
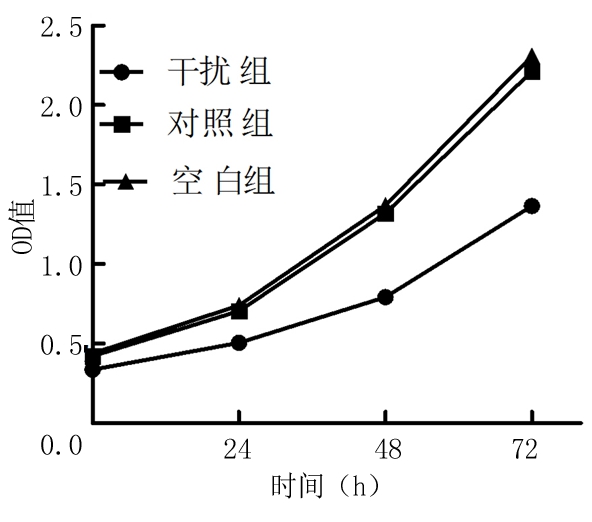
图1不同分组786-O细胞增殖曲线
Figue1Proliferationcurveofdifferent786-Ocellgroups
许多原癌基因的激活和抑癌基因的失活参与了众多恶性肿瘤的发生发展过程。肾癌是严重危害人类健康的肾脏最常见恶性肿瘤,约占成年人全身恶性肿瘤的3%,多属天然耐药,放化疗均不敏感,基因靶向治疗为中晚期肾癌的治疗提供了新途径。
Survivin基因位于人类染色体17q25,片段长14.7 kb,是编码142个氨基酸组成的蛋白,相对分子质量约16 500,含有IAP序列,可直接抑制凋亡酶的活性,由效应细胞蛋白酶受体1在人类基因组库中杂交筛选而分离出来,是迄今发现的最强的凋亡抑制因子[5-6]。基础研究发现,Survivin基因在胚胎组织及大多数肿瘤细胞中广泛表达,而在成熟分化的终末组织中不表达,不仅可以抑制细胞凋亡,而且在调控细胞增殖机制中发挥重要作用[4]。在肿瘤细胞中,Survivin通过与纺锤体微管蛋白特异性结合形成染色体乘客络合体,稳定微管结构,避免纺锤体被水解,保护有丝分裂细胞器的完整型,有利于有丝分裂持续进行,促进肿瘤细胞不断增殖[6]。临床研究发现,Survivin显著表达于前列腺癌[5]、膀胱癌[7]、胰腺癌[8]、卵巢癌[9]、肺小细胞癌[10]等多种恶性肿瘤中,与患者的肿瘤恶性进展、不良预后密切相关。
RNA干扰技术是通过小干扰RNA特异性降解靶基因mRNA,引起基因转录后沉默的现象,具有高效性和序列特异性的优点,是新的基因阻断研究方法。国内学者牛朝霞等[11]利用RNA干扰技术成功靶向沉默Survivin基因表达,并检测到基质金属蛋白酶表达下调,进而抑制了食管癌Eca-109细胞的侵袭与迁移,在食管癌模型上验证了RNA干扰技术靶向沉默Survivin基因的有效性。本研究尝试通过携带干扰RNA的质粒转染肾癌786-O细胞,结果显示干扰组Survivin mRNA及蛋白表达水平明显降低,表明Survivin基因表达成功被沉默;绘制了786-O细胞增殖曲线,3组786-O细胞增殖活力均呈升高趋势,干扰组786-O细胞的增殖活力均明显低于对照组和空白组,其组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),提示干扰Survivin基因可以抑制肿瘤细胞的恶性增殖。
PCNA分子是由261个氨基酸组成的核内蛋白质分子,参与DNA多聚酶的活性作用,近年来被广泛用于恶性肿瘤及某些良性增生性疾病的研究中[12]。在细胞分裂静止期(G0)表达量较低,在S期表达为高峰,在G2/M期明显降低,参与调控细胞周期与凋亡等细胞功能,与肿瘤细胞的恶性增殖、进展密切相关,增殖细胞核抗原PCNA仅在增殖状态的细胞内出现,提示DNA复制程度增加,是存在于细胞核内的反映细胞增殖状态的核蛋白之一。在肿瘤细胞中,Survivin基因高表达可以促进细胞由G1期向S期转换,在G2/M期可见Survivin表达明显升高[13]。据此推测Survivin基因可能通过调控PCNA蛋白表达或与PCNA蛋白协同参与了肾癌细胞的增殖过程。国内学者李书燕等[12]发现,Survivin和PCNA在子宫内膜异位症患者的组织中表达明显增高。推测在子宫内膜异位生长过程中Survivin保护内膜细胞不会凋亡,而PCNA保持内膜细胞的增殖能力,在一定程度上显示了Survivin和PCNA对细胞增殖的协同促进作用。本研究结果显示干扰组786-O细胞中PCNA蛋白表达水平明显降低,表明干扰Survivin基因表达可以引起PCNA蛋白表达量下降;这与MTS实验结果相印证,也显示了Survivin基因影响肾癌细胞增殖的潜在分子机制。
Survivin基因在人体正常分化的组织中不表达或低表达,在肿瘤细胞中高表达的显著差异,提示Survivin既有助于判断肿瘤预后,还可作为肿瘤靶向治疗的理想靶点。靶向Survivin的基因治疗或免疫治疗能够准确定位于肿瘤组织,有效破坏肿瘤细胞的某些功能活动,而不会对人体正常细胞造成损伤[6]。因此,针对Survivin基因的分子机制研究和靶向治疗策略已经成为肿瘤防治的焦点领域。Seo等[14]将Survivin启动子基因与AD5/AD35嵌合型病毒基因相融合,通过病毒不断复制,可以特异性破坏高表达Survivin基因的膀胱癌细胞,并在小鼠模型上进行了验证,该方法不良反应小,对膀胱癌有高效杀伤作用。Xia等[15]在对人类肝癌的研究中发现,应用Survivin的小分子抑制剂YM155可以下调Survivin基因转录水平,造成DNA损伤,激活Caspase-3,表现出抑制细胞增殖与凋亡等抗肿瘤作用。还有学者发现Survivin分子是子宫内膜癌患者独立的预后预测因子,并确认了YM155对子宫内膜癌细胞系的抗增殖和促凋亡作用[16]。此外,在胃癌移植瘤模型中,应用Survivin显性负性突变体C84A,可以抑制胃癌瘤体生长,并可增强5氟尿嘧啶对胃癌细胞的化疗效果[17]。表明下调Survivin表达能阻抑肿瘤的发生、恶性发展,Survivin作为肿瘤抗原基因具有应用于肿瘤基因治疗的巨大潜力。
目前,在针对Survivin分子的免疫治疗中,Survivin蛋白作为肿瘤相关抗原,可以在动物体内利用其免疫原性诱导产生抗Survivin的免疫应答。国外学者已经尝试在临床Ⅰ/Ⅱ试验中应用Survivin多肽分子进行免疫接种,增加肿瘤患者体内CD8+T细胞对癌细胞的特异性免疫反应,但机体不良反应很小;而Survivin多肽疫苗也已经处于Ⅱ期临床试验中,该疫苗可以在难治性黑色素瘤患者中诱导抗Survivin的T细胞数量增加,显著降低了复发率,提高了肿瘤患者的总生存率[18]。提示了Survivin分子作为肿瘤相关抗原应用于肿瘤基因免疫治疗中的巨大潜力。
本研究通过RNA干扰技术构建Survivin基因沉默表达的肾癌786-O细胞,检测到增殖细胞核抗原PCNA蛋白表达出现下调,而且细胞增殖活力明显降低,为将Survivin开发为基因治疗靶分子的应用研究提供了初步的实验依据。后续工作尚需要深入研究Survivin基因影响肾癌细胞恶性增殖的分子通路并通过动物模型加以验证,为将Survivin开发成国内临床可用的基因治疗标靶提供实验依据。
[参考文献]
[1] Sun B,Xu H,Zhang G,et al. Basic fibroblast growth factor upregulates survivin expression in hepatocellular carcinoma cells via aprotein kinase B-dependent pathway[J]. Oncol Rep,2013,30(1):385-390.
[2] 王伟宁,徐赛群,刘丽,等.SSTR2、Livin和Survivin在结肠癌组织中的表达及其意义[J].中国现代医学杂志,2017,27(10):52-56.
[3] 张小玲,田志逢,王萍,等.KLF5和Survivin蛋白异常表达与胃癌预后的关系[J].临床与实验病理学杂志,2016,32(2):142-145.
[4] Khan Z,Khan AA,Yadav H,et al. Survivin,a molecular target for therapeutic interventions in squamous cell carcinoma[J]. Cell Mol Biol Lett,2017,22:8.
[5] 肖邦明,祝兴旺,董理鸣,等.SRSF1和Survivin在前列腺癌组织中的表达及其与病理分级的相关性[J].中国医科大学学报,2016,45(5):452-455.
[6] 殷海森,赵新颖,苏长青.以Survivin为靶标的肿瘤治疗策略[J].第二军医大学学报,2016,37(3):342-348.
[7] Jeon C,Kim M,Kwak C,et al. Prognostic role of survivin in bladder cancer:asystematic review and meta-analysis[J]. PLoS One,2013,8(10):e76719.
[8] Ekeblad S,Lejonklou MH,Stalberg P,et al. Prognostic relevance of survivin in pancreatic endocrine tumors[J]. World J Surg,2012,36(6):1411-1418.
[9] 申薇,梁冰锋,李秀荣,等.凋亡途径蛋白XIAP、Caspase-3和Survivin在上皮性卵巢癌中的表达及相互关系[J].河北医科大学学报,2013,34(12):1561-1564.
[10] Zhang LQ,Wang J,Jiang F,et al. Prognostic value of survivin inpatients with non-small cell lung carcinoma:a systematic reviewwith meta-analysis[J]. PLoS One,2012,7(3):e34100.
[11] 牛朝霞,张秀芝,陈洁,等.Survivin基因沉默抑制食管癌Eca-109细胞的侵袭与迁移[J].安徽医科大学学报,2016,51(2):185-189.
[12] 李书艳,冯卫群.Survivin、PCNA在子宫内膜异位症组织中的表达及其意义[J].河北医科大学学报,2013,34(1):18-20.
[13] Wheatley SP. The functional repertoire of survivin′s tails[J]. Cell Cycle,2015,14(2):261-268.
[14] Seo HK,Seo JB,Nam JK,et al. Development of replication-competent adenovirus for bladder cancer by controlling adenovirus E1a and E4 gene expression with the survivin promoter[J]. Oncotarget,2014,5(14):5615-5623.
[15] Xia H,Chen J,Shi M,et al. The over-expression of survivin enhances the chemotherapeutic efficacy of YM155 in human hepatocellular carcinoma[J]. Oncotarget,2015,6(8):5990-6000.
[16] Chuwa AH,Sone K,Oda K,et al. Significance of survivin as a prognostic factor and a therapeutic target in endometrial cancer[J]. Gynecol Oncol,2016,141(3):564-569.
[17] Weng Y,Fei B,Chi AL,et al. Inhibition of gastric cancer cell growth in vivo by overexpression of adeno-associated virus-mediated survivin mutant C84A[J]. Oncol Res,2013,20(9):411-417.
[18] Altieri DC. Targeting survivin in cancer[J]. Cancer Lett,2013,332(2):225-228.
XU Zhi-li,ZHANG Li-hong,ZHANG Yi,LIANG Chang-chun,MA Zhi-qiang
(DepartmentofUrology,theThirdHospitalofShijiazhuangCity,HebeiProvince,Shijiazhuang050011,China)
[Abstract]ObjectiveTo investigate the effect of Survivin gene expression on human renal carcinoma cell 786-O proliferation.MethodsRNA inteference was used to transfect human renal cancer cell line 786-O and silence Survivin gene expression. Expression of Survivin mRNA and protein were detected by reverse transcription-polymerase chain reaction(RT-PCR) and Western blot assay, respectively. Change of PCNA protein expression was measured meanwhile. The proliferation of 786-O cells was evaluated by MTS assay.ResultsCompared to control siRNA/786-O and non-siRNA/786-O, Survivin siRNA/786-O displayed reduced Survivin expression of mRNA and protein(P<0.05). Expression level of PCNA protein was also down-regulated significantly in Survivin siRNA/786-O cells(P<0.05). No significant differences of Survivin mRNA, Survivin protein and PCNA protein were found between control siRNA/786-O and non-siRNA/786-O(P>0.05). Proliferation activity of all three groups of 786-O cells showed increasing trend obviously. The level of siRNA/786-O cells proliferation was significantly lower than other groups. There were statistically significant differences between groups, at different time point, also analysis of interaction between groups with time point revealed statistical significance(P<0.05).ConclusionRNA interference of Survivin gene can down-regulate expression of Survivin mRNA, Survivin protein and PCNA protein expression with decreasing the proliferation activity of cells. The present study revealed underlying influence of Survivin gene expression on malignant proliferation of renal cancer.
[Key words]kidney neoplasms; RNA interference; cell proliferation
[收稿日期]2017-08-08;
[修回日期]2017-09-11
[基金项目]石家庄市科学技术研究与发展指导计划(131462333)
[作者简介]徐芝立(1980-),男,河北深州人,河北省石家庄市第三医院主治医师,医学硕士,从事泌尿外科疾病诊治研究。
[中图分类号]R737.11
[文献标志码]A
[文章编号]1007-3205(2017)11-1283-05
(本文编辑:赵丽洁)