表1 2组治疗效果比较
Table1Comparisonoftreatmenteffectbetweentwogroups(n=65,例数,%)
·论著·
石境懿,夏 利,张 衡,朱书瑶
(四川省妇幼保健院新生儿科,四川 成都 610032)
[摘要]目的探讨重组人促红细胞生成素(recombinant human erythropoietin,rhu-EPO)辅助治疗对新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopath,HIE)氧化应激损伤及半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic protease-3,Caspase-3)、内源性激活素A(endogenous activin A,ACT A)的影响。方法将130例HIE患者随机分为A组(rhu-EPO辅助常规治疗)与B组(常规治疗)各65例,并选择65例同期健康新生儿纳入C组,比较A组与B组在治疗效果、不良反应率差异及3组在治疗当天、治疗1周、治疗4周时超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、Caspase-3、ACT A、新生儿神经行为测定(neonatal behavioral neurological assessment,NBNA)的差异。结果A组疗效(92.3%)高于B组(70.7%),差异有统计学意义(P<0.05)。不同时间点C组SOD、MDA、Caspase-3、ACT A水平无显著变化,而A、B组SOD水平显著增高,3组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05);A、B组ACT A水平逐渐增高,且B组高于A、C组,3组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05);A、B组Caspase-3呈先升高后降低的趋势,3组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05);A、B组MDA水平逐渐下降,3组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05);A、B组NBNA评分逐渐升高,3组在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05)。A组不良反应发生率(7.7%)低于B组(30.8%),差异有统计学意义(P<0.05)。结论Capspase-3及ACT A均参与HIE病理生理过程,且通过rhu-EPO辅助治疗HIE,有利于降低该病氧化应激损伤及Caspase-3、ACT A水平。
[关键词]缺氧缺血,脑;重组人促红细胞生成素;婴儿,新生
doi:10.3969/j.issn.1007-3205.2017.11.013
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)是我国新生儿中致残率及病死率较高的神经系统疾病之一,其发病机制与围产期新生儿窒息及缺氧引起的氧化应激损伤直接相关[1]。随着对HIE发病机制的深入研究发现,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)可降低氧化应激损伤[2];半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic protease-3,Caspase-3)、内源性激活素A(endogenous activin A,ACT A)又在一定程度上与氧化应激的损伤程度具有相关性[3-4],调控以上因素的表达水平或许对降低或抑制氧化应激损伤具有一定作用。目前,通过重组人促红细胞生成素(recombinant human erythropoietin, rhu-EPO)来增加成熟红细胞数量,进而提高氧气传输总量,改善脑组织缺血、缺氧症状已获得初步共识[5]。但对rhu-EPO是否有利于降低氧化应激损伤的报道相对较少。本研究通过随机对照实验,探讨rhu-EPO对HIE治疗效果的同时,并对其是否调节氧化应激损伤的作用进行初步分析,现报告如下。
1.1 一般资料 选择2013年2月—2015年5月在我院就诊且符合纳入标准的新生儿HIE 130例,按随机数字表法分为A组65例,男性48例、女性17例,胎龄(39.6±1.4)周,出生体质量(3 338±432) g,HIE分级中度39例,重度26例;B组65例,男性45例、女性20例,胎龄(39.8±1.3)周,出生体质量(3 353±419) g,HIE分级中度40例、重度25例。并选择同期正常自然分娩的健康新生儿65例为C组,男性46例、女性19例,胎龄(39.8±1.1)周,体质量(3 353±429) g。3组性别构成、胎龄、出生体质量差异均无统计学意义(P>0.05),A组与B组HIE评估分级差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准,患者家属或监护人知情并签署知情同意书。
1.2 纳入标准 ①病例符合HIE诊断标准[6];②入院日龄<72 h;③体质量≥2 500 g且胎龄≥37周。排除标准:①合并严重先天性异常;②存在头部产伤或颅内出血;③病例脱落者。
1.3 治疗方法 2组均给予相同的常规治疗,如给予常规神经营养药物及降颅压药物,维持正常血压、动脉血气及酸碱平衡等。在此基础上,A组给予rhEPO(华北制药集团有限责任公司,批号S20001304)辅助治疗。首次皮下注射,后改为静脉滴注。每次剂量300 U/kg,3次/周,以4周1个疗程,连续治疗3个疗程。
1.4 评估标准
1.4.1 治疗效果评价 在患儿治疗1个疗程后,由专业医师对患儿神经系统症状进行评估。显效:患儿原始反射和肌张力等症状恢复正常,无抽搐症状;有效:患儿原始反射和肌张力等症状有所改善但未达到正常水平;无效:以上指标无改善或加重。治疗有效率=(显效例数+有效例数)/总例数×100%。
1.4.2 实验室指标 A、B组以治疗为起点,C组以出生为起点,分别采集3组在治疗当天、治疗1周及治疗1个疗程3个时间点的外周静脉血5~7 mL,室温30 min,离心3 000 r/min 10 min,缓慢吸取血清,采用酶联免疫吸附测定检测血清中Caspase-3及、内源性激活素A(endogenous activin A,ACT A)的水平,试剂盒购自上海西唐生物科技有限公司。采用黄嘌呤氧化酶法检测SOD水平,采用硫代巴比妥法测定MDA水平,试剂盒购自南京建成生物工程所。操作步骤严格按照试剂盒说明书进行。
1.4.3 新生儿神经行为测定(neonatal behavioral neurological assessment,NBNA)评分[7]3组新生儿出生后1、2、4周及疗程结束时,由专业医师对其进行NBNA评测。该评分总分40分,评分越高,提示新生儿越健康。
1.4.4 不良反应及预后 记录A、B组在治疗结束至随访1年中发生发育迟缓、脑瘫、智障、癫痫及死亡情况。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。等级资料比较采用秩和检验;计量资料比较采用重复测量的方差分析。P<0.05为差异有统计学意义。
2.1 2组疗效比较 治疗1疗程后,A组共60例(92.3%)治疗有效,B组共46例(70.7%)治疗有效,A组疗效优于B组(U=3.242,P=0.001),见表1。
表1 2组治疗效果比较
Table1Comparisonoftreatmenteffectbetweentwogroups(n=65,例数,%)

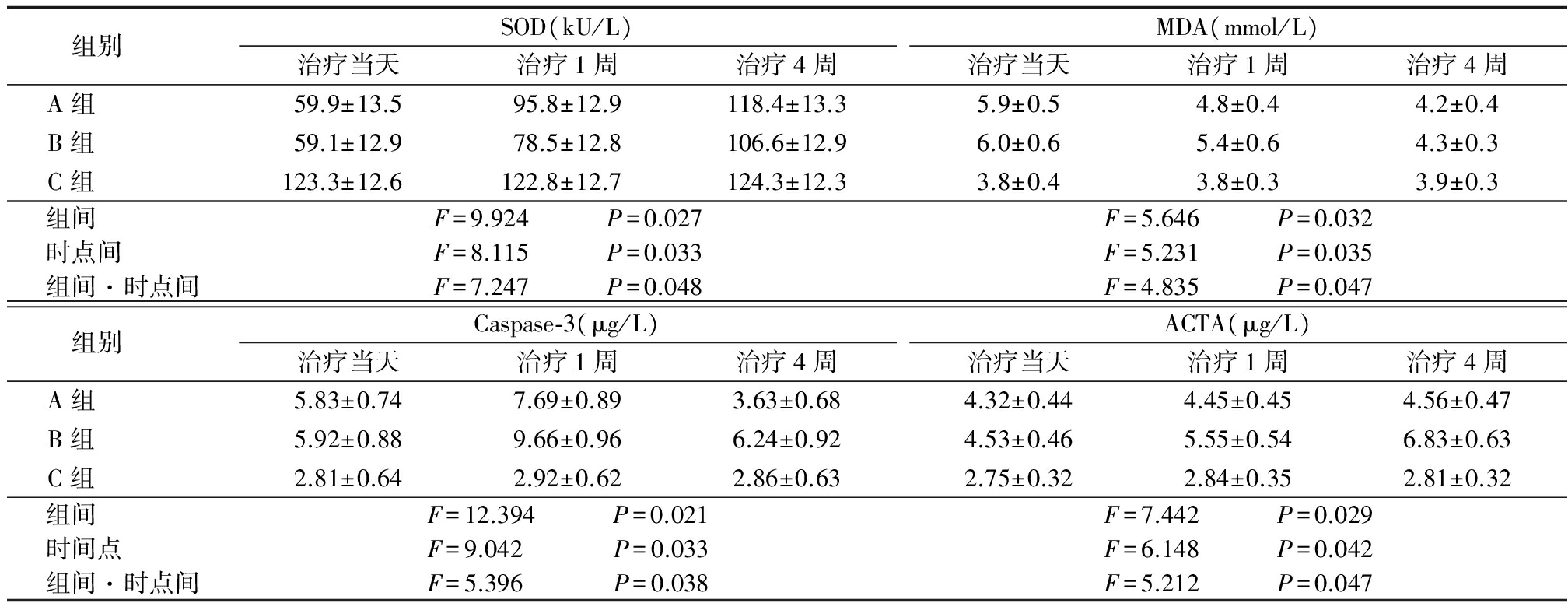
2.2 3组SOD 、MDA、Caspase-3和ACT A比较 A组和B组SOD、ACT A均呈逐渐升高趋势,而C组较平稳;A组和B组MDA均呈逐渐降低趋势,C组较平稳;A组和B组Caspase-3呈先升高后降低的趋势,C组较平稳。3组上述指标在组间、时点间以及组间·时点间交互作用差异均有统计学意义(P<0.05)。见表2。
表2 3组SOD、MDA、Caspase-3和ACTA比较
Table2ComparisonofSOD,MDA、Caspase-3andACTAamongthreegroups![]()
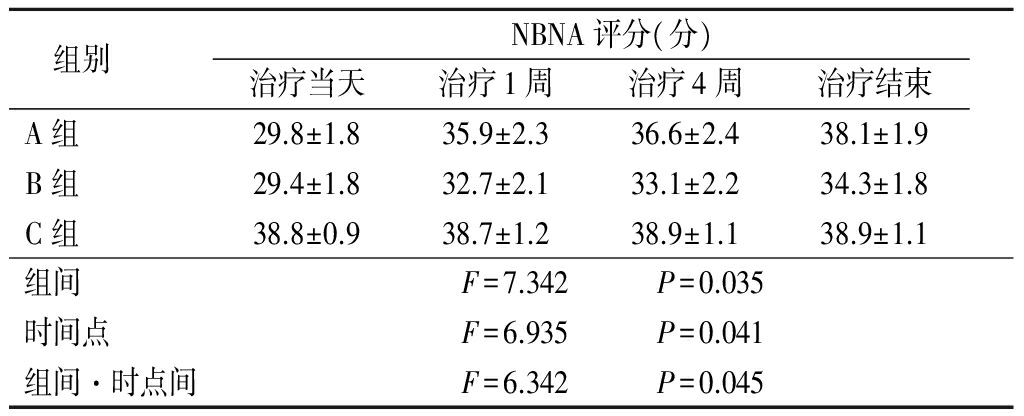
2.3 3组NBNA评分比较 治疗当天A组和B组NBNA评分均较低,但治疗后A组和B组的NBNA评分逐渐升高,特别是A组,到治疗结束时与C组基本无差别,3组在组间、时点间以及组间组间·时点间交互作用差异均有统计学意义(P<0.05),见表3。
表3 3组NBNA评分比较
Table3ComparisonofNBNAscoreamongthreegroups![]()
2.4 不良反应 随访期间,A组共5例出现不良症状,其中癫痫2例、智障2例、脑瘫1例;B组共20例出现不良症状,其中癫痫8例、智障8例、脑瘫1例、发育迟缓3例。B组不良症状发生率高于A组(χ2=11.144,P=0.025)。
促红细胞生成素(erythropoietin,EPO)是来源于肾脏的一种糖蛋白,具有较强的促前体红细胞增殖与分化的作用。最初EPO广泛应用于早产儿贫血防治及慢性肾性贫血中。但随着EPO临床应用的增多及对HIE致病机制的研究,越来越多的数据显示,EPO不仅具有促进造血祖细胞增殖及分化的作用,还可对因缺血缺氧造成的大脑损伤起到一定保护作用。Juul 等[8]研究表明,EPO可以通过抑制神经细胞凋亡、减轻炎症反应、减少NO产生及诱导血管生成等途径来保护神经系统。但Juul的研究是以动物模型为研究对象,EPO的作用机制是否可以完全照搬到临床应用,仍有待进一步确认。近年来研究发现,HIE的发病机制除了缺血缺氧所导致的氧化应激损伤外[9],还可能与神经细胞凋亡、过激的炎症反应、兴奋性氨基酸毒性、自由基及NO大量产生具有相关性[10]。因此,与以上相关蛋白的研究也逐渐成为当下研究及治疗HIE的热点。了解HIE患儿以上蛋白表达变化情况,将有助于更深入及准确了解rhu-EPO的临床作用效果。
作为体内主要的氧自由基清除酶,SOD含量高低与人体氧自由基清除能力呈正相关性。研究证实,低氧会导致细胞内氧自由基表达增加,而窒息则会导致机体处于低氧环境,进而导致体内氧自由基水平升高,而高水平的氧自由基又是引发氧化应激损伤的重要物质之一[11]。此外,氧化应激反应后随之可发生细胞膜脂质化过氧反应。而MDA即使脂质化过氧反应的最终产物,换言之,氧化应激损伤越重,发生脂质化过氧反应也越多,产生的MDA也随之增加。本研究结果显示,在治疗前,A、B组SOD水平低于C组而MDA水平均高于C组,提示此时患儿体内氧自由基水平较高,且已发生大量氧化应激损伤;而随着治疗的进行,A、B组SOD水平逐渐增高,而MDA水平则逐渐下降,在治疗1个疗程后,基本与健康组持平;在治疗1周时,A组改善效果要优于B组。可见给予rhu-EPO对较快降低氧化应激的损伤水平具有一定帮助。
另外,关于Casapse-3与细胞凋亡的已有大量相关报道[12]。目前认为,Caspase-3不仅在凋亡途径中发挥作用,而且还可被激活,诱发正常细胞凋亡。ACT A则是近年来较受关注的β超转化生长因子家族中一种细胞因子。有研究显示,当神经系统受到损失时可反向调节ACT A高表达来保护神经胶质瘤细胞及髓鞘的形成[4],而这种作用在早期神经系统发育阶段尤为突出。此外,ACT A可促进炎症细胞富集及促炎症因子表达,故抑制ACT A表达对抗炎具有一定作用[13]。本研究结果显示,治疗当天A组和B组Caspase-3及ACT A血清水平均高于健康组,随后A、B组Caspase-3均呈现先上升后下降趋势,其中A组上升幅度小于B组,且较快恢复至正常水平;与此同时,B组ACT A水平较快升高,而A组ACT A水平则未明显增加。推测:由于从细胞凋亡到细胞恢复正常需要一定周期,故在Caspase-3的表达水平变化上略显滞后;而ACT A作为细胞释放的细胞因子,一旦细胞状态改善,可直接影响表达水平。但2组经治疗后,A组ACT A水平未明显上升,而B组则逐渐呈现上升趋势。这与rhu-EPO的作用机制可能存在一定相关性。正是由于rhu-EPO对内皮细胞及胶质细胞的促恢复作用,从而反馈性下调了ACT A[14]。若仅依据A、B、C组SOD、MDA、Caspase-3、ACT A表达水平,A组治疗效果可能优于B组,而该推测与统计的治疗效果完全符合。此外,通过不同时期NBNA评分结果也进一步证实了rhu-EPO对辅助治疗HIE具有明显促进作用。另外,在不良反应发生率比较中,A组发生率明显少于B组。
综上所述,rhu-EPO辅助治疗HIE,有助于提高机体SOD水平,减少氧化应激损伤,并下调Caspase-3及ACTA水平,从而获得较高疗效。但本研究纳入病例数较少,且随访时间偏短,若要获得更为可信的结论,后续还需进行大样本、长期随访的随机对照试验。
[参考文献]
[1] Tataranno ML,Perrone S,Buonocore G. Plasma biomarkers of oxidative stress in neonatal brain injury[J]. Clin Perinatol,2015,42(3):529-539.
[2] 李玉飞,鹿玲. 过敏性紫癜患儿血浆髓过氧化物酶、丙二醛、超氧化物歧化酶及总抗氧化能力水平变化[J].临床儿科杂志,2015,33(4):357-360.
[3] Hagar H,Al Malki W. Betaine supplementation protects against renal injury induced by cadmium intoxication in rats:role of oxidative stress and caspase-3[J]. Environ Toxicol Pharmacol,2014,37(2):803-811.
[4] Brackmann FA,Alzheimer C,Trollmann R. Activin A in perinatal brain injury[J]. Neuropediatrics,2015,46(2):82-87.
[5] 钟洪飞.重组人促红细胞生成素治疗新生儿缺氧缺血性脑病临床意义[J].中国现代药物应用,2014,8(24):4-5.
[6] 季丽华.早产儿缺氧缺血性脑病诊断标准探讨[J].心血管病防治知识,2014,13(4):159-160.
[7] 史俊霞,曾国章.20项新生儿行为神经测定应用研究[J].中国儿童保健杂志,2008,16(5):620.
[8] Juul SE,Pet GC. Erythropoietin and neonatal neuroprotection[J]. Clin Perinatol,2015,42(3):469-481.
[9] Chalak LF,S nchez PJ,Adams-Huet B,et al. Biomarkers for severity of neonatal hypoxic-ischemic encephalopathy and outcomes in newborns receiving hypothermia therapy[J]. J Pediatr,2014,164(3):468-474.
nchez PJ,Adams-Huet B,et al. Biomarkers for severity of neonatal hypoxic-ischemic encephalopathy and outcomes in newborns receiving hypothermia therapy[J]. J Pediatr,2014,164(3):468-474.
[10] 郭映辉,李贵霞,李文辉,等. 新生儿缺氧缺血性脑病血清白细胞介素 18 水平动态研究[J].河北医科大学学报,2014,35(11):1337-1337.
[11] Tsang CK,Liu Y,Thomas J,et al. Superoxide dismutase 1 acts as a nuclear transcription factor to regulate oxidative stress resistance[J]. Nature Communications,2014,5(3):3446.
[12] 郭映辉,李梅,刘新光,等.动态监测血清 caspase-3和NSE在新生儿缺氧缺血性脑病诊治中的价值[J].河北医科大学学报,2016,37(9):1069-1072.
[13] Zhao M,Zhu P,Fujino M,et al. Oxidative stress in hypoxic-ischemic encephalopathy:molecular mechanisms and therapeutic strategies[J]. Int J Mol Sci,2016,17(12):E2078.
[14] Liu F,McCullough LD. Inflammatory responses in hypoxic ischemic encephalopathy[J]. Acta Pharmacol Sin,2013,34(9):1121-1130.
SHI Jing-yi, XIA Li, ZHANG Heng, ZHU Shu-yao
(DepartmentofNeonatology,SichuanMaternalandChildHealthCareHospital,Chengdu610032,China)
[Abstract]ObjectiveTo investigate the effects of rhu-EPO on hypoxic-ischemic encephalopath(HIE) oxidative stress injury and Caspase-3,endogenous activin A(ACT A).MethodsOne hundred and thirty patients with HIE were randomly assigned to group A(rhu-EPO adjuvant therapy) and group B(conventional therapy), 65 patients in each group. And 65 cases of healthy newborns were choosen into the group C in order to compare the treatment effect, adverse rate of difference and the differences of superoxide dismutase(SOD), malondialdehyde(MDA), Caspase-3, ACT A and neonatal behavioral neurological assessment(NBNA) observed on the day of treatment, 1 week of treatment and 4 weeks of treatment between group A and B.ResultsGroup A efficiency(92.3%) was higher than group B(70.7%), the difference was statistically significant(P<0.05); The levels of SOD, MDA, Caspase-3 and ACT A in group C were not significantly changed in the different time points, while the levels of SOD in group A and group B were significantly higher, there was significant difference in the inter-group, inter-point, and inter-group/hour-time interactions among the three groups(P<0.05). The levels of ACT A in group A and B were increased gradually, there was significant difference in the inter-group, inter-point, and inter-group/hour-time interactions between the three groups(P<0.05). The levels of Caspase-3 in group A and B were increased first and then decreased, there was significant difference in the inter-group, inter-point, and inter-group/hour-time interactions between the three groups(P<0.05). The level of MDA in group A and B were decreased gradually, in the inter-group, inter-point, and inter-group/hour-time interactions between the three groups(P<0.05). The NBNA scores of group A and B were gradually increased, there was significant difference in the inter-group, inter-point, and inter-group/hour-time interactions between the three groups(P<0.05). The incidence of adverse reactions in A group(7.7%) were lower than the B group(30.8%), the difference was statistically significant.ConclusionCapspase-3 and ACT A are involved in the pathophysiological process of HIE, and rhu-EPO is used to treat HIE, which is beneficial to reduce the oxidative stress injury and levels of Caspase-3 and ACT A.
[Key words]hypoxia-ischemia, brain; recombinant human erythropoietin; infant, newborn
[收稿日期]2017-03-21;
[修回日期]2017-04-05
[作者简介]石境懿(1982-),女,四川成都人,四川省妇幼保健院主治医师,医学学士,从事新生儿常见疾病诊治研究。
[中图分类号]R743
[文献标志码]A
[文章编号]1007-3205(2017)11-1295-05
(本文编辑:许卓文)