·论著·
刘绍伟,王 洋,田喜凤
(华北理工大学基础医学院病原生物学与免疫学系,河北 唐山 063210)
[摘要]目的构建C2株蓝氏贾第鞭毛虫cDNA文库。方法Trizol对C2株贾第虫滋养体RNA进行提取,逆转录获得cDNA单链,LD-PCR扩增获得ds cDNA,经纯化后,与pGADT7-Rec共转化酵母株Y187中。通过营养缺陷型平板SD/-Leu培养获得转化子即包含蓝氏贾第鞭毛虫cDNA文库,并对文库的库容及DNA重组率进行鉴定。结果以RNA为模板,经逆转录、LD-PCR、纯化等,得到了较为理想的双链cDNA。将ds cDNA和pGADT7-Rec转化到酵母菌株,经分离培养,最终得到转化成功的酵母转化子,建立了贾第虫的cDNA文库,文库容量为2.715×107/mL,重组率76.7%,插入片段的大小主要集中在300~1 000。结论成功的构建了较为理想的C2株贾第虫cDNA文库。
[关键词]贾第虫属;基因文库;双杂交系统技术
doi:10.3969/j.issn.1007-3205.2018.01.002
蓝氏贾第鞭毛虫(Giardia lamblia或称Giardia intestinalis或Giardia duodinalis,简称贾第虫)是一种原始的单细胞真核生物,广泛分布于世界各地,常引起贾第虫病,又被称作旅游者腹泻[1-2]。贾第虫病传染性强,发病率高,常呈暴发性流行,尤其在医疗卫生条件较差的第三世界国家。鞭毛、腹吸盘等与贾第虫感染过程密切相关,主要由细胞骨架构成。其中贾第素是贾第虫特有的骨架蛋白[3]。分成α、β、γ、δ四大类[4-5],其中α贾第素是最大的一族,共有21个成员。目前,大部分贾第素的定位已经清楚,但每种α贾第素的具体功能尚未明晰[6]。酵母双杂交技术是研究蛋白质的重要方法。利用酵母双杂交技术,研究人员对已知蛋白的功能进行探讨,并对其功能区域进行细致分析,以便为进一步揭示蛋白质的未知功能、完善对蛋白质的认识提供支持。本研究应用酵母双杂交技术,构建C2株贾第虫cDNA文库,旨在为探索蓝氏贾第鞭毛虫的致病机制奠定基础。现报告如下。
1.1材料和试剂 实验虫株:C2株贾第虫虫株。Trizol 试剂盒购于Invitrogen公司;二硫苏糖醇(dithiothreitol,DTT)、焦碳酸二乙酯(diethy pyrocarbonate,DEPC)购自Sigma-Aldrich公司;1 kb Plus DNA Ladder购自Life公司; Mate & PlateTM文库构建试剂盒购自Clontech公司;其他试剂还有GELVIEW核酸染料、氯仿、异丙醇、无水乙醇等。改良TYI-S-33培养基、DEPC水、RNase-free 75%乙醇、50×TAE电泳缓冲液、1.1×TE/Li Ac 0.9%NaCl、PEG/Li Ac。PCR扩增仪T100、稳压稳流电泳仪DYY-6C、低温高速离心机(型号:3K30)、超微量核酸蛋白测定仪Scandrop2000、凝胶成像系统92-1292、低温高速离心机(型号:Heraeus X1R)、超净工作台ZHJH-C1112B、倒置显微镜CKX31、CO2孵箱2406、低温循环水浴、恒温水浴箱HH-W、高压蒸汽灭菌锅SQ510C、气浴振荡摇床ZHWY-100D。
1.2实验方法
1.2.1C2株贾第虫的双链cDNA的合成 C2贾第虫放入含有改良TYI-S-33培养基硼酸硅培养管中,置于37 ℃培养48~72 h。选择长势较好的培养管, 4 ℃冰浴15 min。取出后培养管充分混合,计数虫体数。并将虫液调制6×106~10×106个滋养体/mL。离心收集贾第虫虫体团块,用Trizol法提取Total RNA,并进行纯化。最后将收集到的RNA溶于120 μL DEPC水中。通过建立逆转录反应体系,以RNA为模板,合成贾第虫cDNA单链。建立DNA的扩增反应体系,以cDNA单链为模板,继续进行LD-PCR扩增,来合成贾第虫双链cDNA。用1.2%琼脂糖对PCR产物进行分析。经纯化后,将ds cDNA保存于-20 ℃待用。
1.2.2酵母感受态制备 酵母菌株Y187接种培养基,30 ℃培养直至长出克隆(约3 d)。选取2~3 mm,小于4周的克隆,至3 mL YPDA培养基。30 ℃ 250 r/min振荡培养8~12 h。取5μL培养菌液至装有50 mL YPDA的250 mL烧瓶中。振荡培养直至OD600为0.15~0.3(16~20 h)。 将菌液700 g室温离心5 min。弃上清,用100 mL新鲜YPDA重悬菌体。30 ℃孵育直至OD值为0.4~0.5(3~5 h)。 再次离心,弃上清, 30 mL去离子水重悬菌体。700 g室温离心5 min。弃上清,用1.5 mL 1.1xTE/LiAc重悬菌体。高速瞬离15 s,弃上清,用600 μL 1.1xTE/LiAc重悬菌体。此时菌体即可作为感受态。
1.2.3酵母感受态的转化 向Y187感受态酵母细胞中共转化:20μL蓝氏贾地鞭毛虫ds cDNA (2 μg)和6 μL pGADT7-Rec(0.5 μg/L)。再加入感受态细胞,2.5 mL PEG/LiAc。30 ℃孵育30 min。加入DMSO 160 μL,轻轻混匀。 42 ℃水浴15 min。700 g离心5 min。弃上清,加入YPD Plus Medium。30 ℃振荡孵育90 min。700 g离心5 min,弃上清。15 mL 0.9%(w/v) NaCl重悬。将50 μL 1/10 、1/100稀释液分别铺板于SD/-Leu 100 mm固体培养基上,30 ℃,孵育3~4 d;确定文库的库容。独立克隆数=No. of cfu/mL on SD/-Leu x重悬液体积(15 mL),将剩下的悬浮液涂布在SD/-Leu培养基上(每板150μL)。约使用100板。30 ℃孵育3~4 d。收获转化子,计算酵母细胞的密度。酵母细胞密度大于2×107/mL则可进行分装保存。若细胞密度小于2×107/mL,需要重新离心,去除多余的悬浮液。将文库分装,-80 ℃贮存。
1.2.4重组率鉴定 挑取30个单克隆,溶解在100 μL ddH2O中。交替放入沸水和液氮中(重复3~4次)。5 500 r/min,离心5 min,收集上清液。将单克隆冻融伤情3 μL、文库通用引物5′-primer 0.3 μL、文库通用引物3′-primer 0.3 μL、2×PCR Mix 10 μL、dd H2O 6.4 μL加入离心管。扩增体系分别经:95 ℃ 5 min,95 ℃ 50 s,55 ℃ 30 s,72 ℃ 2 min,25个循环;72 ℃,10 min。收集扩增产物,电泳分离提纯。
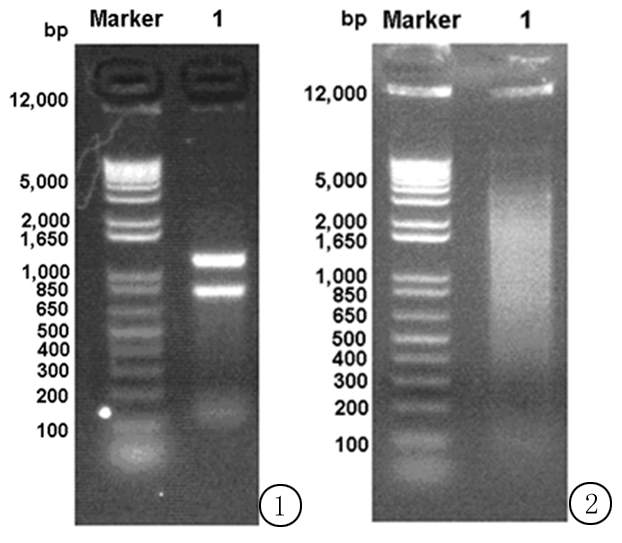
2.1Total RNA浓度及纯度鉴定 提取的贾第虫RNA经紫外分光检测OD260/OD280为2.05,浓度为1.203 μg/μL。经电泳分离出3条特异性条带(图1),分别为5 S、18 S和28 S核糖体RNA。条带亮度显示28 S约为18 S的2倍。总RNA的浓度和纯度符合实验要求。
2.2双链cDNA产物的鉴定 双链cDNA经LD-PCR扩增,电泳分离鉴定。电泳结果(图2)显示,其长度主要分布在300~5 000 bp,很好地排除了小片段的双链cDNA,纯化效果较为理想。

图1提取蓝氏贾第鞭毛虫总RNA电泳结果
Marker:1 kb Plus DNA Ladder;1:总RNA
Figure1TheelectrophoresisresultsofextractingtotalRNAfromGiardialamblia
图2蓝氏贾第鞭毛虫双链cDNA纯化后电泳结果
Marker:1 kb Plus DNA Ladder;1:纯化后的cDNA
Figure2GiardialambliadoublestrandedcDNApurifiedbyelectrophoresisresults
2.3酵母文库库容量鉴定 通过对SD/-Leu板菌落计数(图3),计算库容量(稀释度1∶1 000)=181/100 μL×1 000×1 000 μL=1.81×106/mL;总克隆数CFU=1.81×106/mL×15 mL=2.715×107/mL。
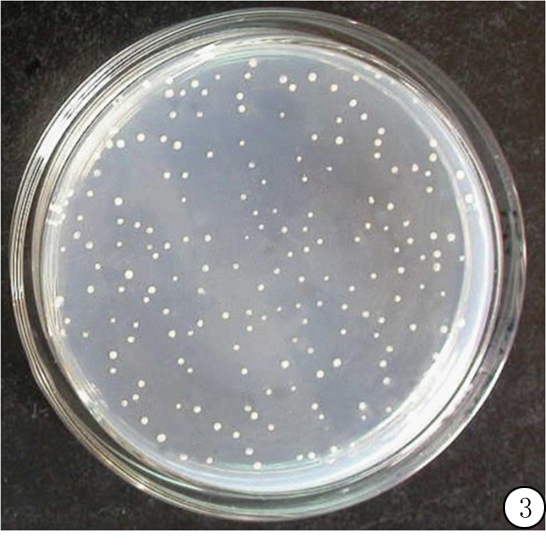
图3转化菌1∶1000倍稀释后平板克隆生长情况
Figure3Thegrowthofthetransformedyeastontheplateafter1∶1 000timesdiluted
2.4重组率鉴定 随机选取30个酵母细胞克隆,冻融裂解后,提取重组质粒DNA,用1%琼脂糖凝胶电泳对重组质粒cDNA经PCR扩增产物进行分离,结果显示,共分离出23条亮带(图4)。表示存在23种不同的插入片段的克隆。插入率为23/30=76.7%。而插入片段的大小主要集中在300~1 000 bp。
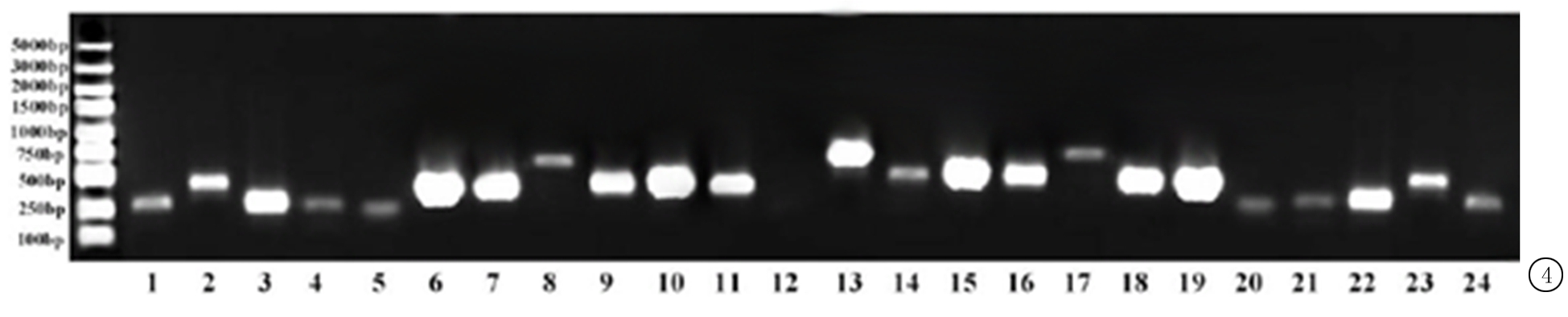
图4PCR鉴定酵母克隆片段插入情况
Figure4IdentificationofyeastclonedfragmentsbyPCR
对于生物体的研究已经进入分子层面,但相对于浩瀚的蛋白质组学和基因组学的内容来说,对每个蛋白质、每段肽链的认识仍然只是很少的一部分。每个蛋白分子可能存在几个或十几个甚至上百个活性位点,这些活性中心是蛋白质发挥效应的真正场所,对于未知功能的活性中心、蛋白质的结构以及生物学作用方面,仍然有待更深入的研究。应用酵母双杂交技术,研究人员对已知蛋白功能区域进行细致分析,进一步发现新的结构域,进而揭示蛋白质未知的功能[7-9],从而完善对于蛋白质的认识。酵母双杂交技术在研究中具有很多的优势[10]:如其采用真核细胞作为宿主,最大限度地还原了生理状态下蛋白质之间的相互作用;通过生理代谢过程进行反应,很多难以检测的微弱相互作用可以利用生物学放大显现出来,该方法的灵敏度高;另外,研究在活细胞中进行,也省去了人为创造反应条件而需要的繁琐工作。正是有了这些优势,该方法在蛋白质的研究[11-14]、基因的研究[15-16]、蛋白连锁图的建立[17-18]、药物及其作用位点[19]、抗原抗体反应[20]、病毒[21]、寄生虫[22]等的研究中被广泛应用。
总RNA的提取是研究的第一步,不仅要保证提取过程中RNA的完整性,而且要保证其浓度和纯度达到实验的要求。Trizol法提取总RNA是目前应用较为广泛的RNA提取方法。一方面它能够较好地保证RNA的结构不遭到破坏,使RNA结构保持完整;另一方面,提取的RNA纯度较高。而且,其操作方便、快捷,对于样本量要求较低,很少量的组织细胞便可达到很好的分离结果。因此,为细菌、寄生虫等微生物RNA的研究提供了较好的便利。
本研究通过将贾第虫虫体细胞进行破环,进一步用Trizol法对其RNA进行提取,经紫外分光检测最终获得了OD260/OD280为2.05、浓度为1.203 μg/μL的RNA。为进一步对RNA纯度进行验证,用1%琼脂糖凝胶电泳对提取物进行电泳分离,结果分离出3条特异性条带,分别为5 S、18 S和28 S核糖体RNA,条带亮度显示28 S约为18 S的2倍。综合验证结果显示,贾第虫总RNA的浓度和纯度均已达到较理想的结果,符合下一步实验的要求。以RNA为模板经逆转录、LD-PCR扩增,得到双链cDNA。此时得到的cDNA纯度,还不能达到实验的要求,需进一步经过纯化柱的纯化、乙醇和醋酸的沉淀,方可得到相对较纯的cDNA。电泳结果显示,双链cDNA的长度分布宽度主要为300~5 000 bp,很好地排除了小片段的双链cDNA,纯化效果较为理想。
将ds cDNA与pGADT7-Rec共转化酵母株Y187中。通过营养缺陷型平板SD/-Leu培养获得转化子即包含蓝氏贾第鞭毛虫cDNA文库。建立的基因文库是否能够满足实验的要求,需要验证2个方面的内容,一是文库的库容量,二是cDNA的完整性。通过对SD/-Leu板菌落计数,计算文库容量为2.715×107/mL。随机选取30个酵母细胞克隆,冻融裂解提取重组质粒DNA进行PCR扩增后,经电泳分离鉴定,得到23种不同插入片段的克隆,插入率为23/30=76.7%,而插入片段的大小主要集中在300~1 000 bp,建立的贾第虫cDNA文库满足建立文库的条件。
本研究应用Trizol 试剂盒对RNA进行了提取,经逆转录获得了cDNA单链,以cDNA单链为模板,通过LD-PCR扩增,得到了较为理想的双链cDNA。将双链cDNA和pGADT7-Rec转化到感受态的酵母菌株,经过培养分离最终得到了满足实验需要的酵母转化子,建立了贾第虫的cDNA文库,为之后的实验内容奠定了基础。
[参考文献]
[1] Tan L,Yu X,Abdullahi AY,et al. Development of a rapid HRM genotyping method for detection of dog-derived Giardia lamblia[J]. Parasitol Res,2015,114(11):4081-4086.
[2] 沈海娥,李冀,杨学慧,等.蓝氏贾第鞭毛虫的细胞核[J].中国煤炭工业医学杂志,2008,11(10):1624-1625.
[3] Crossley R,Holberton DV. Characterization of proteins from the cytoskeleton of Giardia lamblia[J]. J Cell Sci,1983,59:81-103.
[4] Kim J,Goo SY,Chung HJ,et al. Interaction of beta-giardin with the Bop1 protein in Giardia lamblia[J]. Parasitol Res,2006,98(2):138-144.
[5] Nohria A,Alonso RA,Peattie DA. Identification and characterization of gamma-giardin and the gamma-giardin gene from Giardia lamblia[J]. Mol Biochem Parasitol,1992,56(1):27-37.
[6] 王洋,余源,王卫亮,等.蓝氏贾第鞭毛虫α-4贾第素的原核表达及纯化[J].中国人兽共患病学报,2011,27(6):465-469.
[7] 刘禹辰,贺福初,王建.大规模酵母双杂交技术的发展及其在蛋白质相互作用组学中的应用[J].生命科学,2014,26(4):423-429.
[8] 程志,高蕊,马林强,等.利用酵母双杂交技术筛选与转录因子HOXA11相互作用的蛋白[J].重庆医科大学学报,2016,41(5):443-447.
[9] 范文涛,杜恩崎,高小龙,等.禽脑脊髓炎病毒VP1蛋白纳米抗体的筛选及活性检测[J].中国兽医学报,2014,36(1):12-17.
[10] 郑立双,李向楠,孙城涛,等.酵母双杂交技术及应用的研究进展[J].中国畜牧兽医,2013,40(9):105-108.
[11] 张蕾,常宏,徐东.利用双杂交系统筛选并鉴定与GPR30相互作用的蛋白[J].河北医科大学学报,2013,34(4):378-380.
[12] 高向伟,许正平.血管生成素相互作用蛋白质的筛选及鉴定[J].中国生物化学与分子生物学学报,2015,31(12):1289-1293.
[13] 沈君豪,方娟,郭兴荣,等.酵母双杂交技术筛选宫颈癌HeLa细胞cDNA文库中FAM92A1-289关联蛋白[J].山东医药,2016,56(19):1-4.
[14] 刘超,刘乙蒙,栾治东,等.酵母双杂交技术筛选与蛋白激酶Wee1相互作用的蛋白[J].中国生化药物杂志,2016,36(3):23-26.
[15] 法蒂玛·木特力甫,高剑,刘君,等.吐鲁番地区乡村小学生感染蓝氏贾第鞭毛虫基因型的研究[J].医学动物防制,2015,31(8):859-862.
[16] 刘会宁,李剑,柳立军,等.SSH方法对食管癌相关差异基因cDNA文库的建立及初步分析[J].河北医科大学学报,2008,29(2):165-169.
[17] 黄欣媛,范红波.酵母双杂交及其衍生系统[J].生物技术通报,2014,30(1):75-82.
[18] 王婷,葛怀娜,郭宏.酵母双杂交技术的应用进展[J].生物技术进展,2015,5(5):392-396.
[19] 刘潇.基于膜上的酵母双杂交系统及其在药物开发中的应用[J].生命科学研究,2006,10(4):20-24.
[20] 郑美云,李妙君,沈国婴,等.用酵母双杂交系统筛选抗人P53单链抗体[J].细胞与分子免疫学杂志,2016,32(1):112-117.
[21] 张丹,翟永贞,冯国和.丙型肝炎病毒核心蛋白酵母双杂交诱饵载体的构建及鉴定研究[J].临床和实验医学杂志,2014,13(16):1329-1331.
[22] 董亮,张守发,许天应,等.瑟氏泰勒虫感染的牛外周血单个核细胞酵母双杂交cDNA文库构建及鉴定[J].畜牧与兽医,2015,47(9):65-68.
LIU Shao-wei, WANG Yang, TIAN Xi-feng
(DepartmentofPathogenicBiologyandImmunology,CollegeofBasicMedicine,NorthChinaUniversityofScienceandTechnology,HebeiProvince,Tangshan063210,China)
[Abstract]ObjectiveTo construct a cDNA Library of Giardia lamblia (C2) strains.MethodsBy extraction of C2 strains of Giardia lamblia trophozoites RNA using the Trizol method, and by using RNA as a template by reverse transcriptase cDNA single strand. dscDNA was obtained by LD-PCR amplification. dscDNA was purified and co- transformed with pGADT7-Rec in yeast strain Y187. Through auxotrophic medium SD/-Leu screening, transformants including Giardia lamblia cDNA library were obtained. Then the storage capacity and DNA recombination rate of the library were identified.ResultsUsing RNA as template, the ideal double stranded cDNA was obtained by reverse transcription, LD-PCR, purification and other steps. The dscDNA and pGADT7-Rec were transformed into yeast strain, and the transformants were successfully isolated and cultured. Finally, a cDNA Library of Giardia was constructed. The library capacity was 2.715×107/mL, the recombination rate was 76.7%, and the size of the inserted fragments was mainly between 300bp and 1000bp.ConclusionAn ideal C2 Library of Giardia lamblia cDNA was constructed.
[Key words]Giardia; gene library; two-hybrid system techniques
[收稿日期]2017-08-31;
[修回日期]2017-09-27
[基金项目]国家自然科学基金(31471954);河北省自然科学基金(H2017209143)
[作者简介]刘绍伟(1987-),男,安徽利辛人,华北理工大学基础医学院医学硕士研究生,从事病原生物学研究。
[中图分类号]R382.2
[文献标志码]A
[文章编号]1007-3205(2018)01-0007-04
(本文编辑:赵丽洁)