Table1ComparisonofserumHIF-1αandVEGFlevelsbetweenthetwogroupsbeforeandaftertreatment
赵会颖1,杨永刚1,张建平1,李贵琴1,钱玉中2,李倩倩1
(1.河北省石家庄市第一医院老年病科,河北 石家庄 050011;2.河北省石家庄市第一医院中医科,河北 石家庄 050011)
[摘要]目的观察远程缺血预适应(remote ischemic preconditioning,RIPC)对短暂性脑缺血发作(transient ischemia attack,TIA)患者脑血流指标及血管功能的影响,探讨RIPC训练对TIA的保护作用及作用机制。方法将200例患者随机分为治疗组和对照组各100例。对照组单纯按照2011年美国脑卒中和短暂性脑缺血发作二级预防指南用药。治疗组在对照组基础上加用RIPC训练。应用经颅多普勒检查仪检测2组治疗前后颈总动脉及大脑中动脉脑血流指标,采用酶联免疫吸附法测定2组血清缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)及血管内皮生长因子(vascular endothelial growth factor,VEGF)水平。结果RIPC训练的患者较未经RIPC训练的患者脑血流量增加,HIF-1α、VEGF水平明显下降,差异均有统计学意义(P<0.05)。结论RIPC训练可以增加TIA患者脑血流量,调节血清HIF-1α及VEGF水平,对TIA患者具有良好的防治效果。
[关键词]脑缺血发作,短暂性;缺氧诱导因子1, α亚基;血管内皮生长因子类
doi:10.3969/j.issn.1007-3205.2018.01.004
短暂性脑缺血发作(transient ischemia attack,TIA)是由多种因素引起颈动脉或椎基底动脉系统短暂缺血而导致的一过性脑供血不足,表现为短暂反复发作的头晕、言语不利、运动或感觉障碍等。若未得到及时有效的治疗,易引起严重而持久的神经功能损害。反复缺血缺氧可引起血管内皮细胞结构和功能的改变,对血管内皮细胞的许多重要功能造成影响[1]。脑组织缺氧时会引起血清缺氧诱导因子1α(hypoxia-inducible factor-1,HIF-1α)表达明显增加[2-3]。HIF-1α主要通过调控下游靶基因发挥脑保护作用[4]。血管内皮生长因子( vascular endothelial growth factor,VEGF) 是HIF-1α的一个关键靶基因,是血管生成的重要调节因子,能够促进新生血管生成和增加脑血流量,从而起到神经保护作用[5-6]。研究显示,TIA患者脑血管功能状态发生改变[7-8]。远程缺血预适应(remote ischemic preconditioning,RIPC)是指对心脏和脑以外的非重要器官进行重复缺血或缺氧,从而改善血管功能状态,提高远隔重要器官对严重缺血或缺氧的耐受能力,近年来在临床应用中受到一定的肯定[9-10]。本研究观察TIA患者脑血流量和HIF-1α、VEGF水平的变化,以及RIPC训练的干预作用,探讨RIPC训练对TIA的保护作用及作用机制,以期为TIA的治疗提供依据。
1.1一般资料 选择2015年1月—2016年12月于河北省石家庄市第一医院干部病房和神经内科病房收治的TIA患者200例,随机分为2组:对照组100例,男性56例,女性44例,年龄55~72岁,平均(61.3±3.8)岁,发病时间3 min~15 h;治疗组100例,男性54例,女性46例,年龄53~74岁,平均(60.7±4.5)岁,发病时间5 min~14 h。2组性别、年龄、发病时间差异均无统计学意义(P<0.05),具有可比性。
1.2入选标准 ①均表现出“发作性头晕,言语不利,肢体麻木、无力,视物旋转,耳鸣”等脑血管病的常见早期征兆;②年龄大于40岁并小于80岁,性别不限;③检测血常规和出凝血时间无异常;④卒中再发风险量表评分≥3分或短暂性脑缺血发作早期卒中风险预测工具评分≥4分;⑤具有良好依从性,能够按照要求长期规范二级预防用药;⑥患者及家属均知情并同意入组。
1.3排除标准 ①一般状况差;②患有精神疾病;③严重肝肾功能损害;④有脑出血或脑梗死病史者;⑤非缺血性疾病或颈椎病引起的头晕;⑥患有其他严重疾病,预期生存时间不足2年;⑦孕妇或哺乳期妇女;⑧正在服用与研究有关的药物或正在参与其他实验研究者;⑨四肢血管缺血性疾病;⑩患者或家属不同意入组。
1.4剔除及脱落标准 ①未坚持按研究方案进行训练者予以剔除;②自行退出或未按要求完成整个疗程者为脱落病例。
1.5治疗方法 对照组进行常规治疗,依据2011年美国脑卒中和短暂性脑缺血发作二级预防指南用药[11]。治疗组在对照组基础上加用RIPC训练,具体方法如下:患者取平躺位,应用IPC906治疗仪进行RIPC训练,先将患者双上肢进行加压至180 mmHg,压力维持5 min,然后将压力解除休息5 min,完成1个循环,连续进行5 个循环为1次治疗,2次/d,上午和下午各1 次,6个月为1个疗程。住院期间由专业人员进行训练,出院后由接受培训后的家属进行训练。定期电话随访保证每2周至少1次,有效监督和指导患者治疗。
1.6观察指标 分别于治疗前和治疗6个月时采集患者清晨空腹静脉血3~5 mL,血标本高速离心后分离血清,保存于-70 ℃待测。采用酶联免疫吸附法测定血清HIF-1α及VEGF水平,人HIF-1α、VEGF 试剂盒购自上海美旋生物科技有限公司,严格按照说明书操作。血标本采集经本人知情同意并经医院医学伦理学委员会批准。脑血流指标:应用彩色多普勒超声检测仪检查颈总动脉及大脑中动脉收缩期峰值血流速度(peak systolic velocity,PSV)、舒张期末血流速度(end diastolic velocity,EDV)及血管搏动指数(pulsatility index,PI)。统计并比较2组治疗前后检测结果。
1.7统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
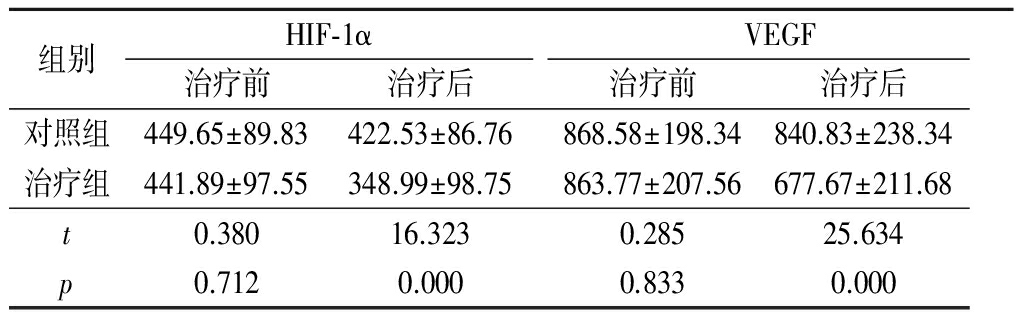
2.12组治疗前后血清HIF-1α、VEGF水平比较 治疗前2组血清HIF-1α、VEGF水平差异均无统计学意义(P>0.05);治疗后治疗组血清HIF-1α、VEGF水平明显低于对照组,差异均有统计学意义(P<0.05)。见表1。
表12组治疗前后血清HIF-1α、VEGF水平比较
Table1ComparisonofserumHIF-1αandVEGFlevelsbetweenthetwogroupsbeforeandaftertreatment![]()
2.22组治疗前后颈总动脉血流指标比较 治疗前2组颈总动脉PSV、EDV 及PI差异均无统计学意义(P>0.05);治疗后治疗组颈总动脉PSV、EDV 及PI 明显优于对照组,差异均有统计学意义(P<0.05)。见表2。
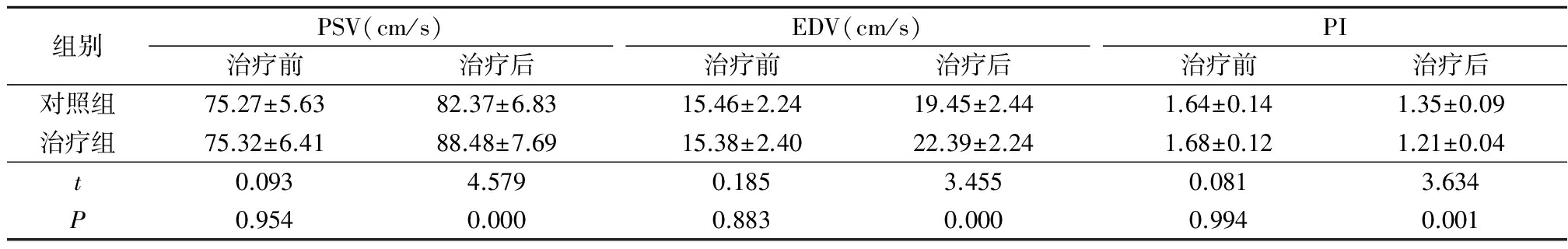
2.32组治疗前后大脑中动脉血流指标比较 治疗前2组大脑中动脉PSV、EDV 及PI差异均无统计学意义(P>0.05);治疗后治疗组大脑中动脉PSV、EDV 及PI 明显优于对照组,差异均有统计学意义(P<0.05)。见表3。
表22组治疗前后颈总动脉血流指标比较
Table2Comparisonofcarotidarterybloodflowindexesbetweentwogroupsbeforeandaftertreatment![]()
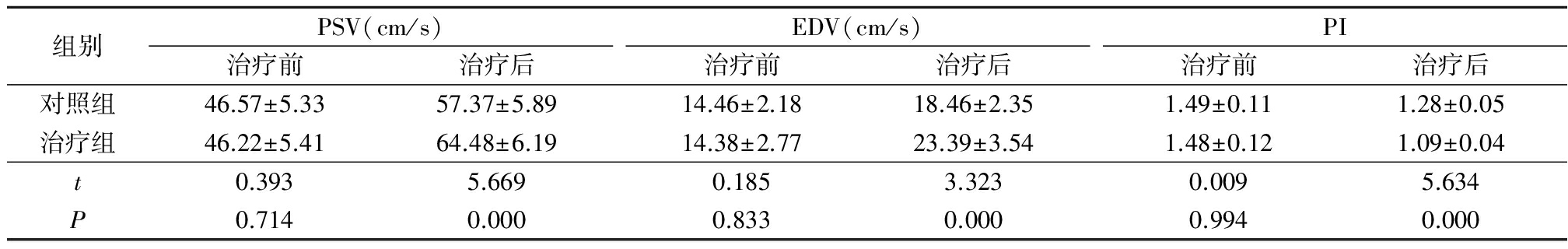
表32组治疗前后大脑中动脉血流指标比较
Table3Comparisonofmiddlecerebralarterybloodflowindexesbetweentwogroupsbeforeandaftertreatment![]()
TIA是脑血管病的特殊类型,具有反复发作、发作时间短等特点,并伴有血管功能状态及血流动力学的改变,若不能得到有效控制,则易发展为脑梗死,给患者和社会带来沉重负担[12]。因此,对本病的防治应引起足够的重视。
脑缺血预适应分为原位缺血预适应和RIPC,由Kitagawa 等[13]于1990年首次研究发现,此现象是指通过一个器官的反复短暂而轻微的亚致死量缺血,使局部器官或远隔组织器官对随后发生的急性严重缺血耐受性明显增强,从而减轻缺血/再灌注损伤,同时血管内皮细胞功能受到保护及减轻炎症反应等。动物实验研究证明,RIPC可以对抗局部缺血/再灌注损伤引起的氧化应激,从而保护靶器官损伤[14-15]。Limani等[16]研究发现,RIPC减轻了老年小鼠肝脏的再灌注损伤,这可能与提高血中VEGF有关。临床试验也证实,RIPC可以降低肺切除术后前列腺素水平和其他氧化性肺损伤标志物,提高术后的PaO2/FiO2比值,保证有效的气体交换,从而减轻肺叶切除术后氧化性肺损伤[17]。有学者通过对90例结肠术后老年患者认知功能的研究发现,接受RIPC训练患者的认知功能明显改善,并有可能与抑制炎症反应有关[18]。有研究显示,RIPC可以通过调节自主神经活性改善心肌缺血,并能通过激活一氧化氮合酶提高红细胞的变形能力,对心脏起到重要的保护作用[19- 20]。临床研究也证实,RIPC能够改善内皮细胞功能,减轻冠心病患者术后的心肌损伤[21]。有研究通过对接受RIPC训练的受试者血浆进行分析,发现RIPC能够保护人脐静脉内皮细胞免受低氧诱导的细胞损伤,且提示这种保护作用可能与细胞内缺血诱导因子HIF-1α的变化有关[22]。RIPC训练作为提高脑组织对缺血缺氧耐受能力的重要手段,可以通过改善组织血流和降低组织代谢等对组织产生保护作用。笔者以往的研究显示,RIPC可以明显降低TIA患者脑梗死的发生率,对TIA具有较好的防治作用[23]。动物实验研究证实,RIPC可以保护大鼠额叶皮层神经元凋亡,并改善大鼠的行为缺陷[24]。有研究显示,RIPC训练可以通过调节HIF-1α、VEGF及腺苷的表达,促进新生血管形成,增加毛细血管数量,从而保护和修复受损脑组织,提高组织对缺血缺氧的耐受能力[25]。
在缺氧诱导的细胞核提取物中发现缺血诱导因子HIF-1,HIF-1的 亚基HIF-1α对细胞内氧分压变化敏感,同时HIF-1α作为HIF-1唯一的氧调节单位,对HIF-1的活性起决定作用。正常状态下,HIF-1α受泛素蛋白酶体系统的影响,处于低水平;组织缺氧时,HIF-1α的降解减少,从而蛋白水平表达增加,使HIF-1的活性显著提高,并启动靶基因的进一步表达,最终使组织对缺氧产生一系列的适应性反应[26]。参与脑保护的下游基因有VEGF、血红素氧化酶1、诱导红细胞生成素、一氧化氮合成酶等,发挥促进血管生成、扩张血管、促进红细胞生成、提高携氧能力等。VEGF 是HIF-1α 的重要靶基因,在缺血缺氧状态下产生明显增多,通过增加受累脑组织的血流量,对神经元及神经功能的恢复具有明显的保护作用,并促进新生血管形成及侧支循环的建立,是血管生成的重要活性因子[5-6]。由此可见,脑组织在正常状态下不表达HIF-1α;当组织缺血缺氧时,HIF-1α 的表达增加,从而实现脑组织的自我保护。由于HIF-1α 对缺血缺氧反应的高度敏感性,其可作为缺血缺氧时脑组织作出适应性反应的重要信号,通过促进VEGF 的转录活性,增加VEGF mRNA的稳定性,以调节VEGF的表达[27-28]。
本研究通过观察RIPC对TIA患者脑血流指标及血管功能的作用,比较应用RIPC训练与未应用RIPC训练患者颈总动脉和大脑中动脉血流量以及血清HIF-1α、VEGF水平的变化,发现给予RIPC训练的患者脑血流量增加,HIF-1α、VEGF水平明显下降。说明TIA患者经此治疗后脑部供血及供氧情况均得到明显改善。
综上所述,RIPC训练可以改善缺血组织的血流动力学和代谢状况,减少TIA的发生及改善预后,是一种新的行之有效的防治措施。
[参考文献]
[1] Wong BW,Marsch E,Treps L,et al. Endothelial cell metabolism in health and disease:impact of hypoxia[J]. EMBO J,2017,36(15):2187-2203.
[2] Chavez JC,LaManna JC. Activation of hypoxia-inducible factor-1 in the rat cerebral cortex after transient global ischemia:potential role of insulin-like growth factor-1[J]. J Neurosci,2002,22(20):8922-8931.
[3] Zhu T,Zhan L,Liang D,et al. Hypoxia-inducible factor 1alpha mediates neuroprotection of hypoxic postconditioning against global cerebral ischemia[J]. J Neuropathol Exp Neuro,2014,73(10):975-986.
[4] Krieg M,Haas R,Brauch H,et al. Up-regulation of hypoxia-inducible factors HIF-1alpha and HIF-2alpha under normoxic conditions in renal carcinoma cells by von Hippel-Lindau tumor suppressor gene loss of function[J]. Oncogene,2000,19(48):5435-5443.
[5] Park YS,Cho JH,Kim IH,et al. Effects of ischemic preconditioning on VEGF and pFlk-1 immunoreactivities in the gerbil ischemic hippocampus after transient cerebral ischemia[J]. J Neurol Sci,2014,347(1/2):179-187.
[6] Ma Y,Zechariah A,Qu Y,et al. Effects of vascular endothelial growth factor in ischemic stroke[J]. J Neurosci Res,2012,90(10):1873-1882.
[7] Quenault A,Martinez de Lizarrondo S,Etard O,et al. Molecular magnetic resonance imaging discloses endothelial activation after transient ischaemic attack[J]. Brain,2017,140(1):146-157.
[8] Meamar R,Nikyar H,Dehghani L,et al. The role of endothelial progenitor cells in transient ischemic attack patients for future cerebrovascular events[J]. J Res Med Sci,2016,21:47.
[9] Quindry JC. Exercise-Induced Cardioprotection and the Therapeutic Potential of RIPC[J]. J Cardiovasc Pharmacol Ther,2017,22(5):397-403
[10] Anttila V,Haapanen H,Yannopoulos F,et al. Review of remote ischemic preconditioning:from laboratory studies to clinical trials[J]. Scand Cardiovasc J,2016,50(5/6):355-361.
[11] 王姝梅,张晓丹,秦伟,等.2011年美国脑卒中和短暂性脑缺血发作二级预防指南解读[J].山东医药,2011,51(20):5-7.
[12] 于文霞,秦震新.短暂性脑缺血发作短期进展为脑梗死的临床多因素分析[J].河北医科大学学报,2010,31(7):823-825.
[13] Kitagawa K,Matsumoto M,Tagaya M,et al. Ischemic tolerance' phenomenon found in the brain[J]. Brain Res,1990,528(1):21-24.
[14] Cho K,Min SI,Ahn S,et al. Integrative Analysis of Renal Ischemia/Reperfusion Injury and Remote Ischemic Preconditioning in Mice[J]. J Proteome Res,2017,16(8):2877-2886.
[15] Duan YF,Sun DL,Chen J,et al. MicroRNA-29a/b/c targets iNOS and is involved in protective remote ischemic preconditioning in an ischemia-reperfusion rat model of non-alcoholic fatty liver disease[J]. Oncol Letters,2017,13(3):1775-1782.
[16] Limani P,Linecker M,Oberkofler CE,et al. Remote Ischemic Preconditioning:A Novel Strategy in Rescuing Older Livers From Ischemia-reperfusion Injury in a Rodent Model[J]. Ann Surg,2016,264(5):797-803.
[17] Garcia-de-la-Asuncion J,Bruno L,Perez-Griera J,et al. Remote Ischemic Preconditioning Decreases Oxidative Lung Damage After Pulmonary Lobectomy:A Single-Center Randomized,Double-Blind,Controlled Trial[J]. Anesth Analgesia,2017,125(2):499-506
[18] He Z,Xu N,Qi S. Remote ischemic preconditioning improves the cognitive function of elderly patients following colon surgery:a randomized clinical trial[J]. Medicine (Baltimore),2017,96(17):e6719.
[19] Abdul-Ghani S,Fleishman AN,Khaliulin I,et al. Remote ischemic preconditioning triggers changes in autonomic nervous system activity:implications for cardioprotection[J]. Physiol Rep,2017,5(3):e1308.
[20] Grau M,Kollikowski A,Bloch W. Remote ischemia preconditioning increases red blood cell deformability through red blood cell-nitric oxide synthase activation[J]. Clin Hemorheol Microcirc,2016,63(3):185-197.
[21] Liang Y,Li YP,He F,et al. Long-term,regular remote ischemic preconditioning improves endothelial function in patients with coronary heart disease[J]. Braz J Med Biol Re,2015,48(6):568-576.
[22] Weber NC,Riedemann I,Smit KF,et al. Plasma from human volunteers subjected to remote ischemic preconditioning protects human endothelial cells from hypoxia-induced cell damage[J]. Basic Res Cardiol,2015,110(2):17.
[23] 杨永刚,钱玉中,赵会颖,等.远程缺血预适应治疗对短暂性脑缺血发作患者再发脑梗死的影响[J].临床合理用药杂志,2014,7(8):87-88.
[24] Ma W,Cao YY,Qu S,et al. Remote ischemic preconditioning provides neuroprotection:impact on ketamine-induced neuroapoptosis in the developing rat brain[J]. Eur Rev Med Pharmacol Sci,2016,20(23):4972-4979.
[25] Xia M,Ding Q,Zhang Z,et al. Remote Limb Ischemic Preconditioning Protects Rats Against Cerebral Ischemia via HIF-1alpha/AMPK/HSP70 Pathway[J]. Cell Mol Neurobiol,2017,37(6):1105-1114.
[26] Tan T,Yu RMK,Wu RSS,et al. Overexpression and Knockdown of Hypoxia-Inducible Factor 1 Disrupt the Expression of Steroidogenic Enzyme Genes and Early Embryonic Development in Zebrafish[J]. Gene Regul Syst Bio,2017,11:1177625017713193.
[27] Salinas-Sanchez AS,Serrano-Oviedo L,Nam-Cha SY,et al. Prognostic Value of the VHL,HIF-1alpha,and VEGF Signaling Pathway and Associated MAPK (ERK1/2 and ERK5) Pathways in Clear-Cell Renal Cell Carcinoma[J]. Clin Genitourin Cancer,2017,15(6):e923-933.
[28] 吴建梁,李鹏,扈玉华,等.小脑血管母细胞瘤中HIF-1α与VEGF的表达及调控机制研究[J].河北医科大学学报,2009,30(12):1259-1259.
ZHAO Hui-ying1, YANG Yong-gang1, ZHANG Jian-ping1, LI Gui-qin1, QIAN Yu-zhong2, LI Qian-qian1
(1.DepartmentofGeriatricsandGerontology,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China; 2.DepartmentofTraditionalChineseMedicine,theFirstHospitalofShijiazhuang,HebeiProvince,Shijiazhuang050011,China)
[Abstract]ObjectiveTo observe the effect of remote ischemic preconditioning(RIPC) on the transient cerebral index and vascular function in patients with transient ischemic attack(TIA), and to investigate the protective effect and mechanism of RIPC on TIA.MethodsTwo hundred patients were randomly divided into treatment group and control group, with 100 patients of each group. The control group
receivedonly secondary prevention guidelines of stroke and transient ischemic attack in 2011. The treatment group was trained with RIPC on the basis of the control group. The cerebral blood flow indexes of the common carotid artery and middle cerebral artery were measured by TCD before and after treatment. Serum hypoxia-inducible factor-1α(HIF-1α) and vascular endothelial growth factor(VEGF) levels were measured by enzyme linked immunosorbent assay.ResultsCerebral blood flow was increased in patients with RIPC training than that without training. HIF-1α and VEGF levels were significantly decreased in patients with RIPC training than that without training, and the difference was statistically significant(P<0.05).ConclusionRIPC can increase cerebral blood flow and regulate serum HIF-1α and VEGF levels of patients with TIA. It has good effect on prevention and treatment of TIA.
[Key words]ischemic attack, transient; hypoxia-inducible factor 1, alpha subunit; vascular endothelial growth factors
[收稿日期]2017-06-29;
[修回日期]2017-08-05
[基金项目]河北省科技计划项目(15277785D)
[作者简介]赵会颖(1964-),女,天津人,河北省石家庄市第一医院主任医师,医学硕士,从事老年病诊治研究。
[中图分类号]R743.31
[文献标志码]A
[文章编号]1007-3205(2018)01-0015-05
(本文编辑:刘斯静)