王文斌1,刘 兵2,吕海涛1,王天阳1,张腾飞1,何 伟1
(1.河北医科大学第二医院肝胆外科,河北 石家庄 050000;2.河北医科大学第三医院肿瘤科,河北石家庄 050051)
[摘要]目的探讨CC类趋化因22(C-C class chemokines 22,CCL22)和叉头状翅膀样转录因子3(forkhead/winged helix transcription factor 3,FOXP3)在胆管癌组织中的表达及其临床意义。方法采用免疫组织化学法检测70例胆管癌组织和15例非肿瘤胆道上皮组织中CCL22、FOXP3的表达情况,分析其与胆管癌临床和预后的关系。结果70例胆管癌、15例非肿瘤胆道上皮组织中CCL22和FOXP3阳性表达率分别为62.4%(44/70)、20.0%(3/15)及71.4%(50/70)、13.3%(2/15)。CCL22和FOXP3蛋白在胆管癌组织中的表达水平均明显高于非肿瘤胆道上皮组织(P<0.01)。有淋巴结转移者和TNM分期Ⅲ+Ⅳ期者较无淋巴结转移者和TNM分期Ⅰ+Ⅱ期者CCL22和FOXP3的表达阳性率高,差异有统计学意义(P<0.05)。CCL22与FOXP3蛋白表达呈明显正相关(P<0.01)。CCL22和FOXP3蛋白阴性表达者生存时间明显长于阳性表达者(P<0.01)。结论CCL22和FOXP3可能对胆管癌发展及预后产生重要影响。
[关键词]胆管肿瘤;CC趋化因子22;叉头状翅膀样转录因3
doi:10.3969/j.issn.1007-3205.2018.01.005
胆管癌的发生发展与其微环境的改变关系密切。研究发现,肿瘤细胞及间质中的吞噬细胞和树突柱状细胞能够分泌CC类趋化因子(C-C class chemokines 22,CCL22)[1-2]。CCL22与调节型T淋巴细胞(regulatory T cells,Tregs)表面特异性配体CCR4结合后,能够选择性地将叉头状翅膀样转录因子3(forkhead/winged helix transcription factor 3,FOXP3)+Tregs招募至肿瘤微环境中,通过Tregs数目扩增,抑制肿瘤局部免疫应答,促进肿瘤的发生发展及远处转移,并影响患者的预后[3]。CCL22在胆管癌组织中的表达及其与FOXP3+Tregs的关系未见报道。本研究采用免疫组织化学方法检测胆管癌组织中CCL22和FOXP3的表达,并分析其与胆管癌临床参数及预后的意义。
1.1一般资料 收集2009年3月—2014年4月在河北医科大学第二医院手术切除经病理证实的胆管癌标本70例(其中腺癌62例,黏液腺癌3例,鳞癌1例,乳头状腺癌3例,神经内分泌癌1例),男性50例,女性20例,年龄35~82岁,平均(59.0±9.7)岁。其中高分化31例,中分化18例,低分化21例。按照美国癌症学会第6版胆管癌TNM分期标准,其中Ⅰ期25例,Ⅱ期30例,Ⅲ期12例,Ⅳ期3例;Ⅰ+Ⅱ期为肿瘤早期,Ⅲ+Ⅳ期为肿瘤进展期。术前均未经放化疗。选择非肿瘤胆管上皮组织标本15例作为对照组,男性9例,女性6例,年龄32~61岁,平均(56.7±9.2)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
1.2试剂 CCL22多克隆抗体(英国Abcam公司试剂),鼠抗人FOXP3单克隆抗体(eBioscience公司试剂),二步法即用型非生物素免疫组织化学ElivisionTM plus检测试剂盒和DAB显色试剂盒购自福州迈新生物技术有限公司。
1.3检测方法 采用链霉素抗生物素蛋白-过氧化物酶(streptavidin-perioxidase,SP)法进行免疫组织化学染色。石蜡常规4 μm厚度切片,脱蜡水化。枸橼酸盐缓冲液中加热15 min进行抗原修复,自然冷却后,3% H2O2室温孵育10 min,阻断内源性过氧化物酶。分别滴加一抗(CCL22浓度为1∶100,FOXP3浓度为1∶400),4 ℃冰箱内过夜。其余步骤按二步法免疫组织化学检测试剂盒说明进行。苏木精复染,脱水封片。已知结肠癌组织对照片作为阳性对照,以PBS替代一抗作为阴性对照。
1.4结果判定 FOXP3为胞核着色,黄色或棕黄色颗粒为阳性。结果判定标准:①计算阳性细胞百分数,随机选取10个高倍视野对阳性细胞进行观察计数,取其平均数,<5%计0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;②根据染色强度分为:无着色0分,弱染色1分,中等染色2分,强染色3分。以2项相加作为最终评分,≥3分为阳性。CCL22着色于肿瘤细胞内和细胞间质,以肿瘤细胞及部分细胞间质出现棕黄色颗粒染色为阳性染色。结果判定标准:①计算阳性细胞百分比,每张切片随机观察10个高倍视野,<10%为0分,11%~50%为1分,51%~75%计2分,>75%计3分;②依据染色强度评分:无着色0分,弱染色1分,中等染色2分,强染色3分。2项得分相加,≤3为阴性,>3为阳性。
1.5随访 通过电话、门诊及住院复查的方式进行随访,随访率为100%。
1.6统计学方法 应用SPSS 19.0统计软件分析数据。计数资料比较采用χ2检验;相关性表达采用Spearman等级相关;采用Kaplan-Meier生存曲线法计算生存率。P<0.05为差异有统计学意义。
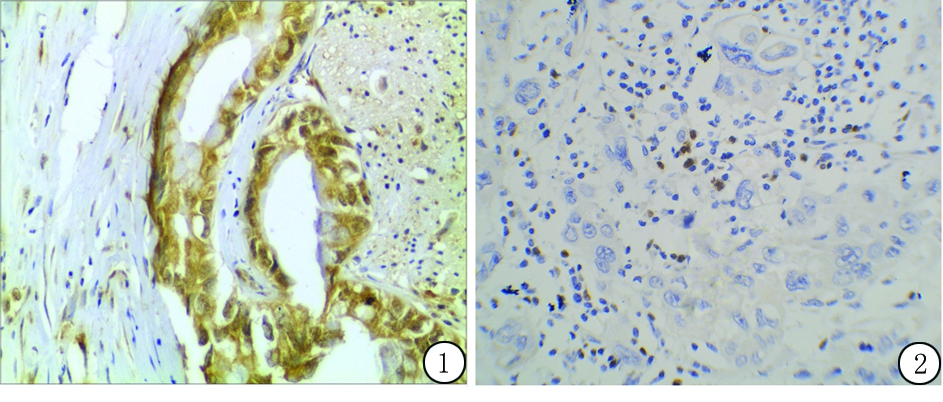
2.12组CCL22和FOXP3蛋白表达比较 CCL22主要分布于胆管癌细胞的胞浆,呈浅黄色或棕黄色颗粒状表达,其在胆管癌中的表达明显高于非肿瘤胆道上皮组织(图1)。FOXP3阳性染色定位于浸润淋巴细胞胞核着色,呈现黄色或棕黄色颗粒(图2)。胆管癌组CCL22和FOXP3蛋白表达率高于对照组,差异均有统计学意义(P<0.01),见表1。
2.2胆管癌组不同病理参数CCL22和FOXP3表达率比较 不同性别、不同年龄、不同肿瘤大小、不同组织分级CCL22和FOXP3表达阳性率差异均无统计学意义(P>0.05);而有淋巴结转移者和TNM分期Ⅲ+Ⅳ期者较无淋巴结转移者和TNM分期Ⅰ+Ⅱ期者CCL22和FOXP3表达阳性率高,差异有统计学意义(P<0.05)。见表2。

图1CCL22在胆管癌组织中的表达(SP×400)
Figure1ExpressionofCCL22incholangiocarcinoma(SP×400)
图2FOXP3在胆管癌组织中的表达(SP×400)
Figure2ExpressionofFOXP3incholangiocarcinoma(SP×400)
表12组CCL22和FOXP3表达率比较
Table1ComparisonbetweenexpressionratesofCCL22andFOXP3intwogroups(例数,%)
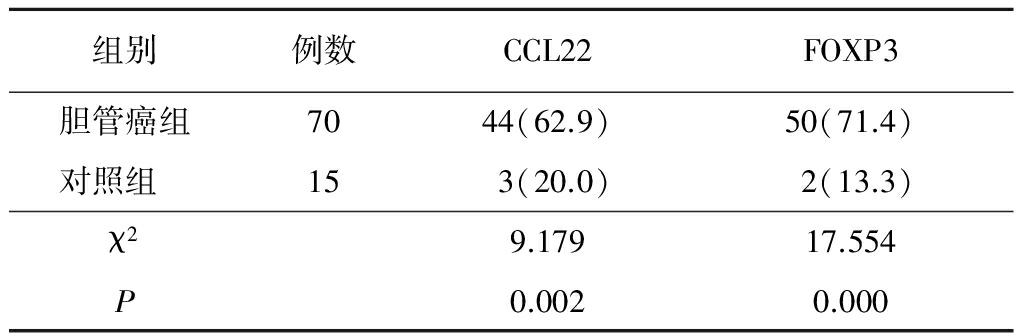
表2胆管癌组不同病理参数CCL22和FOXP3表达阳性率比较
Table2ExpressionratecomparisonofCCL22andFOXP3incholangiocarcinoma(例数,%)
2.3CCL22与FOXP3在胆管癌中表达的相关性及对预后的意义 胆管癌组FOXP3蛋白阳性表达50例(71.4%,50/70),CCL22蛋白阳性表达37例(52.9%,37/70),FOXP3蛋白阳性表达率高于CCL22蛋白表达率,差异有统计学意义(χ2=5.131,P<0.05)。Spearman等级相关分析显示FOXP3与CCL22蛋白在胆管癌组织中的表达呈明显正相关(rs=0.365,P=0.002),提示胆管癌细胞有可能通过表达CCL22蛋白促进FOXP3+Tregs向肿瘤间质浸润。生存分析显示,CCL22和FOXP3阴性表达组中位生存时间47个月,CCL22和FOXP3阳性表达组中位生存时间16个月,阴性表达组生存时间明显长于阳性表达组,差异有统计学意义(χ2=8.240,P=0.004)。
胆管癌占肝胆系统肿瘤的10%~15%,发病率为0.5/10万~1.2/10万,男性多于女性[4]。目前,胆管癌的发病率呈上升趋势。中国人每年新发病例占全世界的55%。由于胆管癌临床特征不明显,发现时已经属于进展期,临床治疗以手术为主,切除范围广,风险大,放化疗效果不理想,预后差。需要寻找新的治疗思路以提高胆管癌的治疗效果。胆管癌的发生发展与其所处的微环境密切相关。肿瘤细胞、肿瘤间质细胞(如巨噬细胞、树突状细胞等)以及各种细胞因子、炎症介质、趋化因子等所构成的免疫微环境对肿瘤的发生发展具有决定性的作用,影响肿瘤患者的预后[5]。
CCL22又称巨噬细胞源趋化因子(macrophage-derived chemokine,MDC),由位于16号染色体的CCL22基因编码,由肿瘤细胞、树突状细胞和巨噬细胞等分泌产生,是CC类趋化因子受体CCR4的特异性配体,通过与免疫细胞表面CCR4受体相结合,影响淋巴细胞、树突状细胞的分化、增殖和定位,抑制肿瘤免疫系统功能,促进肿瘤发生[6-7]。研究发现CCL22在许多肿瘤中有表达[8-10],并且对肿瘤的浸润转移发挥着重要作用。国内管彩虹等[11]采用CCL22诱导肺癌细胞SBC-5后,能够明显增加肺癌细胞的迁移和侵袭能力,并证实ERK/p38MAPK蛋白激酶在其中发挥了重要作用。张伟国等[12]将Dil标记的胃癌细胞株MFC悬液进行小鼠腹腔种植,发现腹水CCL22浓度明显增加,腹膜转移乳斑区域中CCL22表达显著增加,表明CCL22促进了胃癌的腹膜转移。本研究结果显示,CCL22在胆管癌中阳性率为62.4%,在非肿瘤胆道上皮组织阳性表达率为20.0%,CCL22蛋白在胆管癌组织中的表达明显高于非肿瘤胆道上皮组织,表明CCL22在胆管癌的发生方面可能发挥一定的作用;Ⅲ+Ⅳ期CCL22的表达明显高于Ⅰ+Ⅱ的表达,淋巴结转移者CCL22的表达明显高于无转移者,表明CCL22与胆管癌临床进展密切相关,CCL22蛋白表达上调促进了胆管癌的浸润转移。
CCL22能够通过CCR4受体招募Tregs进入肿瘤微环境从而促进肿瘤的发展。Tregs能通过细胞免疫、体液免疫、调节树突细胞的活性等多种机制实现肿瘤细胞微环境中的免疫抑制状态,从而诱发肿瘤细胞的免疫逃逸及机体对其产生耐受。Tregs的特异性标志是FOXP3,FOXP3是转录因子叉头/翼状螺旋家族中的一员,由Bennett 2001年首次报道,与Tregs的发育和成熟关系密切。FOXP3定位于Xp11.23,包含11个外显子和10个内含子,其编码产物为Scurfin蛋白,相对分子质量为43 000,通过Rorkhead区域与DNA结合调节目的基因活化表达,FOXP3目前被公认为是CD4+CD25+Tregs特异性的标记[13]。研究表明,在多种肿瘤组织中存在着CCL22表达和FOXP3+Tregs的浸润,且呈正相关关系,FOXP3具有调节免疫反应、免疫抑制、维持机体内稳态作用,促进肿瘤的发展,对肿瘤的恶性生物学行为和预后产生重要影响[14-15]。国内学者刘亚庆等[16]采用siRNA技术沉默肺腺癌细胞A549 FOXP3表达,发现A549细胞FOXP3沉默后,增殖明显减慢,细胞周期阻滞在G0/G1期,G1/S期checkpoint基因CCND1表达明显下降。杨永碧等[17]通过构建FOXP3基因过表达质粒,采用脂质体转染导入卵巢癌细胞Skov3细胞,发现过表达FOXP3基因能够显著抑制Skov3细胞的侵袭转移能力,降低细胞基质蛋白酶MMP-2和MMP-9的表达水平。刘文宣等[18]发现降钙素基因相关肽能够剂量依赖性抑制Tregs所占的比例和FOXP3 mRNA的表达。本研究发现胆管癌组织中确实存在着FOXP3+Tregs的浸润,而且其浸润数目明显高于非肿瘤胆道上皮组织,说明FOXP3+Tregs对胆管癌的发生可能起着重要作用,并且FOXP3+Tregs的浸润与胆管癌的临床分期和淋巴结转移密切相关,进展期和发生淋巴结转移的肿瘤组织中浸润FOXP3+Tregs数目明显多于早期和无淋巴结转移的肿瘤,并且CCL22与FOXP3的表达呈明显正相关,两者共同阴性表达者生存时间明显优于阳性表达者,证实胆管癌细胞能够通过分泌CCL22诱导FOXP3+Tregs向肿瘤组织浸润,进而引起免疫状态下降,促进胆管癌的发生发展,并影响患者的生存时间。
[参考文献]
[1] 蒋水明,卢海明,刘雷,等.CCL22/CCR4信号通路在原发性肝癌局部免疫逃逸中的作用[J].中华肝胆外科杂志,2016,22(1):24-26.
[2] 王霆,徐凌,魏珏,等.活化的肝星状细胞通过CCL22/CCR4轴促进肝癌细胞侵袭能力[J].肝脏,2015,20(2):124-128.
[3] Alissafi T,Banos A,Boon L,et al. Tregs restrain dendritic cell atuophagy to ameliorate autoimmunity[J]. J Clin Invest,2017,127(7):2789-2804.
[4] Goral V. Cholangiocarcinoma: new insights[J]. Asian Pac J Cancer Prev,2017,18(6):1469-1473.
[5] Nagarsheth N,Wicha MS,Zou W. Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy[J]. Nat Rev Immunol,2017,17(9):559-572.
[6] Hou F,Huang QM,Hu DN,et al. Immune oppression array elucidating immune escape and survival mechanisms in uveal melanoma[J]. Int J Ophthalmol,2016,9(12):1701-1712.
[7] Wertel I,Sur wka J,Polak G,et al. Macrophage-derived chemokine CCL22 and regulatory T cells in ovarian cancer patients[J]. Tumor Biol,2015,36(6):4811-4817.
wka J,Polak G,et al. Macrophage-derived chemokine CCL22 and regulatory T cells in ovarian cancer patients[J]. Tumor Biol,2015,36(6):4811-4817.
[8] Li YQ,Liu FF,Zhang XM,et al. Tumor secretion of CCL22 activates intratumoral Treg infiltration and is independent prognostic predictor of breast cancer[J].PLoS One,2013,8(10):e76379.
[9] Martinenaite E,Munir Ahmad S,Hansen M,et al. CCL22-specific T cells:modulating the immunosuppressive tumor microenvironment[J]. Oncoimmunology,2016,5(11):e1238541.
[10] Sun J,Sun J,Song B,et al. Fucoidan inhibits CCL22 production through NF-κB pathway in M2 macrophages: a potential therapeutic strategy for cancer[J]. Sci Rep,2016,6:35855.
[11] 管彩虹,楼雅芳,赵凯,等.趋化因子CCL22诱导肺癌细胞转移中ERK/p38MAPK蛋白的表达[J].浙江医学,2014,36(23):1907-1909,1913.
[12] 张伟国,安伟德,苗鑫,等.胃癌腹膜乳斑转移与趋化因子CCL22及受体CC类趋化因子受体-4的关系[J].中华实验外科杂志,2013,30(6):1242-1244.
[13] 任贺,李鑫.转录因子FOXP3在不同肿瘤中的表达及功能研究进展[J].中国肿瘤临床,2017,44(10):508-514.
[14] 于丹军,樊静,胡月,等.妇科肿瘤患者外周血中调节性T细胞和血清中TGF-beta、IL-10的变化及相关性研究[J].河北医科大学学报,2016,37(11):1307-1311,1316.
[15] Hou J,Yu Z,Xiang R,et a1. Correlation between infiltration of FOXP3 regulatory T cells and expression of B7-H1 in the tumor tissues of gastric cancer[J]. Exp Mol Pathol,2014,96(3):284-291.
[16] 刘亚庆,赵博,罗亚东,等.转录因子FOXP3对人肺腺癌细胞A549增殖周期的影响及机制研究[J].中国免疫学杂志,2016,32(4):490-494.
[17] 杨永碧,赖琳.上调FOXP3抑制卵巢癌细胞Skov3侵袭和迁移及其机制的研究[J].中国免疫学杂志,2015,31(2):173-175,179.
[18] 刘文宣,杨磊,刘文聪,等.降钙素基因相关肽参与调节Th17和Treg细胞分化[J].河北医科大学学报,2017,38(3):326-330.
WANG Wen-bin1, LIU Bing2, LYU Hai-tao1, WANG Tian-yang1, ZHANG Teng-fei1, HE Wei1
(1.Departmentofhepatobiliary,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China;2.DepartmentofOncology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China)
[Abstract]ObjectiveTo investigate the expression of C-C class chemokines 22(CCL22) and the specific marker of regulatory T cells(Tregs) forkhead/winged helix transcription factor 3(FOXP3) and to analyze the correlation and the relationship with clinicopathological factors and prognosis in order to explore the effect of Tregs on tumor immunity in cholangiocarcinoma.MethodsThe expression of CCL22 and FOXP3 in 70 cases of cholangiocarcinoma and 15 cases of paracancer were detected by immunohistochemical staining.ResultsThe positive expression rates of CCL22 and FOXP3 in 70 cases of cholangiocarcinoma, 15 cases of non-tumor bile duct epithelium were 62.4%, 20.0% and 71.4%, 13.3%, respectively. There was a significant difference among different groups(P<0.01). The positive rates of CCL22 and FOXP3 were significantly higher in the stage Ⅲ+Ⅳ and lymph nodes metastasis patients than those in stage Ⅰ+Ⅱ and no lymph nodes metastasis patients(P<0.05). The expression of CCL22 was positively correlated with that of FOXP3(P<0.01). Moreover survival time of negative expression in CCL22 and FOXP3 patients was longer than that of positive expression in CCL22 and FOXP3 patients(P<0.01).ConclusionCCL22 and FOXP3 may have great influence on development and prognosis of cholangiocarcinoma.
[Key words]bile duct neoplasms; C-C class chemokines 22; forkhead/winged helix transcription factor 3
[收稿日期]2017-08-21;
[修回日期]2017-09-27
[作者简介]王文斌(1973-),男,河北保定人,河北医科大学第二医院副主任医师,医学博士,从事肝胆外科疾病诊治研究。
[中图分类号]R735.8
[文献标志码]A
[文章编号]1007-3205(2018)01-0019-05
(本文编辑:许卓文)