Table1ComparisonofindexessuchasGli1andGli2in4groups
杜媛鲲1,米 源2,陈 阁2,廖海江2,王 雷2*
(1.河北医科大学期刊社,河北 石家庄 050017;2.河北医科大学第四医院胸外二科,河北 石家庄 050011)
[摘要]目的探讨Gli促进肺腺癌A549细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)的分子学机制。方法Western blot法观察GANT61、N-Shh、GANT61&N-Shh分别处理A549细胞后对Gli1、Gli2、p-AKT、AKT、β-catenin和Vimentin蛋白表达的影响;侵袭实验观察GANT61、N-Shh、GANT61&N-Shh对肺腺癌细胞迁移侵袭能力的影响。结果GANT61&N-Shh组Gli1蛋白、Gli2蛋白、p-AKT蛋白、Vimentin蛋白、β-catenin蛋白及穿膜细胞数低于DMSO组和N-Shh蛋白组、高于GANT61组,N-Shh蛋白组高于DMSO组和GANT61组,GANT61组低于DMSO组,差异均有统计学意义(P<0.01);AKT蛋白各组间差异无统计学意义(P>0.05)。结论Gli1和Gli2表达上调可能通过PI3K/AKT途径促进肺腺癌A549细胞上皮-间质转化能力并最终促进细胞侵袭转移。
[关键词]肺肿瘤;上皮-间质转化;肿瘤转移
doi:10.3969/j.issn.1007-3205.2018.01.006
目前全世界肺癌是肿瘤致死性的首要病因,5年生存率只有19.3%。非小细胞肺癌占肺癌的85%,肺腺癌占到了非小细胞肺癌的大多数,且对放化疗不敏感并且容易复发和转移[1]。近年来研发的针对肺腺癌的靶向治疗如表皮生长因子受体(epithelial growth factor receptor,EGFR)酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitor,TKI)和ALK抑制剂等取得了革命性突破,改善了临床疗效,但伴随而来的耐药以及患者没有相关基因突变无法选择此类靶向药物等问题迫切需要我们探索和理解肿瘤的侵袭转移机制,以便找到更好的治疗方法[2-3]。Hedgehog(Hh)信号通路是近年来的研究热点,与皮肤癌[4]、结直肠癌[5]、肝癌[6]、乳腺癌[7]等多种肿瘤的发生发展及转移有关。Gli蛋白家族中存在 Gli1、Gli2、Gli3 3种转录因子。Gli作为Hh通路下游的核心组分在信号传导中发挥核心调控作用,但其调控肿瘤转移的分子机制尚未完全阐明。已有研究发现Gli1具有激活Hh通路的作用,是Hh通路重要的靶基因,Gli2具有转录激活Hh通路的作用,Gli3在Hh信号调节中起转录抑制作用[8-9]。
磷脂酰肌醇-3激酶(phosphatidvlinositol-3-kinases,PI3K)是一种使肌醇环第3位的羟基磷酸化的磷脂酰肌醇激酶。激活的PI3K使质膜上产生PIP3第二信使与AKT相互结合磷酸化AKT,使AKT从细胞膜转移到细胞质和细胞核从而调节下游靶蛋白,进而调控细胞的增殖、凋亡以及迁移等过程[10]。最近研究发现Hh靶基因的过表达与PI3K/AKT的激活相关。Ke等[11]研究发现在卵巢癌中Hh通路可以通过调控PI3K/AKT促进肿瘤侵袭转移。然而在肺腺癌中Hh/Gli与PI3K/AKT是否也存在相互关系进而影响肿瘤转移过程目前鲜见报道。因此,本研究通过观察肺腺癌细胞系A549细胞中的Gli1、Gli2与PI3K/AKT通路表达的关系初步探讨肿瘤的转移机制,旨在为肺腺癌的靶向治疗提供一个新思路。
1.1材料 人肺腺癌细胞系A549(由河北医科大学第四医院肿瘤研究所保存),RPMI-1640细胞培养液(美国Gibco公司),蛋白酶抑制剂(德国roche公司),M-PER培养细胞总蛋白提取试剂(美国热科学公司),Pierce-BCA 蛋白分析试剂盒(美国赛默飞公司),Mini-PROTEAN TGX 预制胶(美国伯乐公司),Tris/甘氨酸/电泳缓冲液(美国伯乐公司),ECL试剂(美国赛默飞世尔科技公司),Tris/甘氨酸/电泳缓冲液(美国伯乐公司),Gli1兔抗人多克隆抗体(美国abcam公司),Vimentin 鼠抗人单克隆抗体(美国abcam公司),AKT兔抗人单克隆抗体(美国cell signaling公司),p-AKT兔抗人单克隆抗体(美国cell signaling公司),Gli2鼠抗人单克隆抗体,β-catenin鼠抗人单克隆抗体(美国abcam公司),GAPDH鼠抗人单克隆抗体(美国santacruz公司),matrigel基质胶(美国BD公司),GANT61(美国Selleckchem公司),PVDF(上海百赛生物技术有限公司),N-Shh蛋白(美国EBioscience公司)。
1.2主要仪器 NanoDrop 8000全光谱紫外-可见光分光光度计(美国Thermo Scientific公司),ELX800多功能酶标仪(美国Bio-Tek公司),小型 Trans-Blot®转印槽(美国BIO-RAD公司),微量移液器(德国 Eppendorf 公司)
1.3方法
1.3.1细胞培养 肺腺癌细胞系A549培养于含有10%小牛血清的RPMI-1640培养基中,置于5%CO2、饱和湿度的37 ℃培养箱中培养,用含0.25%胰蛋白酶、0.02% EDTA的消化液消化细胞,每2~3 d传代1次。
1.3.2Western blot 取对数生长期细胞于培养液中培养,待其生长良好,设立4组:即DMSO组、GANT61组(10 μmol/L)、N-Shh蛋白组(0.5 g/L)以及GANT61&N-Shh组(10 μmol/L GANT61处理细胞30 min后0.5 mg/mL N-Shh处理细胞24 h)。于37 ℃、5% CO2的恒温培养箱中培养,24 h后将细胞从培养箱中取出,吸出培养基后用PBS洗涤细胞,0.25%胰蛋白酶消化细胞制成单细胞悬液。离心机1 000 r/min 离心5 min,吸出上清液后加入适量的M-PER培养细胞总蛋白提取试剂,收集每组样本的总蛋白裂解提取液采用BCA法测定样本的总蛋白浓度。将Tris/甘氨酸/电泳缓冲液加在Trans-Blot®转印槽中,样品上样,200 V,40 min环境下跑胶。100 V 40 min冰水浴环境下转至PVDF膜,TBST洗膜 10 min,3遍。室温用含5%脱脂奶粉的TBST液封膜1 h,加入对应一抗。一抗工作液浓度Gli1(1∶1 000)、Gli2(1∶250)、Vimentin(1∶8 000)、β-catenin(1∶5 000)、GAPDH (1∶20 000),于4 ℃摇床振荡过夜。第2天TBST洗膜3次,加入相应的羊抗兔或羊抗鼠二抗,工作液浓度均为1∶20 000,室温孵育1 h。TBST洗膜3次,于膜上加ECL试剂5 min,暗室X线曝光显影,Image软件对显影条带进行数据分析,实验重复3次。
1.3.3Transwell侵袭实验 将matrigel基质胶取出置于4 ℃的环境下待其融化,按照1∶4比例用培养基稀释后铺于聚碳酸酯膜上并放置于培养箱待固化。实验分为4组:DMSO组、GANT61组、N-Shh组、GANT61&N-Shh组。收集各组药物处理A549细胞24 h后的细胞,吹打为单细胞悬液重悬,在上室加入包含7.5×104个细胞的细胞悬液100 μL。下室加入含10%血清的培养液500 μL,注意防止大气泡的产生,于细胞培养箱中继续培养24 h。24 h后将Transwell从细胞培养小室取出,弃培养液, PBS 液洗涤3 次,棉签擦去上室的Matrigel胶以及尚未穿过膜的细胞, 4%多聚甲醛室温固定30 min,结晶紫染色20 min, PBS洗涤2次,倒置相差显微镜(×400)下随机选取5个视野观察并拍照,实验重复3次。
1.4统计学方法 应用SPSS 19.0统计软件处理数据,计量资料比较分别采用F检验和q检验。P<0.05为差异有统计学意义。
2.1Western blot结果 GANT61&N-Shh组Gli1蛋白、Gli2蛋白、p-AKT蛋白、Vimentin蛋白、β-catenin蛋白低于DMSO组和N-Shh蛋白组、高于GANT61组,N-Shh蛋白组高于DMSO组和GANT61组,GANT61组低于DMSO组,差异均有统计学意义(P<0.05);AKT蛋白各组间差异无统计学意义(P>0.05)。见表1。
Western-blot方法检测A549中Gli1、Gli2、AKT、p-AKT、Vimentin和β-catenin蛋白表达,见图1。
表14组Gli1、Gli2等指标比较
Table1ComparisonofindexessuchasGli1andGli2in4groups![]()
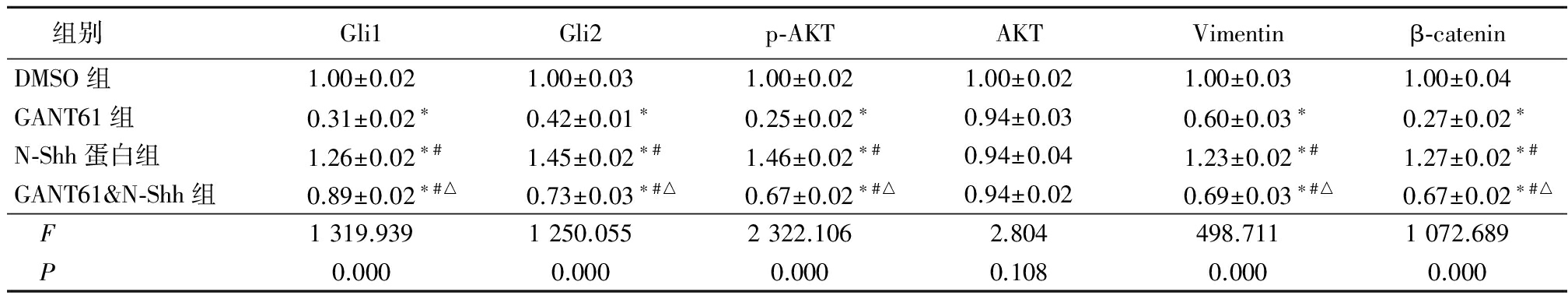
*P<0.01与DMSO组比较 #P<0.01与GANT61组比较 △P<0.01与N-Shh蛋白组比较(q检验)
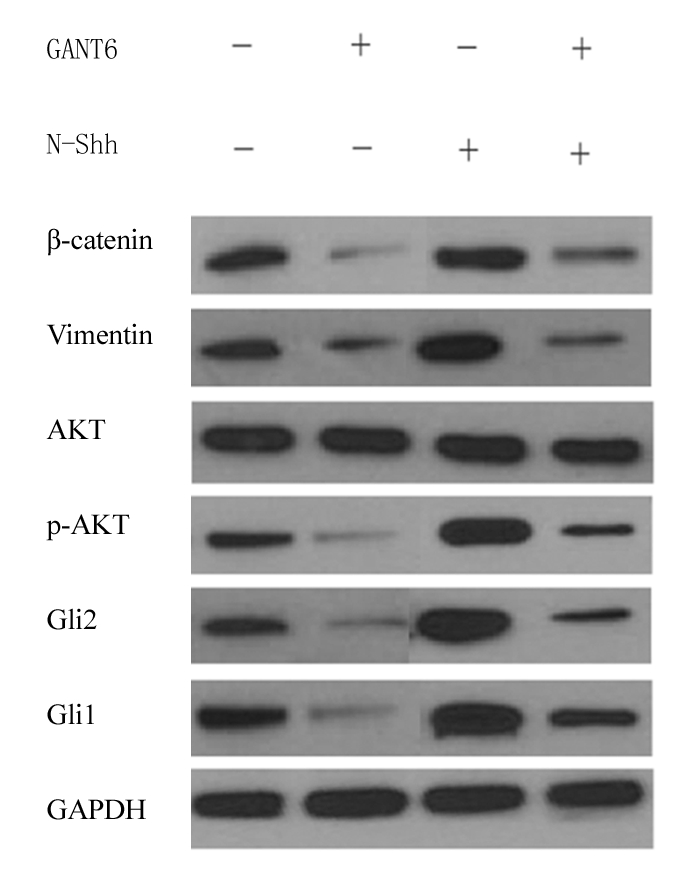
图1Western-blot方法检测A549中Gli1、Gli2、AKT、p-AKT、Vimentin和β-catenin蛋白表达
Figure1DetectionofGli1,Gli2,AKT,p-AKT,Vimentinandbeta-cateninproteinexpressioninA549byWestern-blotmethod
2.2Transwell侵袭实验各组穿膜细胞数比较 GANT61&N-Shh组穿膜细胞数少于DMSO组和N-Shh蛋白组、多于GANT61组,N-Shh蛋白组多于DMSO组和GANT61组,GANT61组少于DMSO组,差异均有统计学意义(P<0.05),见表2。
表24组穿膜细胞数比较
Table2Comparisonofthenumberofmembranecellsin4groups![]() 个)
个)
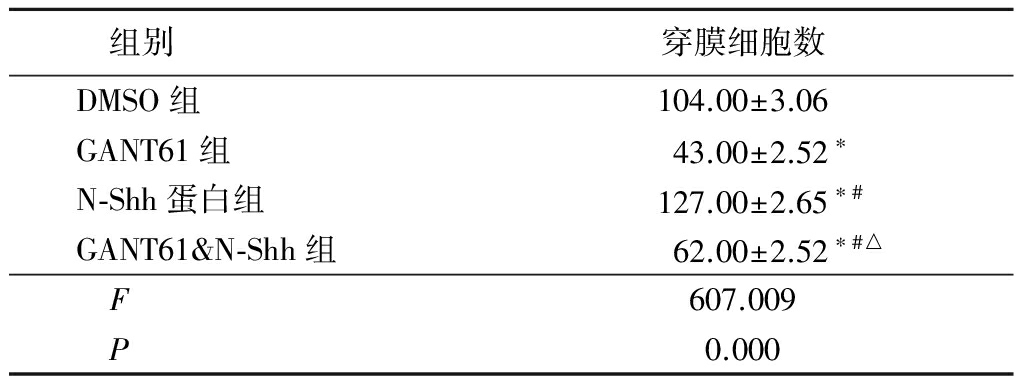
*P<0.01与DMSO组比较 #P<0.01与GANT61组比较 △P<0.01与N-Shh蛋白组比较(q检验)
Hh/Gli信号通路主要由Hh配体、跨膜蛋白受体Ptch、Smo、核转录调控子Gli以及下游靶基因等构成,当Hh配体与受体复合物结合后使Ptch失去了对Smo的抑制,进而释放出Gli蛋白,使得Gli蛋白以全长的形式进入细胞核内从而激活下游靶基因表达,促进细胞增殖、侵袭转移,导致肿瘤的发生发展。在Hh信号通路中,Smo抑制剂GDC-0449 (vismodegib)是最先被研究的Hh通路抑制剂并已经在美国应用于临床试验治疗基底细胞癌[12-13]。但由于存在不依赖Hh/Smo激活的非经典Hh通路,而Gli作为Hh下游通路的关键因子自然已成为了最近肿瘤靶向治疗的热点[14]。
PI3K/AKT通路是细胞中重要的信号传导通路,主要参与调控细胞的增殖分化、凋亡和转移等过程,通路中上游控制基因PTEN的缺失、下游关键因子AKT以及下游mTOR等磷酸化预示着较差的预后,抑制PI3K通路可以减弱肿瘤细胞的侵袭能力[15-17]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是胚胎发育、组织修复、肿瘤转移中的重要细胞机制[18-19],指上皮型细胞在特定的生理或病理情况下向间质型细胞表型转变的过程,在此转化过程中E-cadherin等上皮表型标志物丧失,而Vimentin、β-catenin等间质表型标志物表达上调,从而导致肿瘤细胞易于脱离原组织进入体循环而导致肿瘤转移。多项研究表明EMT现象被证实在胃癌、乳腺癌多种恶性肿瘤中存在,EMT相关标志物的异常表达与肿瘤的侵袭与转移密切相关[20-21]。Vimentin上调是EMT重要特征之一,它属于三型中间丝状体,在维持间质特性中发挥重要作用,其高表达可以降低细胞表面上皮钙黏素的数量和干扰上皮钙黏素介导的细胞黏附,导致肿瘤迅速演变为高侵袭性肿瘤[22]。β-catenin也被认为是EMT过程重要的标记物之一,研究发现在肝癌细胞中β-catenin与EMT过程呈正相关[23]。
本研究分别采用Gli1和Gli2的特异性抑制剂GANT61和Hh/Gli通路激活剂N-Shh蛋白观察Gli对A549的侵袭转移的影响,结果显示应用GANT61可以明显下调A549细胞的Gli1、Gli2、p-AKT、β-catenin和Vimentin蛋白表达,而AKT蛋白表达没有显著变化;采用N-Shh刺激Hh/Gli通路后可以显著上调肺腺癌细胞的Gli1、Gli2、p-AKT、β-catenin和Vimentin蛋白表达。为了能更好地了解Gli与PI3K通路的关系,本研究运用了救援实验,既先应用GANT61抑制Hh/Gli通路后再应用N-Shh活化Hh/Gli通路,结果发现与GANT61组相比,可以部分恢复Gli1、Gli2 、p-AKT、β-catenin、Vimentin等蛋白表达,表明Shh/Gli通路与PI3K /AKT通路之间可能存在“串连”关系。侵袭实验也进一步证实抑制Gli的表达可以下调肺腺癌细胞的侵袭能力,而刺激Shh/Gli通路可以明显促进肿瘤细胞侵袭转移能力,GANT61&N-Shh可以部分恢复肿瘤细胞的侵袭转移能力。其原因可能是在Shh信号通路中通过PI3K/AKT信号通路调控肺腺癌细胞的EMT过程,进而促进肺腺癌细胞的侵袭转移,Gli通过活化p-AKT进而上调β-catenin 、Vimentin蛋白表达促进肺腺癌细胞EMT过程,最终促进肿瘤细胞的侵袭转移。
总之,肺腺癌的EMT进程受多种转录因子以及多条信号转导通路相互作用的影响,本研究初步表明肺腺癌细胞中核转录因子Gli的异常活化可能通过PI3K /AKT信号通路影响细胞的EMT过程,从而影响细胞的侵袭转移。这种“串联”关系为肺腺癌的靶向治疗提供了新思路、新位点。但对于Gli调控肺腺癌的生物学行为的具体调节机制以及在临床中的进一步应用仍需进行深入的研究和探讨。
[参考文献]
[1] Guo T,Zhao S,Wang P,et al. YB-1 regulates tumor growth by promoting MACC1/c-Met pathway in human lung adenocarcinoma[J]. Oncotarget,2017,8(29):48110-48125.
[2] Yang X,Yang K,Kuang K. The efficacy and safety of EGFR inhibitor monotherapy in non-small cell lung cancer:a systematic review[J]. Curr Oncol Rep,2014,16(6):390.
[3] Rossi A,Maione P,Sacco PC,et al. ALK inhibitors and advanced non-small cell lung cancer (review)[J]. Int J Oncol,2014,45(2):499-508.
[4] Poggi L,Kolesar JM. Vismodegib for the treatment of basal cell skin cancer[J]. Am J Health Syst Pharm,2013,70(12):1033-1038.
[5] Gerling M,Büller NV,Kirn LM,et al. Stromal Hedgehog signalling is downregulated in colon cancer and its restoration restrains tumourgrowth[J]. Nat Commun,2016,7:12321.
[6] Dugum M,Hanouneh I,McIntyre T,et al. Sonic hedgehog signaling in hepatocellular carcinoma:a pilot study[J]. Mol Clin Oncol,2016,4(3):369-374.
[7] Wang X,Wei S,Zhao Y,et al. Anti-proliferation of breast cancer cells with itraconazole:hedgehog pathway inhibition induces apoptosis and autophagic cell death[J]. Cancer Lett,2017,385:128-136.
[8] Kim J,Kato M,Beachy PA. Gli2 trafficking links Hedgehog-dependent activation of Smoothened in the primary cilium to transcriptional activation in the nucleus[J]. Proc Natl Acad Sci U S A,2009,106(51):21666-21671.
[9] Stecca B,Ruiz IAltaba A. Context-dependent regulation of the GLI code in cancer by HEDGEHOG and non-HEDGEHOG signals[J]. J Mol Cell Bio,2010,2(2):84-95.
[10] 廖明娟,陈红风.PI3K/AKT/mTOR信号通路抑制剂在乳腺癌中的研究进展[J].中华肿瘤防治杂志,2012,19(3):230-234.
[11] Ke Z,Caiping S,Qing,Z,et al. Sonic hedgehog-Gli1 signals promote epithelial-mesenchymal transition in ovarian cancer by mediating PI3K/AKT pathway[J]. Med Oncol,2015,32(1):368.
[12] Sekulic A,Migden MR,Oro AE,et al. Efficacy and Safety of Vismodegib in Advanced Basal-Cell Carcinoma[J]. N Engl J Med,2012,366(23):2171-2179.
[13] Dlugosz A,Agrawal S,Kirkpatrick P. Vismodegib[J]. Nat Rev Drug Discov,2012,11(6):437-438.
[14] Hui CC,Angers S.Gli Proteins in Development and Disease[J]. Ann Rev Cell Dev Bio,2011,27:513-537.
[15] Majumder PK,Sellers WR. Akt-regulated pathways in prostate cancer[J]. Oncogene,2005,25(50):7465-7474.
[16] Amin H,Wani NA,Farooq S,et al. Inhibition of Invasion in Pancreatic Cancer Cells by Conjugate of EPA with beta(3,3)-Pip-OH via PI3K/Akt/NF-kB Pathway[J]. ACS Med Chem Lett,2015,6(10):1071-1074.
[17] Abraham J. PI3K/AKT/mTOR pathway inhibitors:the ideal combination partners for breast cancer therapies?[J]. Expert Rev Anticancer Ther,2015,15(1):51-68.
[18] Thiery JP,Acloque H,HuangRY,et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell,2009,139(5):871-890.
[19] Theveneau E,Marchant L,Kuriyama S,etal. Collective chemotaxis requires contact-dependent cell polarity[J]. Dev Cell,2010,19(1):39-53.
[20] Liu F,Gu LN,Shan BE,et al. Biomarkers for EMT and MET in breast cancer:an update[J]. Oncol Lett,2016,12(6):4869-4876.
[21] Wang B,Chen Q,Cao,Y,et al. LGR5 Is a Gastric Cancer Stem Cell Marker Associated with Stemness and the EMT Signature Genes NANOG,NANOGP8,PRRX1,TWIST1,and BMI1[J]. PLoS One,2016,11(12):e0168904.
[22] Roy LD,Sahraei M,Subramani DB,et al. MUC1 enhances invasiveness of pancreatic cancer cells by inducing epithelial to mesenchymal transition[J]. Oncogene,2011,30(12):1449-1459.
[23] Liu J,Ruan B,You N,et al. Downregulation of miR-200a induces EMT phenotypes and CSC-like signatures through targeting the beta-catenin pathway in hepatic oval cells[J]. PLoS One,2013,8(11):e79409.
DU Yuan-kun1, MI Yuan2, CHEN Ge2, LIAO Hai-jiang2, WANG Lei2*
(1.DepartmentofPeriodicalMagazine,HebeiMedicalUniversity,Shijiazhuang,Hebei050017,Chian; 2.DepartmentofThoracicSurgery,TheFourthHospitalofHebeiMedicalUniversity,Hebei050011,China)
[Abstract]ObjectiveTo explore the molecular mechanisms by which Gli transcription factor inhibitor regulates epithelial-mesenchymal transition(EMT) in Lung Adenocarcinoma.MethodsThe protein expression of Gli1, Gli2, p-AKT, AKT, Vimentin and β-catenin were observed by Western blot assay with respective treatment of GANT61, N-Shh, GANT61&N-Shh. Transwell assay were performed to detect cell invasion ability.ResultsGANT61&N-Shh group was lower than DMSO group and N-Shh protein group in expression of Gli1, Gli2, p-AKT, Vimentin and the number of membrane cells, and was higher than GANT61 group in the above indicators. N-Shh protein group was higher than DMSO group and GANT61 group. GANT61 group was lower than DMSO group,the difference was significant(P<0.01). AKT protein expression showed no significant difference among difference groups(P>0.05).ConclusionUp-regulated expression of Gli1 and Gli2 may promote epithelial mesenchymal transition and eventually promote cell invasion and metastasis of lung adenocarcinoma A549 cells through PI3K/AKT pathway.
[Key words]lung neoplasms; epithelial-mesenchymal transition; neoplasm metastasis
[收稿日期]2017-03-27;
[修回日期]2017-10-15
[基金项目]河北省引进留学人员资助项目(CY201613)
[作者简介]杜媛鲲(1980-),女,河北石家庄人,河北医科大学期刊社副编审,医学硕士,从事医学期刊编辑研究。
*通讯作者。E-mail:492850006@qq.com
[中图分类号]R734.2
[文献标志码]A
[文章编号]1007-3205(2018)01-0024-05
(本文编辑:刘斯静)