Table1EffectofSAMoncellgrowthcycleandapoptosisofSW620andLoVo
王 博1,李永才2,齐 蕾1,刘晓丽1,赵振亚1,许 欣1*
(1.河北省邢台市人民医院病理科,河北 邢台 054001;2.河北省邢台市人民医院CT/MRI科,河北 邢台 054001)
[摘要]目的研究甲基化修饰对结直肠癌(colorectal cancer,CRC)细胞体外生物学行为的影响及意义。方法外源性甲基供体药物S-腺苷甲硫氨酸(S-Adenosyl-L-methionine,SAM)处理CRC细胞株SW620和LoVo 6 d后,采用流式细胞术检测细胞生长、凋亡的变化,Tanswell方法观察体外细胞运动迁移能力、趋化侵袭能力的变化,平板克隆形成实验检测细胞克隆增殖能力的变化,从而分析SAM对细胞体外生物学行为的影响。S-腺苷高半胱氨酸(S-Adenosyl-L-homocysteine,SAH)为SAM的同型异构体,SAH组及磷酸盐缓冲液(phosphate buffer saline,PBS)组作为对照。结果SAM组SW620细胞周期G1%和LoVo细胞周期S%高于SAH组和PBS组(P<0.05) 。SAM组SW620 穿膜细胞数、LoVo穿膜细胞数、SW620穿胶细胞数和LoVo穿胶细胞数明显少于SAH组和PBS组(P<0.05)。SAM组SW620细胞克隆形成率和LoVo细胞克隆形成率明显小于SAH组和PBS组(P<0.05)。结论通过外源性甲基修饰能够减弱CRC细胞体外生物学行为能力,甲基供体类药物有望对CRC有疗效,并为其临床应用提供初步理论基础。
[关键词]结直肠肿瘤;甲基化;S-腺苷甲硫氨酸
doi:10.3969/j.issn.1007-3205.2018.01.020
结直肠癌(colorectal cancer,CRC)是最常见的消化系统恶性肿瘤之一,其全球及国内的发病率及病死率均处于上升趋势,且趋向年轻化[1-3],我国的临床流行病数据显示,CRC病死率居第4位,仅次于肺癌、胃癌和乳腺癌[4-5];尽管目前在CRC的诊疗上已取得长足进步,但预后效果仍有待提高,故需要人们通过不断研究寻找有效的治疗手段。近年来,肿瘤的表观遗传学研究对CRC的诊疗有深远的影响,人们已知DNA甲基化是表观遗传学中非常重要的基因调控机制,基因组整体的低甲基化存在于人类多种肿瘤中,导致促癌基因高表达[6-7]。目前S-腺苷甲硫氨酸(S-Adenosyl-L-methionine,SAM)是实验中广泛应用的外源性甲基化供体,可以提高细胞DNA的甲基化水平。因此,本研究用药物SAM高甲基化CRC细胞株,观察肿瘤细胞生长及凋亡、增殖、迁移、侵袭能力的变化,从而探讨甲基化对CRC细胞生物学行为的影响,旨在为甲基化用于CRC治疗的探索性研究奠定基础。
1.1实验材料 人类CRC细胞株SW620和LoVo购自ATCC;胎牛血清、RPMI-1640培养基、胰蛋白酶购自美国GIBCO公司;SAM购自Sigma-Aldrich公司;SAM的同型异构体S-腺苷高半胱氨酸(S-Adenosyl-L-homocysteine,SAH)购自NEB公司;Transwell迁移小室购自Corning公司,Transwell侵袭小室购自Chemicon公司。
1.2细胞培养与分组 将人类CRC细胞株SW620和LoVo放入37 ℃、5% CO2细胞培养箱内,使用含10% 胎牛血清的RPMI-1640 培养基培养,取用生长状态良好的细胞。待瓶内细胞生长覆盖率约90%后,用0.25%胰蛋白酶消化细胞,按5×105个细胞/100 mL培养瓶分别传代。传代细胞贴壁后,分别加入含100 mol/L和250 mol/L SAM的培养基处理细胞SW620和LoVo(SAM组),隔天更换含相同药物浓度的新鲜RPMI-1640培养液,培养6 d后收集细胞用于实验。实验对照组采用相同浓度SAH和磷酸盐缓冲液(phosphate buffer saline,PBS)处理细胞,即SAH组及PBS组。
1.3细胞周期检测 消化收集处理后的各组细胞,PBS冷液清洗2次,70%乙醇-20 ℃固定24 h后洗涤3次,依次加入250 μL胰蛋白酶缓冲液室温孵育10 min, 200 μL胰蛋白酶抑制剂和RNA酶缓冲液室温孵育10 min, 200 μL冷碘化丙啶暗处室温孵育;于1 h内上流式仪分析细胞DNA含量分布。
1.4Transwell小室体外迁移实验 Transwell小室的上下室之间以聚碳酸酯微孔膜分隔(孔径8.0 μm)。实验前将放置于-20 ℃冰箱储存的小室取出,置于培养箱中使之复温到37 ℃,在内室中加入300 μL无血清的RPMI-1640培养液,置于培养箱中孵育2 h,使ECMatrix层亲水。0.25%胰酶消化细胞,离心1 000 r/min×5 min,收集细胞,正常培基重悬细胞沉淀后离心1 000 r/min×5min,再用正常培基重悬细胞沉淀,室温下放置15 min,再用无血清培基洗涤细胞2次,每次收集细胞均是1 000 r/min×10 min,最后用无血清的RPMI-1640培养液重悬细胞,调整细胞数为(0.5~1.0)×106cells/mL。小心吸出内室中培养液,加500 μL含10%小牛血清的培养液于外室中,加300 μL 细胞悬液于内室中,37 ℃、5% CO2培养箱中培养24 h。取出小室,弃培养液,用棉签擦掉未穿过膜的细胞。D-Hanks 液洗小室3次,甲醇固定15 min,Giemsa染色30 min,用蒸馏水轻轻地冲洗数次,空气中风干。在200倍显微镜下随机选取5 个视野计数穿过微孔膜的细胞数,取其均值代表浸润力量值。每组设3个复孔。
1.5Transwell小室体外侵袭实验 Transwell小室(B&D公司)的上下室之间以聚碳酸酯微孔膜分隔(孔径8.0 μm),膜上包被人工基底膜胶(Matrigel),评价肿瘤细胞的侵袭能力。实验前将-20 ℃冰箱储存的小室取出置于培养箱中复温至37 ℃后,操作步骤及计数方式同上述Transwell小室体外迁移实验。
1.6平板克隆形成实验 生长状态良好的培养细胞,用 D-Hanks 液洗3次,0.25%胰酶消化,细胞悬液反复吹打,使细胞充分分散,接种100个细胞到6 孔培养板中,每组细胞接种3复孔,培养箱中培养2 周。出现肉眼可见的细胞克隆时终止培养,弃去培养液,PBS清洗2次,空气内干燥;甲醇固定15 min,弃甲醇后空气内干燥;用Giemsa染色15 min,流水缓慢洗去染液,空气内干燥;显微镜下对每组细胞3个孔形成的克隆计数,≥50个细胞为1个克隆,取其均值,平板克隆形成率=形成克隆数/接种细胞数×100%。
1.7统计学方法 应用SPSS 13.0统计学软件分析数据,计量资料比较分别采用单因素方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2.1SAM对细胞周期及凋亡的影响 SW620细胞株中,SAM组SW620细胞周期G1%高于SAH组和PBS组,差异有统计学意义 (P<0.05),显示
药物SAM使SW620细胞在G1期出现了阻滞。LoVo细胞株中,SAM组LoVo细胞周期S%高于SAH组和PBS组,差异有统计学意义(P<0.05),表明药物SAM使LoVo细胞出现了S期阻滞。SAH和PBS组SW620细胞周期G1%和LoVo细胞周期S%差异无统计学意义(P>0.05)。2种细胞流式分析结果中均未见到细胞凋亡峰的存在,表明SAM未导致细胞凋亡的出现。见表1,图1。
表1SAM对SW620及LoVo细胞周期、凋亡的影响
Table1EffectofSAMoncellgrowthcycleandapoptosisofSW620andLoVo![]()
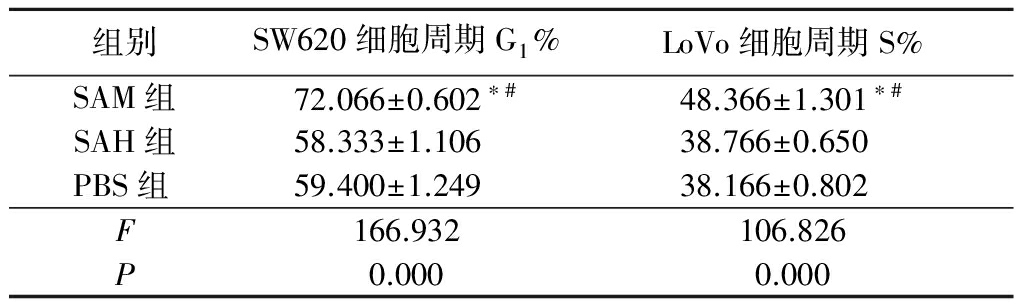
*P<0.05与SAH组比较 #P<0.05与PBS组比较(LSD-t检验)
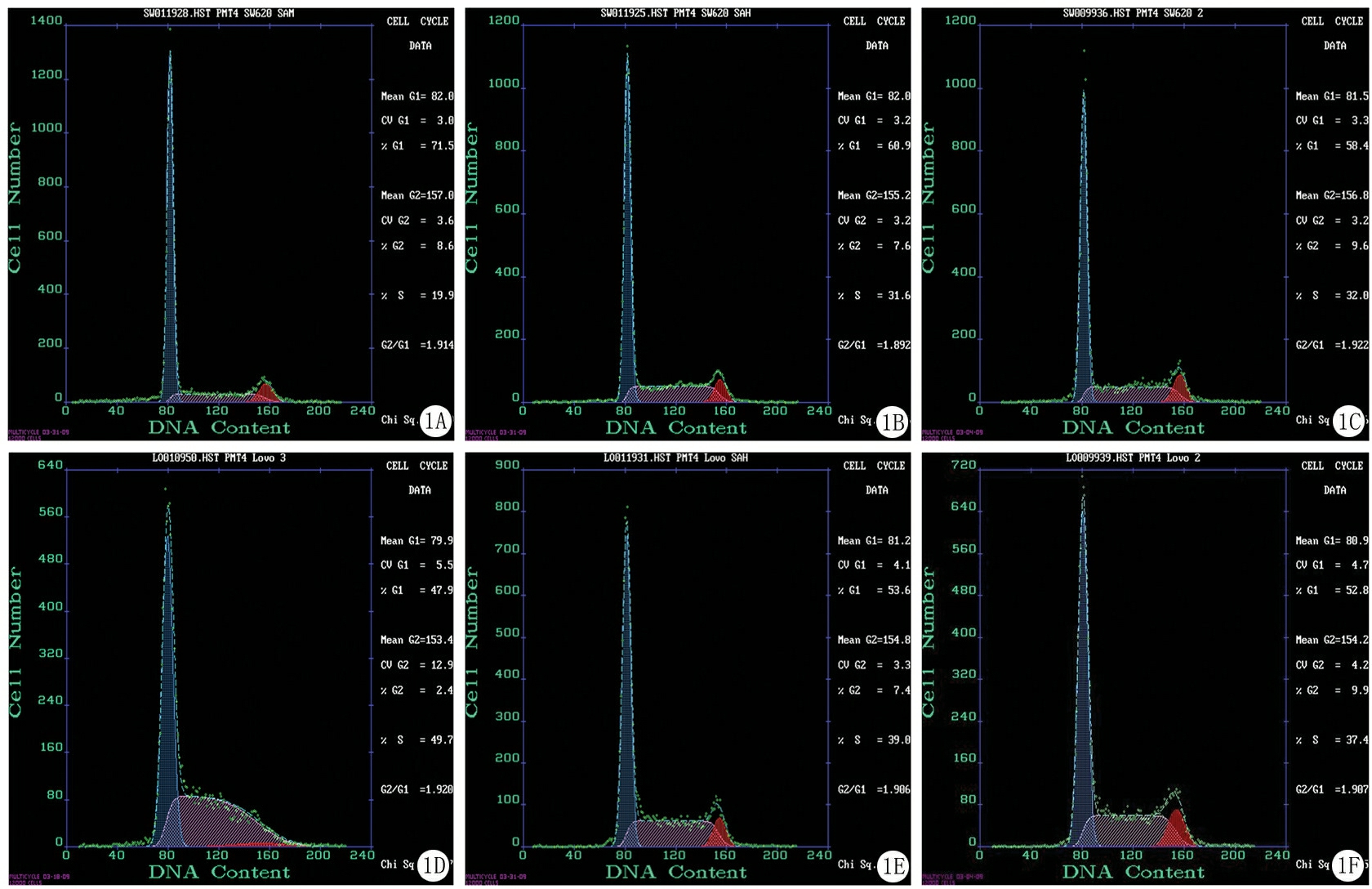
图1SAM对SW620及LoVo细胞周期、凋亡的影响
A.SAM处理SW620细胞组;B.SAH处理SW620细胞组;C.PBS处理SW620细胞组;D.SAM处理LoVo细胞组;E.SAH处理LoVo细胞组;F.PBS处理LoVo细胞组
Figure1EffectofSAMoncellgrowthcycleandapoptosisofSW620andLoVo
2.2SAM对细胞迁移能力和侵袭能力的影响 细胞接种到小室24 h 后,将穿过8 μm 微孔的细胞计数5个高倍视野检测细胞迁移能力。结果显示,SAM组SW620 穿膜细胞数和LoVo穿膜细胞数显著低于SAH组和 PBS组,差异有统计学意义(P<0.05),SAH组和PBS组SW620穿膜细胞数和LoVo穿膜细胞数差异无统计学意义(P>0.05)。细胞接种到小室24 h 后,将穿过包被有人工基底膜胶的8 μm 微孔的细胞计数5个高倍视野检测细胞侵袭能力。结果显示,SAM组SW620 穿胶细胞数和LoVo穿胶细胞数显著低于SAH组和 PBS组,差异有统计学意义(P<0.05),SAH组和PBS组SW620穿胶细胞数和LoVo穿胶细胞数差异无统计学意义(P>0.05)。表明SAM能够显著降低CRC细胞的体外迁移及侵袭能力。见表2,图2。
表2SAM对SW620及LoVo细胞迁移、侵袭能力的影响
Table2EffectofSAMoncellmigrationandinvasionofSW620andLoVo![]() 个)
个)
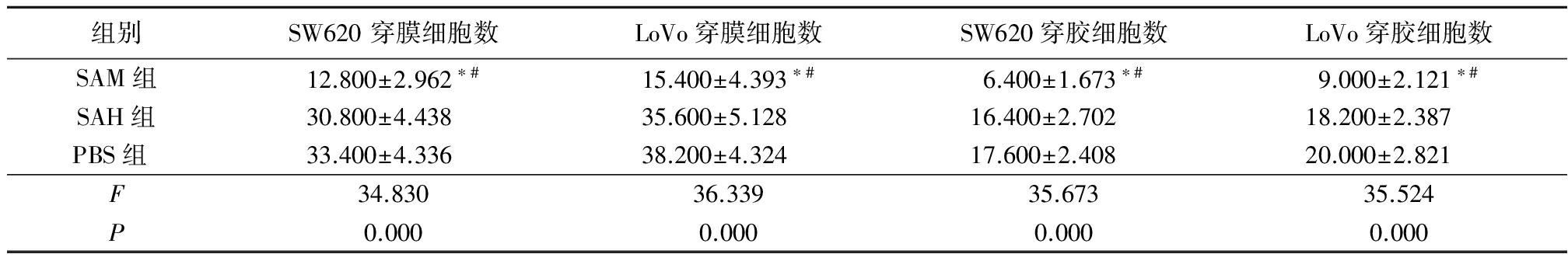
*P<0.05与SAH组比较 #P<0.05与PBS组比较(LSD-t检验)
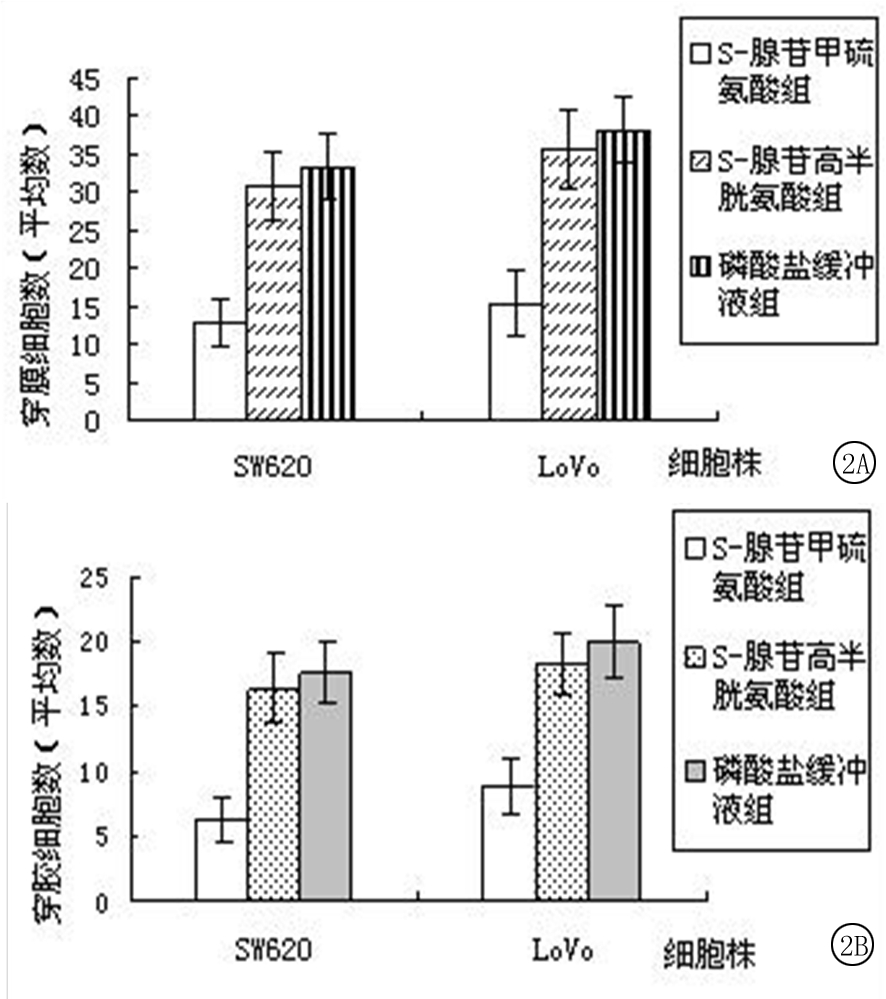
图2SAM处理对SW620和LoVo细胞的迁移能力、侵袭能力的影响
A.迁移能力;B.侵袭能力
Figure2EffectofSAMoncellmigrationandinvasionofSW620andLoVo
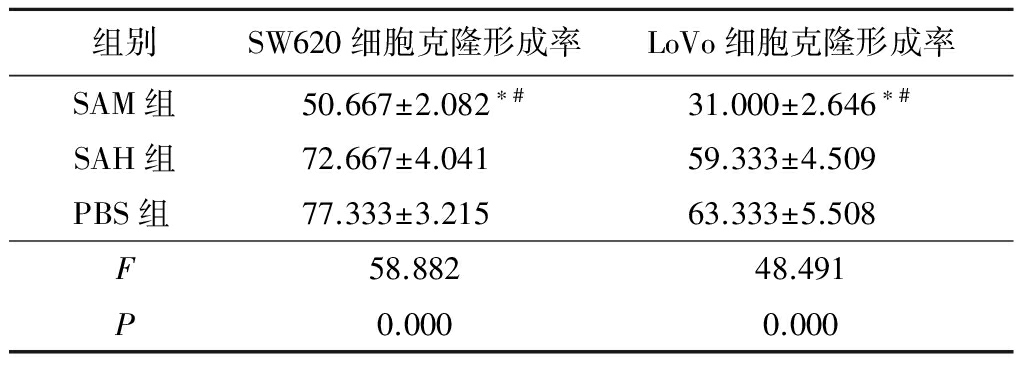
2.3SAM对细胞克隆形成的影响 平板克隆实验统计结果显示,SAM组SW620细胞克隆形成率和LoVo细胞克隆形成率明显小于SAH组和PBS组,差异有统计学意义(P<0.05),SAH组和PBS组SW620细胞克隆形成率和LoVo细胞克隆形成率差异无统计学意义(P>0.05)。说明SAM处理能够降低CRC细胞的体外增殖速度。见表3,图3。
表3SAM对SW620及LoVo细胞平板克隆形成的影响
Table3EffectofSAMonPlatecolonyformationefficiencyofSW620andLoVo![]()
*P<0.05与SAH组比较 #P<0.05与PBS组比较(LSD-t检验)
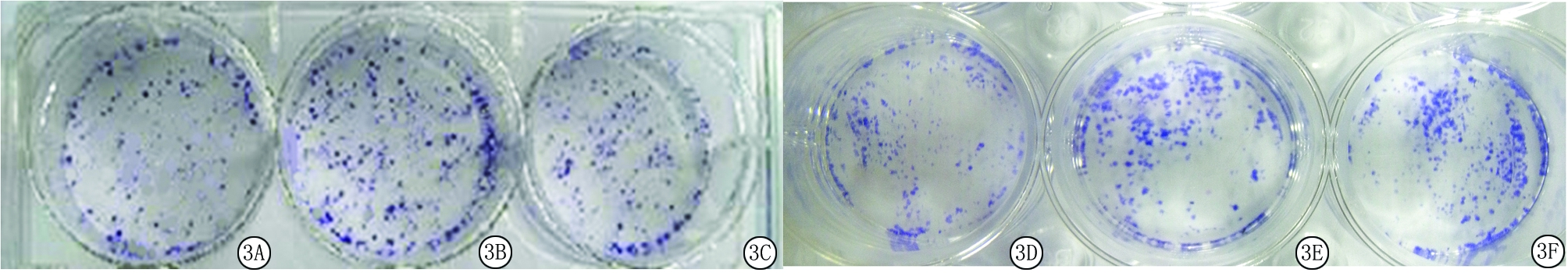
图3SAM处理对SW620和LoVo细胞克隆形成能力的影响
A.SAM组处理SW620细胞;B.SAH组处理SW620细胞;C.PBS组处理SW620细胞;D.SAM组处理LoVo细胞;E.SAH组处理LoVo细胞;F.PBS组处理LoVo细胞
Figure3EffectofSAMonplatecolonyformationefficiencyofSW620andLoVo
目前各种调控细胞功能的癌基因和抑癌基因与恶性肿瘤发生发展的关系越来越受到人们的关注。DNA甲基化是基因表达的重要调控机制之一,高甲基化与基因的表达沉默、功能丧失有关,低甲基化则与基因表达的恢复或增高密切相关,目前大量研究发现,几乎所有的肿瘤细胞中均存在着DNA甲基化紊乱,这种变化普遍表现为整个基因组的低甲基化和局部区域CpG岛的高甲基化。其中低甲基化主要通过活化促癌基因,增加染色体不稳定性,遗传印记丢失,促进了正常分裂增殖的细胞向癌细胞转变,尤其促进了肿瘤的发生、发展和转移[8-10];而局部区域CpG岛的高甲基化主要为启动子区域CpG岛的高甲基化,可使一些抑癌基因表达受限甚至沉默[11-12],也促进了肿瘤的发生、发展和转移。DNA甲基化属于一种共价修饰,即不涉及核苷酸序列变化的可遗传的基因表达方式的改变,在 DNA 甲基转移酶作用下完成,故而高甲基化和低甲基化之间是可逆的动态过程[13]。
DNA异常甲基化不仅发生于恶性肿瘤的早期,更存在于其发展的整个过程,在发病机制中起了关键的作用;对DNA异常甲基化的研究可以更加深入地了解到恶性肿瘤的发病机制,为今后早期诊治、预后判断等提供了更为可靠的依据[14]。同时,表观遗传学修饰的可逆性特征使其能够作为肿瘤预防、治疗的新靶点,进而成为研究热点。
之前的研究多集中在抑癌基因启动子的高甲基化状态研究,并通过药物逆转高甲基化状态,恢复其表达和功能,至今已取得大量成果[13]。但随着DNA甲基化状态对肿瘤形成及发展中作用的深入研究发现,在肿瘤发生、发展过程中DNA低甲基化比高甲基化更为常见,基因组的低甲基化和部分促癌基因由于启动子低甲基化而高表达,在肿瘤的进展过程中起到了重要的作用,并且基因组的低甲基化随着细胞恶性程度的增加而愈加明显,同时与其组织分型、肿瘤分级和病理分期相关,是病情诊断的重要指标之一[12,15];人机体内蛋氨酸的代谢产物SAM为一碳循环提供了甲基,继而影响着全基因组DNA甲基化程度,体内甲基供体的缺乏,往往引起基因组甲基化水平的紊乱,导致全基因组低甲基化[16]。因此,在人们研究药物治疗肿瘤中提出了一种思路,即用甲基化药物为肿瘤治疗提供新方案。利用DNA低甲基化状态的可逆特性,通过甲基化药物提供甲基供体来增加基因甲基化的概率或抑制脱甲基作用,逆转肿瘤基因组整体的低甲基化状态,使之高甲基化,进而抑制促癌基因的表达,增加染色体稳定性,防止遗传印记丢失,从而抑制肿瘤的形成、生长和侵袭。己有研究成功通过外源性甲基供体SAM高甲基细胞DNA,实现了在乳腺癌、前列腺癌及肝癌中抑制某些在肿瘤进展和转移过程中起重要作用的促癌基因过表达,进而抑制该肿瘤的侵袭和转移,逆转了肿瘤细胞的恶性表型;同时也证实了外源性的SAM能够直接抑制去甲基化酶的作用,从而提高细胞的甲基化水平。但目前对基因组的低甲基研究相对较少,试图用逆转这一状态来治疗肿瘤的研究更是寥寥无几。
基于上述理论及研究成果,本研究使用甲基供体药物SAM处理CRC细胞,作为外源性甲基供体提高CRC细胞的甲基化水平,初步研究甲基化修饰对CRC细胞体外生物学行为的影响,并初步探讨临床应用的可行性。药物SAH是SAM的同型异构体,但不具有甲基基团,故无甲基化作用,在实验中SAH组细胞作为对照,可以排除SAM药物从甲基化作用外的其他方面对细胞产生影响。实验结果表明药物SAM明显阻滞了CRC细胞体外生长周期中某一阶段,明显减弱了CRC细胞体外运动迁移及侵袭能力、克隆增殖能力,具有抑制CRC细胞体外生物学行为的作用,其中PBS组和SAH组细胞数据差异无统计学意义,进一步说明SAM对癌细胞的抑制作用是通过SAM提供甲基供体、甲基化细胞DNA实现的。恶性肿瘤特殊表现为肿瘤细胞的无限制生长、直接侵袭能力及远处转移能力。因此,抑制肿瘤细胞无限制的增殖、侵袭和转移是治疗肿瘤的有效方法。本研究通过SAM高甲基化DNA抑制了CRC细胞体外生长、增殖、侵袭和迁移能力,从CRC方面支持了SAM类甲基化药物治疗肿瘤的可行性理论,对临床CRC的治疗应用有着积极意义,同时提供了研究的新方向。
同时也引发了一些新的思考:DNA高甲基化对CRC细胞体外生物学行为具有抑制作用,但机体是一个复杂的、多系统网状互联的机能综合体,DNA高甲基化对CRC细胞体内生物行为是否能起到抑制作用,在机体内众多天然屏障及互联机制的影响下,DNA高甲基化抑制CRC细胞的能力是否还能实现,是否会导致机体其他功能的变化,抑或是出现不利的结果,均值得进一步探讨。甲基化类物质是使DNA非特异性的甲基化,不能忽视基因的选择性问题。因此,揭示DNA甲基化机制的基本规律,寻找疾病相关的特定甲基化调节机制,对于疾病的早期预防、诊断,对于研发特异性较强的去甲基化或甲基化药物以及应用于治疗方面的工作任重而道远,这也将成为下一步实验研究的重点。
[参考文献]
[1] 曹红旗,席金川,王飞飞,等.结直肠癌骨转移临床特点的Meta分析[J].河北医科大学学报,2017,38(9):1041-1044,1067.
[2] 吴晨鹏. microRNA在结直肠肿瘤中的研究进展[J].河北医科大学学报,2013,34(3):370-372.
[3] Chen W,Zheng R,Zhang S,et al. Report of cancer incidence and mortality in China,2010[J]. Ann Transl Med,2014,2(7):61.
[4] Du LB,Li HZ,Wang YQ,et al. Report of cancer incidence and mortality in China,2013[J]. Zhonghua Zhong Liu Za Zhi,2017,39(9):701-706.
[5] 李道娟,梁迪,靳晶,等.河北省40年结直肠癌发病和死亡分析[J].中国癌症杂志,2017,27(3):212-218.
[6] Hashimoto Y,Zumwalt TJ,Goel A. DNA methylation patterns as noninvasive biomarkers and targets of epigenetic therapies in colorectal cancer[J]. Epigenomics,2016,8(5):685-703.
[7] Skowronski K,Andrews J,Rodenhiser DI,et al. Genome-wide analysis in human colorectal cancer cells reveals ischemia-mediated expression of motility genes via DNA hypomethylation[J]. PLoS One,2014,9(7):e103243.
[8] Veltri RW,Christudass CS. Nuclear morphometry,epigenetic changes,and clinical relevance in prostate cancer[J]. Adv Exp Med Biol,2014,773:77-99.
[9] Araújo OC,Rosa AS,Fernandes A,et al. RASSF1A and DOK1 promoter methylation levels in hepatocellular carcinoma,cirrhotic and non-cirrhotic liver,and correlation with liver cancer in brazilian patients[J]. PLoS One,2016,11(4):e0153796.
[10] 魏绍峰,张爱华.DNA低甲基化及其与肿瘤关系的研究进展[J].癌变·畸变·突变,2016,28(3):243-245,249.
[11] Fan Z,Ze Y. DNA methylation of prostate cancer and clinical application[J]. Yi Chuan,2014,36(5):420-30.
[12] 常江,王颖,柳利,等.IGF2BP3低甲基化与结肠癌组织分化的关系[J].天津医药,2015,43(6):642-645.
[13] Chik F,Machnes Z,Szyf M. Synergistic anti-breast cancer effect of a combined treatment with the methyl donor S-adenosyl methionine and the DNA methylation inhibitor 5-aza-2′-deoxycytidine[J]. Carcinohenesis,2014,35(1):138-144.
[14] 何倩,王邈,孟静岩.DNA甲基化与大肠癌相关性的研究[J].天津中医药大学学报,2016,35(6):361-365.
[15] Timp W,Bravo HC,McDonald OG,et al. Large hypomethylated blocks as a universal defining epigenetic alteration in human solid tumors[J]. Genome Med,2014,6(8):61.
[16] Luo WP,Du YF,Huang J,et al. Effect of peripheral bloodgenomic DNA methylation on the relationship between methyl donor status and risk of breast cancer[J]. Zhonghua Liu Xing Bing Xue Za Zhi,2017,38(4):537-541.
WANG Bo1, LI Yong-cai2, QI Lei1, LIU Xiao-li1, ZHAO Zhen-ya1, XU Xin1*
(1.DepartmentofPathology,XingtaiPeople′sHospital,HebeiProvince,Xingtai054001,China; 2.DepartmentofCT/MRI,XingtaiPeople′sHospital,HebeiProvince,Xingtai054001,China)
[Abstract]ObjectiveTo explore the effects and significances of methylated modification on the biological behaviors of colorectal cancer(CRC) cell lines SW620 and LoVo in vitro.MethodsSW620 and LoVo were treated with S-Adenosyl-L-methionine(SAM) for six days. Then the flow cytometry assay was used to assessed the changes of cell growth cycle and apoptosis,the transwell assay was used to detect the changs of cell invasion and migration, the plate colony assay was used to testify the changes of cell colony-formation ability, thereby to study the effects of SAM on the biological behaviors of CRC cells. S-Adenosyl-L-homocysteine(SAH)-treated cells and phosphate buffer saline(PBS)-treated cells were used as control groups in the study.ResultsCompared with either SAH-treated cell groups or PBS- treated ones, the cell cycle of SW620 cell cycle G1% and LoVo cell cycle S% in SAM group were higher than that in SAH group and PBS group(P<0.05). Compared with SAH- treated cells and PBS- treated ones, the mean cell numbers of SW620 and LoVo treated with SAM were all significantly less than that in SAH group and PBS group through the microporous membrane or the matrigel, the difference is statistically significant(P<0.05). The colony-formation rates of SW620 and LoVo treated with SAM were significantly lesser than that treated with SAH and PBS(P<0.05).ConclusionThe exogenous methylation agent can inhibit biological behaviors of CRC cells in vitro. Methylated donor drugs are expected to be effective in the clinical treatment of CRC and provide a preliminary theoretical basis for its clinical application.
[Key words]colorectal neoplasms; methylation; S-Adenosy-L-methionine
[收稿日期]2017-09-26;
[修回日期]2017-10-19
[基金项目]邢台市科技计划项目(2016ZC296)
[作者简介]王博(1984-),女,河北邢台人,河北省邢台市人民医院主治医师,医学硕士,从事病理学诊断研究。
* 通讯作者。E-mail:xx7766@sina.com
[中图分类号]R735.34
[文献标志码]A
[文章编号]1007-3205(2018)01-0091-06
(本文编辑:赵丽洁)