慢性肾脏病不同分期矿物质异常的横断面研究
常立欣,张东雪
(河北医科大学第四医院肾内科,河北 石家庄 050011)
[摘要]目的分析慢性肾脏病(chronickidney diseases,CKD)1~5期患者矿物质及骨代谢异常的现状,探讨影响CKD矿物质及骨代谢异常的影响因素。方法将收治的179例非透析患者根据肾小球滤过率进行CKD分期:CKD1期43例、CKD2期24例、CKD3期27例、CKD4期38例、CKD5期47例。比较CKD1~5期患者血磷、血钙、钙磷乘积、全段甲状旁腺素(immunoreactive parathyroid hormone,iPTH)和碱性磷酸酶(alkaline phosphatase,ALP)水平,并评估钙磷代谢异常的相关影响因素。结果CKD3期患者iPTH水平明显高于CKD1期患者(P<0.05);CKD4期患者iPTH水平明显高于CKD1、2、3期患者,血磷、钙磷乘积、ALP水平均明显高于CKD1期患者(P<0.05);CKD5期患者iPTH、血磷、钙磷乘积水平均明显高于CKD1、2、3、4期,ALP水平较明显高于CKD1、2期患者(P<0.05)。相关性分析结果显示,血磷水平与iPTH、钙磷乘积、ALP呈正相关(P<0.05),与GFR呈负相关(P<0.05)。多元线性回归分析结果显示,钙磷乘积、iPTH、GFR、ALP是血磷升高的影响因素(P<0.05)。结论矿物质及骨代谢异常是CKD常见并发症,且随疾病进展不断加重。血磷与CKD进程、钙磷乘积、iPTH、ALP密切相关。
[关键词]肾病;钙;磷
doi:10.3969/j.issn.1007-3205.2018.01.021
矿物质和骨代谢异常是慢性肾脏病(chronickidney diseases,CKD)患者,尤其是终末期肾脏病患者常见的并发症,矿物质和骨代谢异常可引起骨病与血管钙化,还可引起免疫力降低,引起肺、血管、心肌及心脏瓣膜等钙化,进而导致心血管事件的高发,严重影响患者的生存质量[1-3]。因此,维持甲状旁腺激素水平及钙磷代谢平衡在合适范围已经成为改善CKD患者生存质量的重要方法[4]。本研究对CKD1~5期患者矿物质与骨代谢异常进行相关性分析,旨在为CKD1~5期非透析患者的诊断治疗提供依据。现报告如下。
1 资 料 与 方 法
1.1一般资料 选取2015年12月—2016年12月河北医科大学第四医院收治的CKD患者179例。入选标准:①均符合美国肾脏病预后质量倡议(Kidney Disease Outcomes Quality Initiative,K/DOQI)关于CKD定义的标准[5];②肾脏损伤(病理学检查、影像学检查、血或尿成分异常)≥3个月;③均未进行血液透析或腹膜透析。排除标准:①正在参与干预性临床试验的患者;②意识障碍等无法获得知情同意的患者;③肝硬化、艾滋病病毒感染或艾滋病者;④近1年内肿瘤复发或正在接受放化疗的患者;⑤6个月内接受免疫抑制剂治疗的患者;⑥骨髓或器官移植的患者。根据肾小球滤过率(glomerular filtration rate,GFR)分为CKD1期43例[男性20例,女性23例;平均年龄(47.13±7.46)岁,平均病程0.3(0.2,7.3)个月;原发病为原发性肾小球肾炎16例、糖尿病肾病8例、缺血性肾病2例、急性肾损伤5例、ANCA相关性小血管炎肾损害4例、狼疮性肾炎2例、紫癜性肾炎2例、高血压肾损害3例、其他1例]、CKD2期24例[男性12例,女性12例;平均年龄(50.5±25.1)岁,平均病程1.5(0.2,14.5)个月;原发病为原发性肾小球肾炎11例、糖尿病肾病6例、缺血性肾病1例、急性肾损伤2例、ANCA相关性小血管炎肾损害2例、紫癜性肾炎1例、高血压肾损害1例]、CKD3期27例[男性13例,女性14例;平均年龄(49±15.9)岁,平均病程6.5(0.6,24.7)个月;原发病为原发性肾小球肾炎11例、糖尿病肾病7例、缺血性肾病1例、急性肾损伤2例、ANCA相关性小血管炎肾损害1例、狼疮性肾炎2例、紫癜性肾炎2例、高血压肾损害1例]、CKD4期38例[男性20例,女性18例;平均年龄(54.38±15.28)岁,平均病程0.3(0.1,3.0)个月;原发病为原发性肾小球肾炎13例、糖尿病肾病8例、缺血性肾病2例、急性肾损伤4例、ANCA相关性小血管炎肾损害4例、狼疮性肾炎3例、紫癜性肾炎1例、高血压肾损害2例、其他1例]、CKD5期47例[男性27例,女性20例;平均年龄(53.96±13.19)岁,平均病程1.2(0.2,34.3)个月;原发病为原发性肾小球肾炎18例、糖尿病肾病9例、缺血性肾病2例、急性肾损伤5例、ANCA相关性小血管炎肾损害4例、狼疮性肾炎3例、紫癜性肾炎2例、高血压肾损害3例、其他1例]。各期性别、年龄、病程差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2检测指标 抽取患者清晨空腹血进行血液检测,检测项目包括血磷、血钙、钙磷乘积、血肌酐、全段甲状旁腺素(immunoreactive parathyroid hormone,iPTH)、碱性磷酸酶(alkaline phosphatase,ALP)。将空腹血3 000 r/min离心15 min分离血清样本,应用全自动生化仪检测血磷、血钙、血肌酐、ALP,采用酶联免疫法检测iPTH。根据K/DIGO指南[5]推荐,分别对血磷和血钙水平进行评估和指导临床治疗。对于血磷,建议CKD1~4期患者控制在0.81~1.45 mmol/L,CKD5期及进入透析的患者控制在1.31~1.78 mmol/L。对于血钙,建议CKD1~4期患者控制在实验室正常指标范围内,而CKD5期及进入透析的患者控制在2.10~2.37 mmol/L。根据K/DOQI建议,iPTH控制范围:CKD3期iPTH<70 ng/L,CKD4期iPTH<110 ng/L,CKD5期iPTH为100~300 ng/L。
1.3统计学方法 应用SPSS 17.0统计学软件分析数据。计量资料非正态分布时以M(Q1,Q3)表示,多组间比较采用秩和检验;相关性采用Pearson相关分析;影响因素确定采用多元线性回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1CKD1~5期患者iPTH、血钙、血磷、钙磷乘积、ALP指标比较 CKD3期患者iPTH水平明显高于CKD1期患者(P<0.05);CKD4期患者iPTH水平明显高于CKD1、2、3期患者,血磷、钙磷乘积、ALP水平明显均高于CKD1期患者(P<0.05);CKD5期患者iPTH、血磷、钙磷乘积水平均明显高于CKD1、2、3、4期,ALP水平明显高于CKD1、2期患者(P<0.05)。各期患者血钙水平差异无统计学意义(P>0.05)。CKD1~3期患者血磷、钙磷乘积、ALP水平差异均无统计学意义(P>0.05)。见表1。
表1各期iPTH、血钙、血磷、钙磷乘积、ALP比较[M(Q1,Q3)]
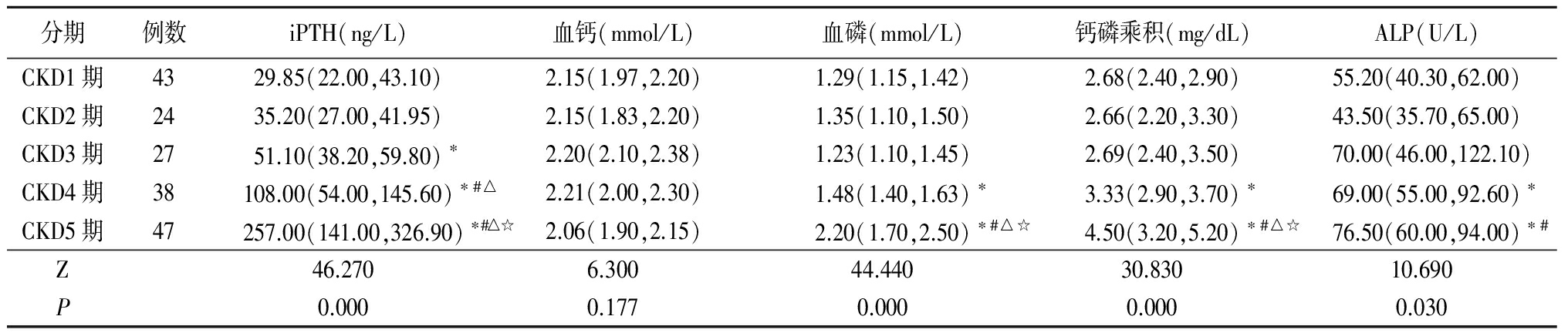
分期例数iPTH(ng/L)血钙(mmol/L)血磷(mmol/L)钙磷乘积(mg/dL)ALP(U/L)CKD1期4329.85(22.00,43.10)2.15(1.97,2.20)1.29(1.15,1.42)2.68(2.40,2.90)55.20(40.30,62.00)CKD2期2435.20(27.00,41.95)2.15(1.83,2.20)1.35(1.10,1.50)2.66(2.20,3.30)43.50(35.70,65.00)CKD3期2751.10(38.20,59.80)∗2.20(2.10,2.38)1.23(1.10,1.45)2.69(2.40,3.50)70.00(46.00,122.10)CKD4期38108.00(54.00,145.60)∗#△2.21(2.00,2.30)1.48(1.40,1.63)∗3.33(2.90,3.70)∗69.00(55.00,92.60)∗CKD5期47257.00(141.00,326.90)∗#△☆2.06(1.90,2.15)2.20(1.70,2.50)∗#△☆4.50(3.20,5.20)∗#△☆76.50(60.00,94.00)∗#Z46.2706.30044.44030.83010.690P0.0000.1770.0000.0000.030
*P<0.05与CKD1期比较 #P<0.05与CKD2期比较 △P<0.05与CKD3期比较 ☆P<0.05与CKD4期比较(秩和检验)
2.2血磷与临床指标的相关因素分析 Pearson相关分析结果显示,血磷水平与iPTH、钙磷乘积、ALP呈正相关(r=0.572、0.830、0.318,P<0.05),与GFR呈负相关(r=-0.315,P<0.05)。
2.3血磷升高的影响因素分析 以血磷为因变量,以iPTH、钙磷乘积、ALP、GFR为自变量进行多元线性回归分析,结果显示钙磷乘积、iPTH、GFR、ALP是血磷升高的影响因素(P<0.05),见表2。
表2血磷与各因素相关性的多元线性回归分析
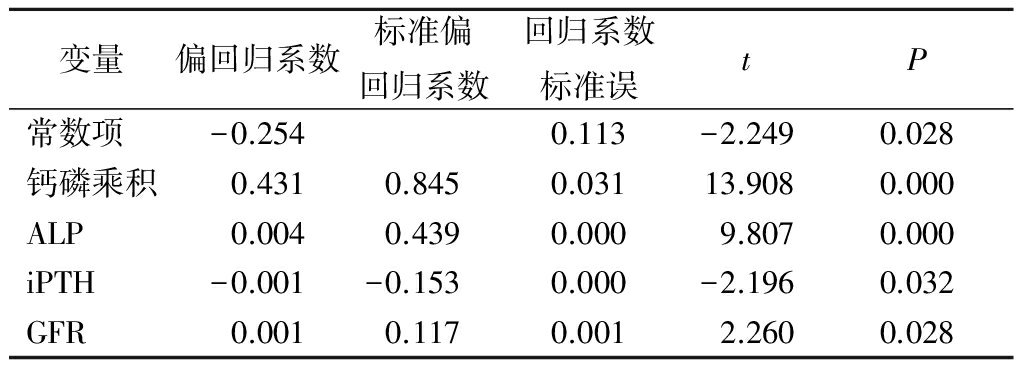
变量偏回归系数标准偏回归系数回归系数标准误tP常数项-0.2540.113-2.2490.028钙磷乘积0.4310.8450.03113.9080.000ALP0.0040.4390.0009.8070.000iPTH-0.001-0.1530.000-2.1960.032GFR0.0010.1170.0012.2600.028
3 讨 论
2002年美国国家肾脏病基金会提出CKD的定义和分期以来,CKD的概念已经得到广泛的接受和认可,有关CKD的研究亦取得了很大进展[6-7]。有研究显示,CKD发病率已超过10%,且CKD发病率呈持续增长趋势。CKD患者如果得不到及时有效的治疗,很可能持续进展恶化,并最终进入终末期肾脏病。所以,需对CKD患者做到定期监测、及时治疗[8]。钙磷代谢异常是CKD患者常见并发症,且随疾病进展不断加重[9]。CKD患者早期,随着肾单位的失功,血iPTH水平即开始升高,血磷、血钙、ALP水平亦开始发生变化,由于钙磷代谢异常和甲状旁腺功能亢进引起的骨病即可出现[10-11]。此外,高磷血症和增高的钙磷乘积以及高iPTH血症可以进一步导致软组织钙化、心脑血管钙化以及增加心脑血管事件的风险,严重影响了CKD患者的预后及生存质量[12-13]。
既往有研究表明,随着CKD进展,矿物质和骨代谢异常会进一步加重,血磷、钙磷乘积、iPTH水平逐渐升高,血钙水平逐渐降低[14]。本研究结果显示,当患者进入CKD3期时便出现iPTH升高,与CKD1期比较明显上升(P<0.05);进入CKD4期时,血磷及钙磷乘积水平逐渐升高,CKD4期患者iPTH水平较CKD1、2、3期明显上升(P<0.05),CKD4期血磷、钙磷乘积、ALP水平较CKD1期明显上升(P<0.05);当进入CKD5期时,通常会表现出明显的高磷血症及高iPTH,CKD5期患者血磷、钙磷乘积、iPTH水平明显高于CKD1、2、3、4期(P<0.05),CKD5期ALP水平明显高于CKD1、2期(P<0.05);各期血钙差异无统计学意义。其矿物质代谢异常的趋势与既往研究一致。
另外,也有研究发现当CKD患者GFR降至正常水平的20%~30%时,残余的肾单位不能够维持体内磷的正常代谢,会导致高磷血症[15]。而高磷血症会导致残存肾单位的解剖和功能进一步损害,继而发生肾性骨病、继发性甲状旁腺功能亢进、心脑血管钙化以及血流动力学异常等[16-18]。本研究结果显示,血磷水平与iPTH、钙磷乘积、ALP呈正相关,与GFR呈负相关;钙磷乘积、iPTH、GFR是血磷升高的影响因素。认为随着GFR下降,一方面血钙浓度降低、血磷浓度及钙磷乘积升高,可以刺激甲状旁腺分泌iPTH增多;而另一方面由于高血磷可以刺激纤维母细胞,使其生长因子(fibroblastgrowth factor-23,FGF-23)生成增加,从而抑制1α羟化酶的活性,使1,25(OH)2维生素D3的生成减少以及iPTH的分泌增多,由于iPTH作用于骨,进而使钙磷释放增多,加重高磷血症,导致恶性循环。ALP与血磷独立相关,ALP是反映骨形成特异和敏感的指标,通过水解磷脂而释放无机磷,使局部磷浓度增加,从而促进骨的矿化,有利于骨的形成。血清ALP的主要来源是肝和骨骼,排除肝脏疾病,血清ALP可作为骨代谢的生物化学标记物。有研究表明CKD患者的骨代谢生物化学标志物会随血肌酐下降而明显升高[19]。随着CKD的进展,ALP亦会逐渐增高并大量水解磷脂,而大量释放磷入血,使血磷浓度升高。研究表明高磷血症是CKD患者矿物质代谢异常的中心环节,有效控制高磷血症是防止CKD进展的关键[20]。目前治疗高磷血症的途径主要有3种:控制饮食中磷的摄入、应用磷结合剂、血液净化[21-22]。对于CKD1~5期未进入血液透析的患者,适于应用磷结合剂以及控制饮食中磷的摄入,并定期监测血磷,以控制血磷升高并预防并发症的发生。
综上所述,影响血磷水平的因素为钙磷乘积、ALP、GFR、iPTH。高磷血症作为CKD患者的常见并发症之一,需联合饮食控制、药物治疗才能有效控制CKD患者体内的血磷水平。定期监测血磷、钙磷乘积、ALP、GFR及iPTH水平,并将其控制在理想范围,对于延缓CKD进程、调整矿物质和骨代谢异常是非常重要的。
[参考文献]
[1] 王金宝,张金玉,周健美,等.维持性血液透析患者钙、磷、iPTH代谢异常的调查分析[J].实用医学杂志,2016,32(2):333-334.
[2] 盛燕群,申飞梅.高通量血液透析在慢性肾脏病——矿物质和骨异常中的应用及护理[J].中外医学研究,2015,13(22):152-153,154.
[3] 李贺,代文迪,刘文虎.慢性肾脏病非透析患者矿物质骨代谢紊乱的研究[J].中国医师杂志,2016,18(2):195-198.
[4] 马欣,王小琴,韩四萍.慢性肾脏疾病3~5期矿物质异常的横断面研究[J].临床肾脏病杂志,2014,14(3):141-145.
[5] Riella MC. Kidney disease:improving global outcomes(KDIGO)CKD word group.KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease[J]. Kidney International Supplements,2013,3(1):1-150.
[6] 谢院生,郑法雷,董捷,等.慢性肾脏病非透析治疗[J].中国医院用评价与分析杂志,2016,16(1):3-6.
[7] 郭玮,潘柏申.从K/DOQI 2002到KDIGO 2012慢性肾脏疾病诊疗指南中实验室检测项目相关应用建议的解读[J].检验医学,2015,30(7):663-667.
[8] 任雅臣,田少云,尹智炜,等.慢性肾病患者危险因素分析[J].临床荟萃,2013,28(3):304-305.
[9] Vikrant S,Parashar A. Prevalence and severity of disordered mineral metabolism in patients with chronic kidney disease:a study from a tertiary care hospital in India[J]. Indian J Endocrinol Metab,2016,20(4):460-467.
[10] 马春园,苑雪莹,刘婧怡,等.慢性肾脏病——矿物质及骨代谢紊乱的单中心横断面研究[J].中华肾脏病杂志,2015,31(5):333-338.
[11] 余毅,郭芳.CKD患者血管钙化与钙磷代谢紊乱[J].中国中西医结合肾病杂志,2015,16(10):847-850.
[12] Chen W,Melamed ML. Vascular calcification in predialysis CKD:common and deadly[J]. Clin J Am Soc Nephrol,2015,10(4):551-553.
[13] G rriz JL,Molina P,Cerver
rriz JL,Molina P,Cerver n MJ,et al. Vascular calcification in Patients with nondialysis CKD over 3 years[J]. Clin J Am Soc Nephrol,2015,10(4):654-666.
n MJ,et al. Vascular calcification in Patients with nondialysis CKD over 3 years[J]. Clin J Am Soc Nephrol,2015,10(4):654-666.
[14] Martínez-Castelao A,G rriz JL,Portolés JM,et al. Baseline characteristics of patients with chronic kidney disease stage 3 and stage 4 in Spain:the MERENA observational cohort study[J]. BMC Nephrol,2011,12:53.
rriz JL,Portolés JM,et al. Baseline characteristics of patients with chronic kidney disease stage 3 and stage 4 in Spain:the MERENA observational cohort study[J]. BMC Nephrol,2011,12:53.
[15] Yoon SJ,Park S,Park C,et al. Association of soluble receptor for advanced glyeation end-product with increasing central aortic stiffness in hypertensive patients[J]. Coron Artery Dis,2012,23(2):85-90.
[16] Torres PA,De Broe M. Calcium-sensing receptor,calcimimetics,and cardiovascular calcifications in chronic kidney disease[J]. Kidney Int,2012,82(1):19-25.
[17] 朱金荣,张枫,张晓宇,等.血液透析患者钙磷代谢紊乱现状及影响因素分析[J].中国血液净化,2015,14(8):478-481.
[18] Hu MC,Shiizaki K,Kuro-o M,et al. Fibroblast growth factor 23 and Klotho:physiology and pathophysiology of an endocrine network of mineral metabolism[J]. Annu Rev Physiol,2013,75:503-533.
[19] 杨洁,康建国,吕艳伟,等.慢性肾脏病骨矿物质代谢和骨转换生物化学标志物临床分析[J].中国医药,2016,11(6):868-873.
[20] 王文伟,田露露,熊艳文,等.慢性肾脏病血管钙化小鼠模型的建立[J].河北医科大学学报,2017,38(3):253-257.
[21] 李婷婷,樊蓉.血液透析合并高磷血症患者饮食护理的研究现状[J].中国血液净化,2016,15(6):382-384.
[22] 钟桂芳,冯瑛华,冯婉华,等.如何控制透析患者的血磷增高[J].饮食保健,2016,3(19):197.
[收稿日期]2017-05-03;
[修回日期]2017-06-01
[作者简介]常立欣(1973-),女,河北藁城人,河北医科大学第四医院主管护师,医学学士,从事临床护理学研究。
[中图分类号]R692
[文献标志码]B
[文章编号]1007-3205(2018)01-0097-04
(本文编辑:赵丽洁)


 rriz JL,Molina P,Cerver
rriz JL,Molina P,Cerver