戴琳琳,崔 颖
(河北省石家庄市中医院急诊科,河北 石家庄 050051)
[摘要]目的探讨低分子肝素治疗对ICU脓毒症患者凝血功能、炎症反应以及免疫功能的影响。方法将脓毒症患者72例根据随机数字表法分为对照组和观察组各36例。对照组给予常规治疗,观察组在常规治疗基础上给予低分子肝素钙皮下注射7 d。比较2组治疗前后急性生理学和慢性健康状况Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHE Ⅱ)评分、炎症因子、凝血指标、免疫指标、ICU住院时间、28 d病死率及不良反应发生率。结果治疗后,2组APACHEⅡ评分、C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白细胞介素6(interleukin 6,IL-6)均呈降低趋势,血小板计数(platelets,PLT)均呈升高趋势,观察组APACHEⅡ评分、CRP、PCT、IL-6低于对照组,PLT明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。2组凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05)。治疗后7 d,对照组血清超氧化物歧化酶(superoxide dismutase,SOD)低于治疗前、丙二醛(malondialdehyde,MDA)高于治疗前、观察组SOD高于治疗前、MDA低于治疗前、观察组SOD高于对照组、MDA低于对照组(P<0.05)。2组平均ICU住院时间、28 d病死率、不良反应发生率差异均无统计学意义(P>0.05)。结论低分子肝素能明显降低脓毒症患者的炎症反应,防止凝血系统异常激活,对微循环具有明显改善作用,减慢了多器官功能衰竭的发生速度,不良反应较轻,建议临床推广应用。
[关键词]脓毒症;肝素,低分子量;凝血功能;炎症反应
doi:10.3969/j.issn.1007-3205.2018.01.022
脓毒症为创伤、休克以及严重感染等疾病常见的并发症,当机体对病原微生物及其产物失去控制时会发生炎症反应,导致脓毒症的发生,使组织受到破坏以及脏器功能受损[1]。脓毒症是危重症患者的主要死亡原因,这是因为一部分患者不能及时诊断而缺乏适宜的治疗。研究者为了使诊治效果得到改善一直在寻找能特异性反映炎症特征和敏感性的生物标志物,但这些尝试均未成功;有研究探讨脓毒症促炎和抗炎因子之间的平衡关系与临床并不完全相符,使绝大多数抗炎治疗失败[2]。脓毒症的发病机制主要包括炎症反应失控、免疫功能紊乱、凝血功能障碍导致血液高凝状态,其相互作用产生了一系列复杂的反应过程[3]。在脓毒症的发生和发展过程中,凝血功能的异常活化起到重要作用,是导致脓毒血症引起多脏器功能不全的主要原因。低分子肝素抗血栓能力较强,作用快速并持久,能有效改善血流动力学指标,其半衰期明显长于普通肝素,生物利用度高,出血风险低,已被广泛应用于临床[4]。本研究对我院ICU收治的72例脓毒症患者进行分组比较,观察低分子肝素治疗脓毒症的临床效果,现报告如下。
1.1一般资料 选择2014年5月—2015年5月我院收治的脓毒症患者72例,根据随机数字表法分为观察组和对照组各36例。观察组男性19例,女性17例,年龄23~75 岁,平均(56.17±3.22) 岁;入ICU时平均急性生理学和慢性健康状况Ⅱ(Acute Physiology and Chronic Health Evaluation,APACHE Ⅱ)评分(18.75±3.24)分;原发疾病:急性肺部感染9例,败血症6例,多发伤5例,化脓性胆管炎4例,急性胰腺炎3例,尿路感染3例,肝脓肿2例,其他脓毒症4例。对照组男性19例,女性17例,年龄21~72 岁,平均年龄(55.82±3.95) 岁;入ICU时平均APACHEⅡ评分(19.16±3.67)分;原发疾病:急性肺部感染8例,败血症7例,多发伤6例,化脓性胆管炎3例,急性胰腺炎4例,尿路感染2例,肝脓肿3例,其他脓毒症3例。2组性别、 年龄、入ICU时APACHEⅡ评分、原发疾病差异均无统计学意义(P>0.05),具有可比性。
纳入标准(符合以下2个或2个以上临床特征的全身炎症反应综合征可判断为脓毒症):①体温≥38 ℃或≤36 ℃;②心率≥90次/min;③呼吸频率≥20 次/min,或动脉二氧化碳分压≤32 mmHg,或借助呼吸机;④白细胞计数≥12×109/L或≤4×109/L,或未成熟中性粒细胞百分比>10%。排除标准:①之前使用过肝素而导致血小板减少的患者;②有出血倾向,血小板计数(platelets,PLT)<30×109/L,且与凝血功能障碍有相关性;③患急性细菌性心内膜炎者;④妊娠、哺乳期妇女;⑤存在活动性出血的患者;⑥颅脑外伤、脑出血较为严重的患者,脑动脉瘤、动静脉畸形及消化道出血者;⑦免疫功能障碍属于原发性和在发病前已给予免疫抑制治疗的患者。
本研究经医院伦理委员会通过,取得患者及其家属同意并签署知情同意书。所有患者的临床资料均保密,保护患者的隐私权。
1.2方法 对照组给予常规治疗,对原发基础疾病给予积极对症处理,在疾病早期给予广谱抗生素控制感染,给予液体复苏,纠正水电解质紊乱和维持酸碱平衡,积极预防应激性溃疡,积极控制血压和血糖,保护脏器功能,给予合理营养,实施病原学相关检查,对肝肾功能、血气分析、血乳酸,血糖、血常规、凝血功能等进行密切监测。观察组在常规治疗基础上,给予低分子肝素钙,又称天普洛宁(广东天普生化医药股份有限公司,0.6 mL/支)皮下注射,每日1次,0.3 mL/次,共治疗7 d。
1.3评价指标 比较2组治疗前及治疗后3 d、7 d APACHEⅡ评分;比较2组C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)及血清白细胞介素6(interleukin 6,IL-6)、PLT、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time APTT)、纤维蛋白原(fibrinogen,FIB)、血清超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)变化;比较2组ICU住院时间、28 d病死率以及不良反应发生率。APACHEⅡ评分主要包括急性生理学、年龄以及慢性健康状况等3项内容,共14条参数,最高71分,分值越高说明病情越重。
1.4统计学方法 应用SPSS 20.0统计学软件分析数据。计量资料比较分别采用成组设计的t检验、配对t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
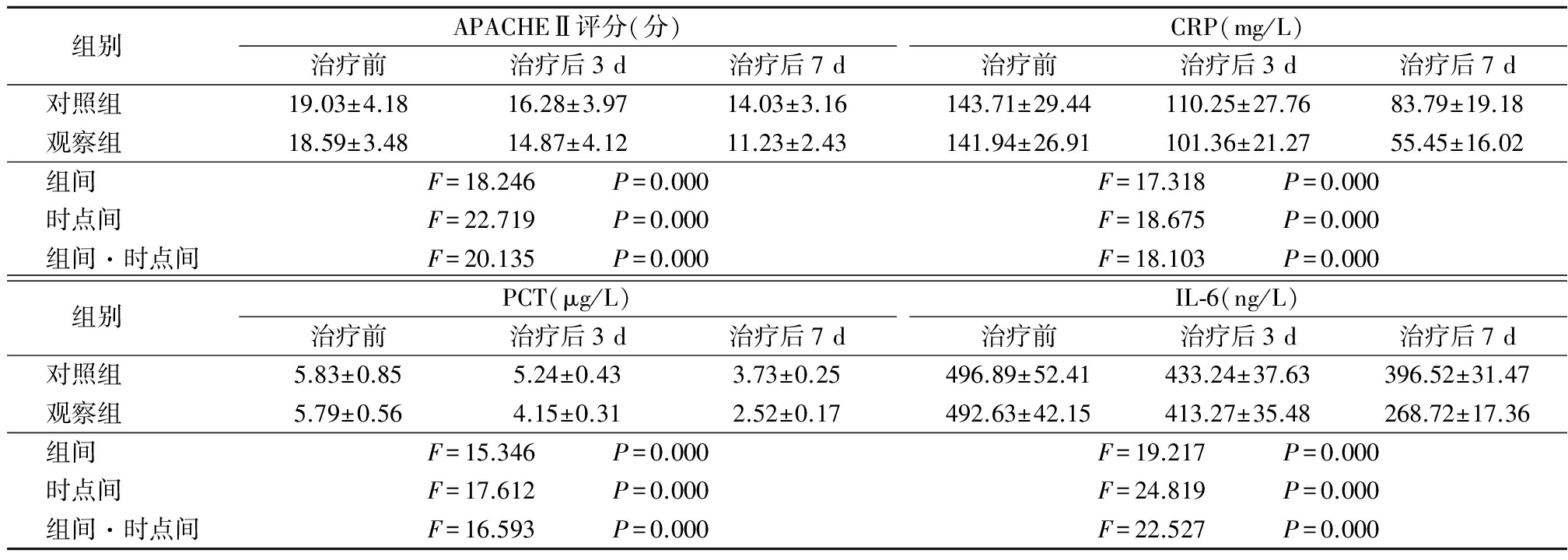
2.12组治疗前后APACHEⅡ评分、相关炎症指标比较 治疗后,2组APACHEⅡ评分、CRP、PCT、IL-6均呈降低趋势,且观察组低于对照组,其组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表1。
表12组治疗前后APACHEⅡ评分、相关炎症指标比较![]()
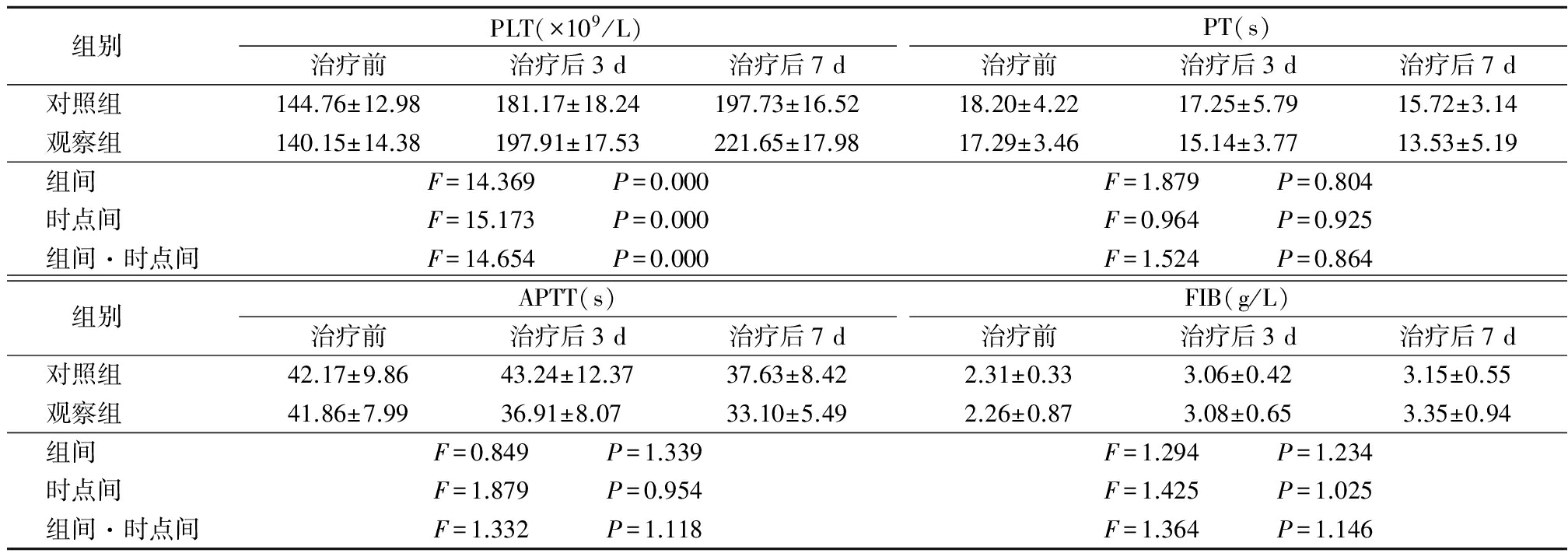
2.22组治疗前后PLT、凝血功能指标比较 治疗后,2组PLT均呈升高趋势,且观察组PLT明显高于对照组,其组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。2组PT、APTT、FIB组间、时点间、组间·时点间交互作用差异均无统计学意义(P>0.05)。见表2。
表22组治疗前后PLT、凝血功能指标比较![]()
2.32组治疗前后免疫功能比较 治疗前2组SOD、MDA水平差异均无统计学意义(P>0.05);治疗后7 d,对照组SOD低于治疗前、MDA高于治疗前,观察组SOD高于治疗前、MDA低于治疗前,观察组SOD高于对照组、MDA低于对照组,差异均有统计学意义(P<0.05)。见表3。
表32组治疗前后免疫功能比较![]()
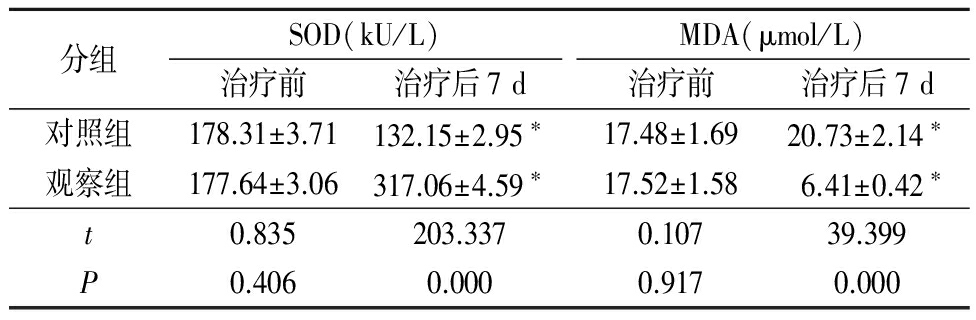
*P<0.05与治疗前比较(配对t检验)
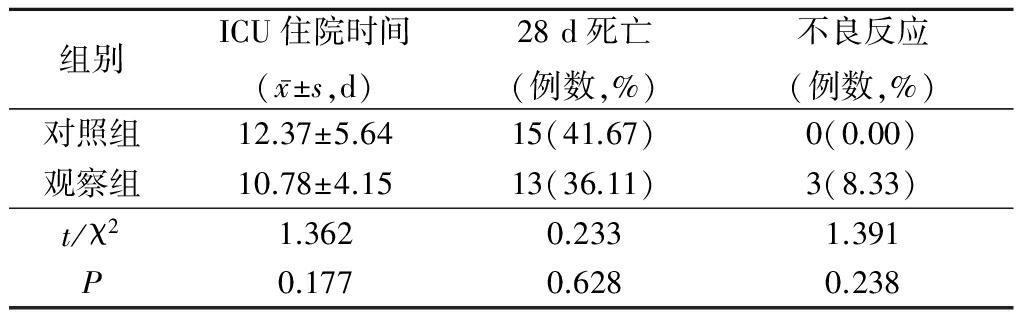
2.42组ICU住院时间、28 d病死率及不良反应发生率比较 2组平均ICU住院时间、28 d病死率、不良反应发生率差异均无统计学意义(P>0.05),见表4。
观察组出现黑便2例,穿刺部位出现皮下淤斑1例,经对症处理后症状均逐渐消失,未见其他严重不良反应。
表42组ICU住院时间、28d病死率及不良反应发生率比较(n=36)
脓毒症的炎症反应使凝血系统受到破坏,消耗内源性抗凝因子,抑制纤溶活性,导致微循环血栓产生,因而使组织缺氧、器官功能不全[5]。炎症细胞和炎症因子不仅对血管内皮细胞具有损伤作用,阻止内皮细胞表面与血流接触,使生理性抗凝机制遭到破坏;还能够促进组织因子释放,异常激活外源性凝血机制,凝血系统被激活后又进一步加剧炎症反应[6]。这个过程反复循环,使抗凝物质不断消耗而衰竭,凝血和抗凝之间的平衡关系受到严重干扰,最终凝血机制发生严重异常,如果器官发生功能障碍和血流动力学障碍可导致脓毒症加重或脓毒性休克,并进一步发展为多脏器功能不全和多脏器功能衰竭,最终死亡[7]。
以往临床常采用广谱抗生素等常规方案治疗脓毒症,虽取得一定成效,但由于ICU患者病情较重,常并发其他基础疾病,受多种因素影响,临床治疗效果并不理想。根据之前的相关理论[8],脓毒症中炎症反应过程与血液高凝过程存在相互交叉,在理论上所有抗凝药物均应该能够治疗脓毒症。低分子肝素由普通肝素解聚形成,能抵抗血栓,防止血液凝固,不但具备较高的抗凝血因子Ⅹa活性,还有较低的抗凝血因子Ⅱa活性,或者具有抗凝血酶活性[9]。低分子肝素的抗血栓作用快速并且持久,对血流动力学具有明显改善作用,具有较高的生物利用度、较长的半衰期、较低的出血风险和免疫活性,在临床上被广泛应用。相关动物实验研究显示,低分子肝素可以使脓毒症大鼠静脉血中IL-6、肿瘤坏死因子α及血管紧张素Ⅱ的水平下降,进而使脓毒症的炎症反应受到抑制[10]。低分子肝素的抗炎作用也很明显,能降低白细胞黏附和激活速度,使补体系统的激活受到抑制,较好地保护血管内皮细胞连续性和完整性,最终改善脓毒症患者的微循环功能[11]。低分子肝素不仅能抑制脓毒症患者的病理性凝血系统激活,防止病情进一步发展,还能降低严重出血的发生率,对脓毒症的治疗非常适宜[12]。
代庆春等[13]发现,相对于常规治疗,联合应用低分子肝素可以明显降低APACHEⅡ评分,降低CRP和PCT水平,提高PLT,而且对凝血功能并无明显影响。本研究结果显示,观察组采用低分子肝素治疗7 d后,APACHEⅡ评分、CRP和PCT明显低于对照组。表明联合应用低分子肝素后能降低炎症反应,减轻全身各脏器功能因炎症反应造成的损害,减少多器官功能障碍综合征的发生率,对抗生素的抗炎效果起到协同促进作用,临床应用效果确切。血清IL-6水平也是反映脓毒症患者炎症严重程度的重要指标,并且能有效预测脓毒症的预后[14-15]。本研究通过低分子肝素的介入,使IL-6等炎症因子所触发的炎症瀑布效应受到抑制,使炎症对各脏器功能的损害降到最低,最终降低了多器官功能障碍综合征的发生率。本研究结果还显示,治疗后,观察组PLT明显高于对照组,表明低分子肝素使异常的凝血功能受到抑制,血小板的异常消耗被降低;观察组治疗后SOD明显高于对照组,MDA明显低于对照组,表明低分子肝素可以防止氧自由基损伤全身组织,使全身微循环障碍得到有效改善;在治疗过程中,2组均未出现严重不良反应,表明低分子肝素治疗脓毒症的不良反应较轻,安全性高。
总之,低分子肝素能明显降低脓毒症患者的炎症反应,防止凝血系统异常激活,对微循环具有明显的改善作用,减慢了多器官功能衰竭的发生速度,不良反应较轻,建议推广。
[参考文献]
[1] 张焱.重度脓毒症患者凝血功能四项检测的临床意义[J].血栓与止血学,2017,23(2):256-258.
[2] Allen KS,Sawheny E,Kinasewitz GT. Anticoagulant modulation of inflammation in severe sepsis[J]. World J Crit Care Med,2015,4(2):105-115.
[3] 章志丹,李鑫,马晓春.脓毒症抗凝治疗的现实与未来[J/CD].中华重症医学电子杂志,2016,2(3):156-161.
[4] 崔雷,程青虹,何永来,等.低分子肝素对脓毒症大鼠可溶性血栓调节蛋白、可溶性内皮细胞蛋白C受体及可溶性E-选择素的影响[J].中国老年学杂志,2015,35(18):5058-5060.
[5] Zarychanski R,Abou-Setta AM,Kanji S,et al. The efficacy and safety of heparin in patients with sepsis:a systematic reviewand metaanalysis[J]. Crit Care Med,2015,43(3):511-518.
[6] 唐勇,甄玲玲,张蓓,等.低分子肝素对中国人群脓毒症疗效的Meta分析[J].医学综述,2015,21(13):2435-2437,2440.
[7] 高勇,王晓静,李宁.降钙素原下降率对脓毒血症治疗及预后评估的意义[J].河北医科大学学报,2015,36(7):768-771,782.
[8] Opal SM,Dellinger RP,Vincent JL,et al. The next generation of sepsis clinical trial designs:what is next after thedemise of recombinant human activated protein C?[J]. Crit Care Med,2014,42(7):1714-1721.
[9] 吴志雄,冯坤好,谭家余,等.小剂量肝素钠与低分子肝素钙对脓毒症治疗作用的对比研究[J].临床和实验医学杂志,2016,15(4):359-361.
[10] 沈国锋,李响,倪金迪,等.低分子肝素治疗对ICU脓毒症患者急性肺损伤/急性呼吸窘迫综合征的影响[J].中国急救医学,2016,36(12):1130-1132.
[11] Wildhagen KC,García de Frutos P,Reutelingsperger CP,et al. Nonanticoagulant heparin prevents histone-mediated cytotoxicity in vitro and improves survival in sepsis[J]. Blood,2014,123(7):1098-1101.
[12] 韩宇,高传玉,秦秉玉,等.抗凝治疗对脓毒症凝血和炎症指标的影响及其意义[J].中华危重病急救医学,2015,27(2):102-105.
[13] 代庆春,李娜,回志,等.不同抗凝方法对连续性血液净化治疗脓毒症患者凝血功能和疗效的影响[J].中国老年学杂志,2016,36(7):1681-1682,1683.
[14] Ranzani OT,Monteiro MB,Ferreira EM,et al. Reclassifying the spectrum of septic patients using lactate:severe sepsis,cryptic shock,vasoplegic shock and dysoxic shock[J]. Rev Bras Ter Intensiva,2013,25(4):270-278.
[15] 李卫刚,常莉,周平,等.连续性血液净化联合低相对分子质量肝素治疗脓毒症时对凝血功能的影响[J].血栓与止血学,2015,21(4):249-250.
[收稿日期]2017-05-25;
[修回日期]2017-06-13
[作者简介]戴琳琳(1983-),女,河北乐亭人,河北省石家庄市中医院主治医师,医学学士,从事危重症诊治研究。
[中图分类号]R631
[文献标志码]B
[文章编号]1007-3205(2018)01-0100-05
(本文编辑:赵丽洁)