肺癌是最常见的恶性肿瘤之一,其发病率和病死率一直居高不下,严重威胁人类健康。据统计男女肺癌新发病率均占恶性肿瘤的14%,位居第二,但病死率均位居首位。小细胞肺癌(small cell lung cancer,SCLC)约占所有肺癌患者的13%,具有恶性程度高、发展快、自然病程短及广泛转移等特点[1],其中位生存期仅为9~10个月,5年生存率不足5%[2]。SCLC对化疗高度敏感,故目前SCLC首选化疗。化疗中常用的或指南推荐的药物是铂类药物,能够显著控制病情进展。但随着化疗周期的进行SCLC极易发生耐药,导致肿瘤复发,且绝大多数患者死于肿瘤复发及远处转移。研究显示,对于局限期小细胞肺癌(limited-stage small cell lung cancer,LS-SCLC)患者,同步放化疗可显著延长患者的生存时间,提高患者的缓解率,其疗效优于单纯化疗,已成为LS-SCLC的主要治疗方法[3-4];主要是因为放疗能够有效杀灭肿瘤细胞,延缓或减少肿瘤复发,同时顺铂具有放疗增敏效果,故联合放疗多选择以顺铂为基础的化疗方案。在临床上,依托泊苷联合顺铂(EP)方案配合胸部放疗是治疗LS-SCLC的标准治疗方案[5]。但由于联合放化疗不良反应大,且联合放疗的起始时间与患者预后密切相关,故同步放疗时机的选择仍有待商榷。本研究选择LS-SCLC患者,比较在不同EP化疗周期开始进行放疗后患者的获益及耐受情况,旨在探讨同步放疗时机的选择。现报告如下。
1 资料与方法
1.1 一般资料 选取2013年4月—2015年4月河北北方学院附属第一医院呼吸内科住院治疗的LS-SCLC患者120例,按随机数字表法分为A组和B组各60例。A组男性34例,女性26例,年龄47~82岁,平均(63.20±9.93)岁;B组男性30例,女性30例,年龄51~80岁,平均(66.18±8.13)岁。2组性别、年龄差异均无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会批准。
1.2 纳入标准和排除标准
1.2.1 纳入标准 ①符合国际肺癌研究协会制定的SCLC临床诊断,临床分期符合局限期者;②预计生存期>3个月,美国东部肿瘤协作组体能状态评分标准(Eastern Cooperative Oncology Group Performance Status,ECOG-PS)评分0~2分;③经病理学或细胞学确诊,且经CT检查证实至少存在1处可测量病灶;④心肝肾等重要脏器功能无重大损伤,功能基本正常,无严重感染;⑤骨髓储备正常;⑥知情同意且积极配合治疗;⑦治疗前无放化疗史。
1.2.2 排除标准 ①预计生存期<3个月;②TNM分期后考虑术后或曾有化疗史者;③心肝肾等重要脏器功能存在严重障碍者,并发未控制的严重感染;④未找到可供测量或评价的实体瘤;⑤骨髓造血功能异常;⑥不能配合治疗者。
1.3 研究方法 按纳入与排除标准选取的患者在治疗前进行临床分期、基线评估(病例评估,血常规、电解质、肝功能、Ca2+、乳酸脱氢酶、尿素氮、肌酐,胸部/肝脏/肾上腺静脉增强CT,头颅MRI或头颅增强CT,局限期考虑行PET-CT检查,建议戒烟)符合T1~2,N0。A组:VP-16 120 mg/m2d1、d2、d3,顺铂60 mg/m2d1,每3周1个周期,共4个周期,于第1周期同步放疗,放疗剂量为3周45 GY(1.5 GY,2次/d)。B组:VP-16 120 mg/m2d1、d2、d3,顺铂60 mg/m2d1,每3周1个周期,共4个周期,于第2周期同步放疗,放疗剂量为3周45 GY(1.5 GY,2次/d)。各组用药前30 min常规静脉滴注格拉司琼、地塞米松等药物以减轻化疗反应。
1.4 观察指标及疗效评定标准
1.4.1 生存率比较 观察2年生存率变化。
1.4.2 近期疗效观察 完成第4周期后评估。
1.4.3 病灶变化 采用 2009年美国国立癌症研究所实体瘤客观疗效评定标准修订版(Response Evaluation Criteria in Solid Tumors,RECIST1.1)进行评价。①完全缓解(complete remission,CR):所有目标病灶消失,至少维持4周;②部分缓解(partial remission,PR):基线病灶最大径总和至少缩小30%,至少维持4周;③稳定(stable disease,SD):基线病灶最大径总和有缩小但未达PR或有增加但未达进展(progressive disease,PD);④PD:基线病灶最大径总和至少增加20%或出现新病灶。以CR+PR计算有效率(response rate,RR),CR+PR+SD计算疾病控制率(disease control rate,DCR)。无进展生存时间(progression free survival,PFS)是指从患者从治疗开始到影像学或临床发现肿瘤进展或患者死亡(以先发生者为准)所持续的时间。
1.4.4 不良反应 采用美国国立癌症研究所通用毒性标准(National Cancer Institute Common Toxicity Criteria, NCI-CTC 3.0)评价各组患者的化疗不良反应,具体包括白细胞减少、贫血、血小板减少、食管炎等。
1.4.5 外周血循环血肿瘤细胞(circulat-ing tumor cells,CTC)数值变化 CTC是存在于外周血中的各类肿瘤细胞的统称。监测CTC类型和数量变化趋势可实时监测肿瘤动态、评估治疗效果,实现实时个体治疗。在基线评估时和化疗期间第4周期分别采集血标本采用 CellSearch 方法检测CTC计数。
1.5 统计学方法 应用SPSS 13.0统计学软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验;采用Kaplan-Meier法进行生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效 2组RR和DCR差异均无统计学意义(P>0.05);A组PFS和总生存时间长于B组,差异有统计学意义(P<0.05)。见表1。
生存曲线见图1,2。
表1 2组疗效比较
Table 1 Comparison of efficacy in both groups (n=60)

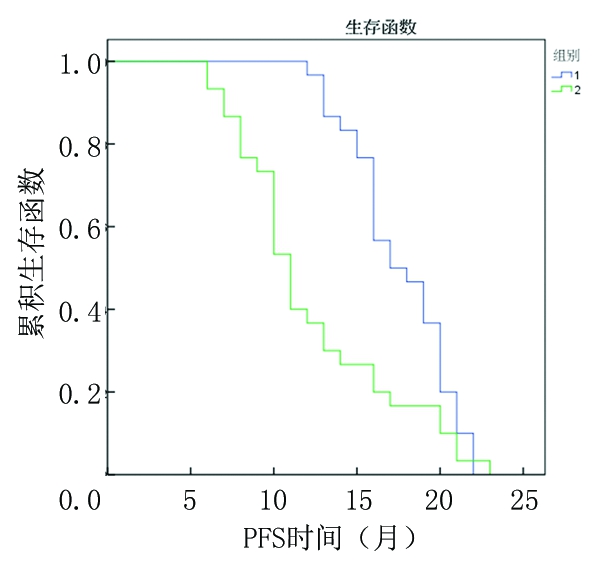
图1 PFS时间
Figure1 PFS time
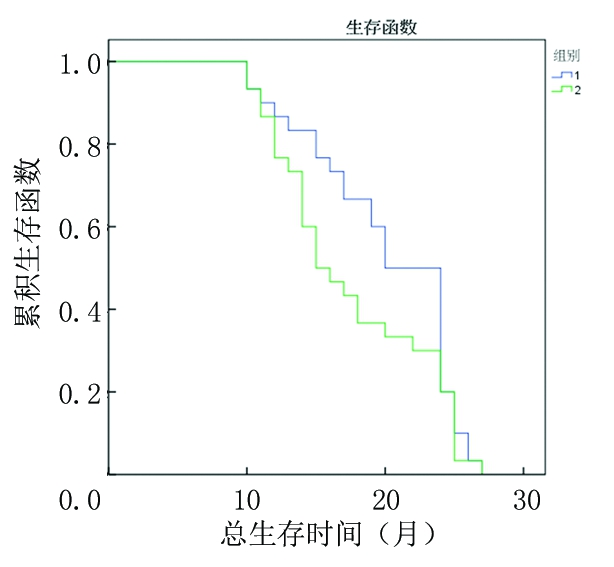
图2 生存时间
Figure 2 Survival time
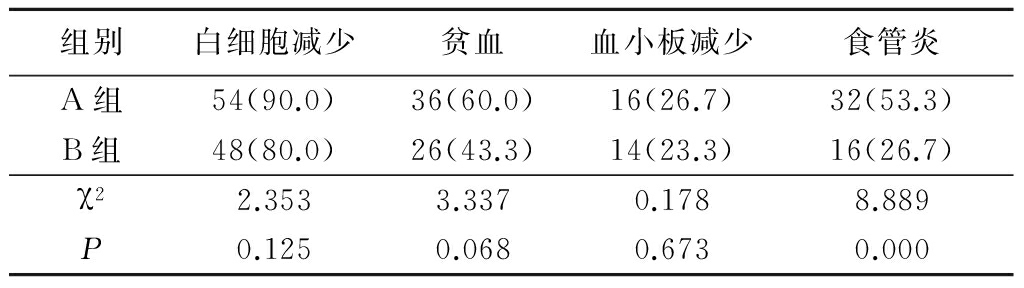
2.2 不良反应 不良反应主要包括白细胞减少、贫血、血小板减少、食管炎等。A组食管炎发生率明显高于B组,差异有统计学意义(P<0.05);2组白细胞减少、贫血、血小板减少发生率差异均无统计学意义(P>0.05)。见表2。
表2 A、B组不良反应发生率比较
Table 2 Comparison of the incidence of adverse reactions in A and B treatment groups (n=60,例数,%)
2.3 CTC测定情况 治疗前2组CTC≥1、CTC≥5、CTC≥10和CTC≥50比例差异均无统计学意义(P>0.05)。治疗后A组CTC≥1、CTC≥5、CTC≥10和CTC≥50比例均较治疗前明显减少(P<0.05);B组CTC≥10和CTC≥50比例较治疗前明显减少(P<0.05),CTC≥1和CTC≥5比例与治疗前差异无统计学意义(P>0.05);A组CTC≥5、CTC≥10比例少于B组(P<0.05),CTC≥1、CTC≥50比例与B组差异无统计学意义(P>0.05)。见表3。
表3 A、B组CTC测定情况
Table 3 CTC count in A and B groups (n=60,例数,%)
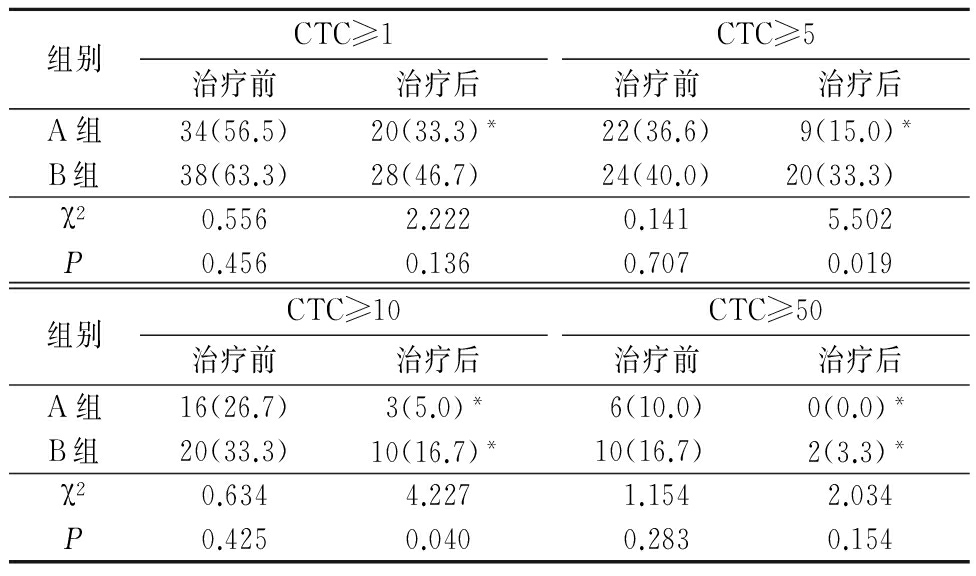
*P<0.05与治疗前比较(χ2检验)
3 讨 论
SCLC具有恶性程度高、倍增时间短、发展迅速以及早期转移等特点,预后较差[6]。手术对于大多数局限性SCLC患者效果有限[7-9]。在临床上EP方案联合放疗是LS-SCLC患者的主要治疗方案[10],与单纯化疗比较,可以显著延长患者的生存期。LS-SCLC患者对EP联合放疗方案的反应率可达70%~90%。通过放疗可使LS-SCLC患者肿瘤的局部控制率提高25%,从而有效改善患者的预后。EP方案联合放疗的不良反应体现在增加患者食管炎发生率,并增加化疗的肺毒性及血液毒性[11]。
对于LS-SCLC患者,如何把握化疗的时机有待商榷。研究表明,对于LS-SCLC患者,同期放化疗生存率优于序贯放化疗[12],而在同步放化疗中,早期进行同步放化疗有利于减少化疗抗拒的肿瘤细胞,减少肿瘤细胞对放疗的抵抗性,降低远处转移并减少肿瘤细胞的增殖,从而有效延长患者的生存期,并控制患者局部及全身症状[13-15]。NCCN指南推荐局限期患者应于化疗第1或第2治疗周期同步进行放疗,故本研究主要讨论第1及第2周期联合放疗的预后比较。
本研究通过对比不同放疗时期患者生存期、PFS、不良反应及CTC等指标,发现与第2周期同步放疗比较,第1周期放疗的PFS明显延长,且CTC明显下降,而第2周期同步放疗CTC未见明显变化,2组RR、DCR无明显差异,与相关研究结果一致[16-17]。其原因可能在于化疗敏感患者在初始化疗后肿瘤处于降期状态,肿瘤直径及肿瘤负荷减低,肿瘤内部乏氧率降低,且尚未产生耐药,而在之后的放化疗中,由于肿瘤对放化疗的耐药率增加,使得效果较之前下降,故第1周期放疗的效果优于第2周期放疗。在不良反应方面,第1周期同步放疗的食管炎发生率高于第2周期放疗,应引起重视并积极预防,而2组白细胞减少、贫血、血小板减少发生率差异无统计学意义,因SCLC具有早期转移特性,故及早使用综合治疗有利于改善患者的预后。所以,EP方案联合第1周期同步放疗有利于改善患者的预后,其有待大规模研究进一步证实。
本研究的优势在于运用CTC等治疗指标比较不同放疗周期治疗后外周血肿瘤细胞的抑制程度,从而客观地评价肿瘤细胞对不同化疗方案的敏感性。本研究的局限性在于患者样本量较小,可能对结果存在影响;另外,研究可能存在未知的混杂因素,可能会对研究结果产生偏倚。
[参考文献]
[1] Tartarone A,Giordano P,Lerose R,et al. Progress and challenges in the treatment of small cell lung cancer[J]. Med Oncol,2017,34(6):110.
[2] Parikh M,Riess J,Lara PN Jr. New and emerging developments in extensive-stage small cell lung cancer therapeutics[J]. Curr Opin Oncol,2016,28(2):97-103.
[3] Xiao X,Wang S,Xia S,et al. Retrospective study of irinotecan/cisplatin followed by etoposide/cisplatin or the reverse sequence in extensive-stage small cell lung cancer[J]. Onco Targets Ther,2015,8:2209-2214.
[4] Imai H,Mori K,Watase N,et al. Clinical impact of post-progression survival on overall survival in elderly patients with extensive disease small-cell lung cancer[J]. Thorac Cancer,2016,7(6):655-662.
[5] 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[6] Käsmann L,Bolm L,Janssen S,et al. Prognostic factors and treatment of early-stage small-cell lung cancer[J]. Anticancer Res,2017,37(3):1535-1537.
[7] Hou SZ,Cheng ZM,Wu YB,et al. Evaluation of short-term and long-term efficacy of surgical and non-surgical treatment in patients with early-stage small cell lung cancer:a comparative study[J]. Cancer Biomark,2017,19(3):249-256.
[8] 张力.2010年第1版NCCN临床肿瘤治疗指南小细胞肺癌部分解读[J].国际呼吸杂志,2010,30(22):1355-1357.
[9] 窦学军,王志远,王亮,等.外科治疗Ⅲa期小细胞肺癌的疗效分析[J].中国肺癌杂志,2017,20(2):88-92.
[10] Shi Y,Hu Y,Hu X,et al. Cisplatin combined with irinotecan or etoposide for untreated extensive-stage small cell lung cancer:a multicenter randomized controlled clinical trial[J]. Thorac Cancer,2015,6(6):785-791.
[11] Zhang J,Fan M,Liu D,et al. Hypo-or conventionally fractiongated radiotherapy combined with chemotherapy in patients with limited stage small cell cancer[J]. Radiat Oncol,2017,12(1):51.
[12] 徐秀理,陆林,胡宗涛,等.小细胞肺癌同期化放疗的临床结果分析[J].临床肺科杂志,2015,20(6):993-996.
[13] De Ruysscher D,Lueza B,Le Péchoux C, et al. Impact of thoracic radiotherapy timing in limited-stage small-cell lung cancer: usefulness of the individual patient data meta-analysis[J]. Ann Oncol,2016,27(10):1818-1828.
[14] Post CM,Verma V,Mitin T,et al. Practice patterns of thoracic radiotherapy for extensive-stage small-cell lung cancer: survey of US academic thoracic radiation oncologists[J]. Clin Lung Cancer,2017,18(3):310-315.
[15] Slotman B. What is the optimal radiotherapy schedule for limited stage small cell lung cancer?[J]. Lung Cancer,2017,105:52-53.
[16] 丁新民,冯华松,伏婷婷,等.局限期小细胞肺癌前两周期EP方案化疗有效性与预后[J].中国老年学杂志,2016,36(8):1880-1882.
[17] 赵晓光,宋明霞,徐洁,等.UGT1 A1基因多态性与小细胞肺癌伊立替康化疗毒性和疗效的研究[J].河北医科大学学报,2014,35(9):1000-1002.