全球范围内,食管癌发病率在最常见的恶性肿瘤中排第八位;据估计,2012年全球食管癌新发45.6万例,占全部癌症发病的3.2%;而全球每年死于食管癌的患者占全部恶性肿瘤死亡例数的第六位;据估计,2012年全球因食管癌死亡40万例,占全部癌症死亡的4.9%[1]。我国食管癌发病以鳞状细胞癌多见,并有局部地区高发的分布特点[2]。本病早期症状不明显,一旦出现进行性吞咽困难、吞咽疼痛、声音嘶哑、体质量下降等表现时,病程多已进入中后期。手术治疗目前仍是食管癌治疗的首选方法。传统食管癌根治术根据肿瘤位置的不同,常见有左侧开胸、右侧开胸+开腹、右侧开胸+开腹+开颈等多种手术入路可供选择。但传统手术由于视野的限制,对于淋巴结清扫彻底性较差,并且手术切口长,术后患者恢复较慢,痛苦较大。微创食管癌根治术具有创伤小、安全性高、彻底性好[3]等特点。本研究比较开胸食管癌根治术与微创食管癌根治术的手术效果,报告如下。
1 资料与方法
1.1 一般资料 选取2013年11月—2016年7月于我院行食管癌根治术患者123例,所有手术均由同一组手术医师配合完成。纳入标准:①经术前胃镜病理活组织检查确诊为食管鳞状细胞癌(0期,高度不典型增生);②所有患者无高血压、糖尿病、心脏病等既往病史,肝肾功能无异常;③所有患者均经术前检查无远处转移征象,食管鳞癌TNM分期处于Ⅲb期(包括Ⅲb期)之前,所有患者接受随访1年,失访者从本研究中剔除。根据患者意愿分为微创食管癌根治术组(微创组,68例)和常规开胸手术组(开胸组,55例)。微创组男性44例,女性24例,年龄45~75岁,平均(59.2±7.3)岁;肿瘤位置:上段7例,中段45例,下段16例;TNM分期:0期2例,Ⅰ期(Ⅰa+Ⅰb) 8例,Ⅱ期(Ⅱa+Ⅱb) 23例,Ⅲ期(Ⅲa+Ⅲb) 35例。开胸组男性39例,女性16例,年龄44~76岁,平均(58.7±7.3)岁;肿瘤位置:上段4例,中段39例,下段12例;TNM分期:0期1例,Ⅰ期(Ⅰa+Ⅰb) 6例,Ⅱ期(Ⅱa+Ⅱb) 19例,Ⅲ期(Ⅲa+Ⅲb) 29例;行左胸切口43例,右胸上腹两切口8例,颈胸腹三切口4例。2组性别、年龄、肿瘤部位、TNM分期差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准。
1.2 手术方法
1.2.1 微创组 患者选择静吸复合麻醉,插双腔气管插管。首先为水平仰卧位,选取患者脐部为观察孔,置入气腹针,腹腔压力为11 mmHg时置入腹腔镜观察腹腔内情况,选取右锁骨中线脐上2 cm处为主操作孔,右肋缘下锁骨中线处及左腋前线脐水平均为副操作孔,剑突下2 cm处为挡肝操作孔,用超声刀打开小网膜囊,在胰腺上缘寻找胃左动静脉,清扫胃左血管旁淋巴结并游离胃左血管,用Hem-o-lok钳夹、切断胃左血管,继续沿小弯侧游离胃至食管裂孔,寻找并切断胃短动脉。沿胃网膜血管弓无血管区起切断胃横结肠韧带,将胃大小弯侧全部游离,清扫贲门左、贲门右、胃大弯、胃小弯、胃短动脉旁、肝总动脉旁、脾门淋巴结。分离贲门周围与食管裂孔组织,扩大食管裂孔。在胃小弯用直线切割缝合器切除部分胃、贲门,留胃底,将余胃制作管状胃(部分),外加浆肌层包埋缝合。常规给予行空肠造瘘:在左腹直肌外缘用空肠穿刺针穿透腹壁进入空肠(在近端30 cm处),从腹壁外放入空肠管进入空肠远端20 cm。在肠壁缝2个荷包线引出腹壁外收紧打结,脾窝处放置腹腔引流管,关腹。左侧卧位,常规消毒、铺单,选取腋中线第7肋间为观察孔,腋前线第4肋间为主操作孔,腋前线第3肋间及腋后线第8肋间为副操作孔,由胸顶起向下游离食管至食管裂孔,游离奇静脉弓,Hem-o-lok钳夹切断,将远心端用缝线固定于胸壁,清扫双侧喉返神经旁、上纵膈、隆突下、肺门、食管旁、下肺韧带旁淋巴结,并观察奇静脉弓上方胸导管充盈情况,如胸导管充盈良好则不行胸导管结扎,如充盈不满意则可行胸导管结扎。然后将胃提至胸腔,用直线切割缝合器切除胃底(把剩余部分胃切断),完成管状胃的制作,并外加浆肌层包埋缝合。在右颈胸锁乳突肌前缘切口4 cm,在甲状腺与颈总动脉鞘之间游离出食管,将胃经胸廓上口上提至颈部,做食管与胃底行端侧颈部吻合,缝合颈部切口,胸腔纵膈处放置引流管,关胸。
1.2.2 开胸组 如肿瘤位置较低无需胸顶吻合者及肿瘤与主动脉关系不密切者常规左胸切口,标准后外侧切口游离食管,打开膈肌,游离胃,并完成管状胃制作,切除肿瘤,将胃提至胸腔与食管断端行端侧吻合。清扫视野范围内淋巴结。如肿瘤位置较高需行胸顶吻合者及肿瘤与主动脉关系较密切者选择右胸切口,标准后外侧切口游离食管,清扫视野范围内淋巴结,上腹正中切口开腹游离胃,并完成管状胃制作,清扫腹腔淋巴结,关腹。将胃提至胸腔,与食管断端在胸顶处行端侧吻合。如肿瘤位于颈段食管,则在完成右胸+上腹操作后,切开右颈部,将胃经胸廓上口上提至颈部,切除肿瘤,做食管与胃行端侧颈部吻合。所有手术均常规结扎胸导管。
1.3 观察指标 ①记录手术时间、术中失血量、胸腔引流量、术后胸管留置时间、术后开始进食时间、术后疼痛程度(采用视觉模拟疼痛评分法:0~2分为无痛,3~4分为轻度疼痛,5~8分为中度疼痛,9~10分为剧烈疼痛[4])、淋巴结清扫个数。②术后主要并发症:主要有吻合口瘘、脓胸、肺部感染、乳糜胸、声音嘶哑、吻合口狭窄。③患者1年无瘤生存率及总生存率。
1.4 统计学方法 应用 SPSS 13.0统计学软件分析数据。计量资料比较采用独立样本的t检验;计数资料比较采用χ2检验;无瘤生存率和总生存率计算采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结 果
2.1 2组术中、术后情况比较 微创组手术时间明显长于开胸组,术中失血量、术后胸腔引流量少于开胸组,术后胸管留置时间、术后开始进食时间短于开胸组,术后疼痛程度低于开胸组,淋巴结清扫个数多于开胸组,差异有统计学意义(P<0.05),见表1。
表1 2组术中情况比较
Table1 Comparison of the two groups in the operation
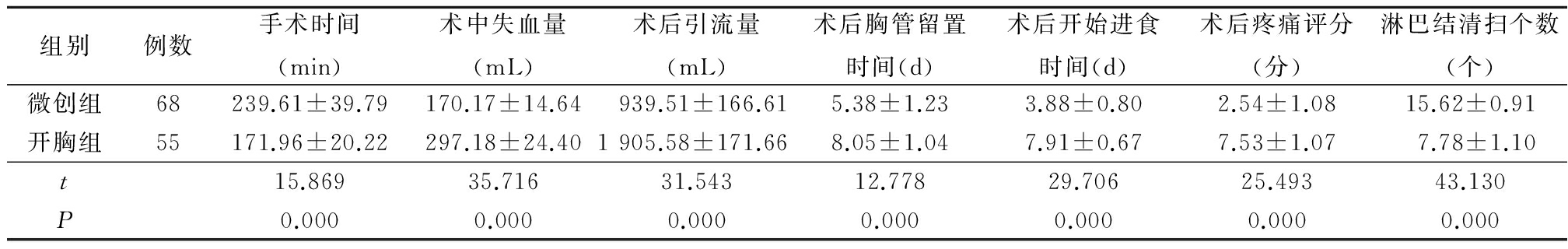
2.2 2组术后主要并发症发生率情况比较 微创组肺部感染发生率低于开胸组,差异有统计学意义(P<0.05);2组吻合口瘘、脓胸、乳糜胸、声音嘶哑、吻合口狭窄发生率差异均无统计学意义(P>0.05)。见表2。
表2 2组术后常见并发症发生率比较
Table 2 Comparison of the incidence rate of the common postoperative complications between the two groups (例数,%)
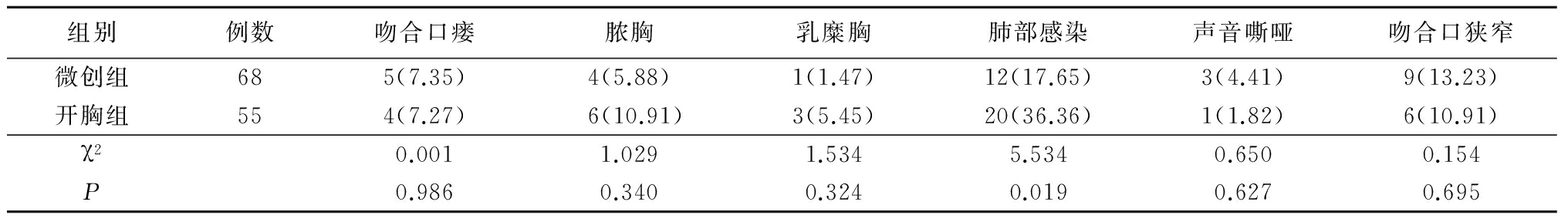
2.3 2组术后1年无瘤生存率和总生存率比较 微创组术后1年无瘤生存率高于开胸组(P<0.05),2组1年总生存率差异无统计学意义(P>0.05),见表3,图1。
表3 2组术后1年无瘤生存率和总生存率比较
Table 3 Comparison of the disease-free survival rate and overall survival rate between the two groups in one year (例数,%)
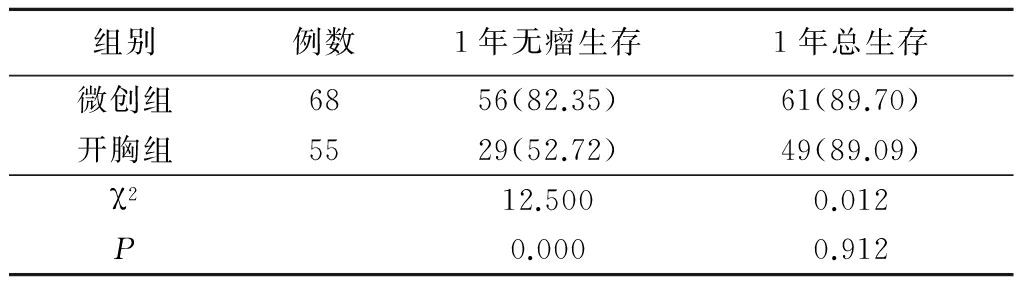
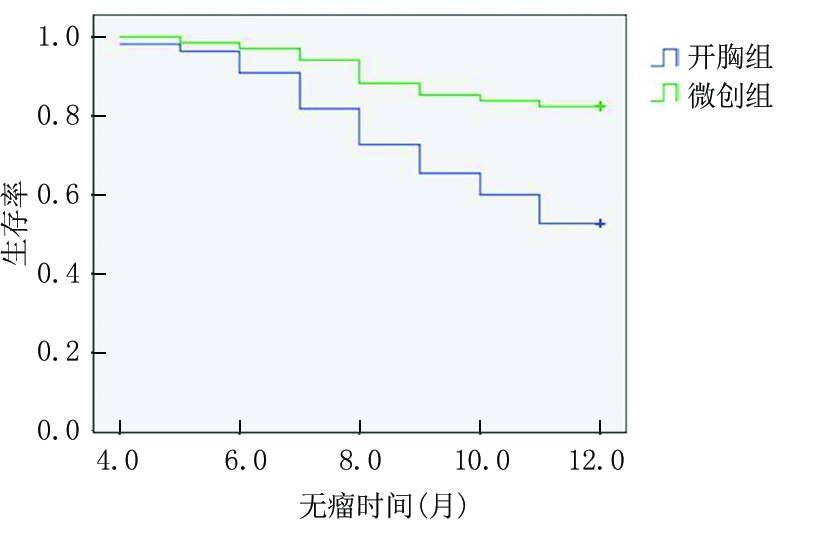
图1 2组生存曲线比较
Figure 1 Comparison of survival curves between the two groups
3 讨 论
微创食管癌根治术在食管癌治疗中越来越受到重视,越来越多的胸外科医生选择微创食管癌根治术作为食管癌手术治疗的首选方案[5-6]。这种治疗方法不仅在技术上完全可行,减少了患者的手术创伤,减轻了患者的痛苦,而且更重要的是其治疗效果优于传统开胸手术。
本研究显示微创组术中出血量及胸腔引流量均少于开胸组(P<0.05)。术中出血量及胸腔引流量是对患者手术创伤大小判定的重要指标,考虑原因是腔镜下视野较好、操作精细、不良反应较少[7],同时止血快捷、彻底,并缩短开关胸时间,减少其过程中损伤和出血,且胸腔闭式引流管留置时间因此缩短,由此带来的术后疼痛也明显减轻。由于微创手术为镜下操作,较直视操作难度大,步骤多,开展总例数较开胸手术少,操作衔接不流畅等原因造成微创组手术时间延长。随着手术技术的不断熟练和改进,将有可能使微创手术时间≤开胸手术时间。微创手术视野清晰,吻合确切,且颈部吻合口瘘出现后出现全身并发症的风险低于胸腔瘘,故微创组患者术后可实现早期进食,减少长时间胃肠外营养并发症,改善营养状态,反而更有利于吻合口愈合。
喉返神经旁淋巴结是食管癌淋巴转移较为多见的部位,清扫该处淋巴结可降低术后复发,提高生存率[8-9]。各角度视野清晰是微创手术最为显著的优点,开胸手术无法清晰解剖的淋巴结在腔镜下可清晰操作,尤其在左开胸食管癌根治术中:一方面打开膈肌后腹腔内操作视野较差,无法完整进行腹腔淋巴结清扫,即使是食管上段高分化鳞状细胞仍有可能出现腹腔淋巴结转移[10];另一方面由于主动脉及左侧锁骨下动脉的遮挡,很难完成上纵膈淋巴结清扫,即使是右胸+上腹切口食管癌根治术中,由于切口位置的限制,双侧喉返神经旁淋巴结的清扫是很难安全完成的。本研究显示微创组淋巴结清扫个数多于开胸组(P<0.05)。随着淋巴结清扫数量的增加,必将导致微创组淋巴结清扫时间的延长,但是这种时间增加从患者无瘤生存期来看应该是利大于弊的。
本研究2组吻合口瘘、脓胸、乳糜胸发生率差异均无统计学意义(P>0.05)。说明微创食管癌根治术手术技术确切,能达到与开胸手术相同的手术效果。本研究微创组肺部感染发生率低于开胸组(P<0.05)。原因可能是:一方面微创手术操作精细,对肺组织牵拉较少,不良反应少,肺组织渗出较少;另一方面开胸手术要切断背阔肌、前锯肌、部分竖脊肌及肋骨,严重影响了患者的呼吸功能,并造成了剧烈的疼痛,患者术后常拒绝咳嗽、排痰,从而使得呼吸道分泌物无法有效排出,阻塞气道,出现肺部不张、肺部感染的情况[11]。微创手术不涉及肌肉及肋骨的离断,术后疼痛较轻,患者咳嗽、排痰较顺利,故肺部感染发生率降低[12]。
本研究结果显示微创组1年无瘤生存率高于开胸组(P<0.05),这可能与微创组视野清晰、手术操作精确、瘤体切除和淋巴结清扫彻底有关[13-14];而2组1年总生存率差异无统计学意义(P<0.05),可能与随访时间较短有关,有些患者虽然已出现复发和转移征象,但尚未死亡,故此数据需要后续进行随访观察以得出更加准确的结论。
综上所述,微创食管癌根治术在食管癌手术治疗中能达到与开胸手术相同的治疗目的,并在治疗效果、安全性上优于开胸手术,是食管癌根治术的发展趋势,国内其他学者也有类似相同的结论[15-16]。但微创手术多依赖各种器械,治疗费用较开胸手术高,故临床上要根据患者的具体情况及自主意愿选择进行何种手术操作。
[参考文献]
[1] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:Sources,methods and major patterns in globocan 2012[J]. Int J Cancer,2015,136(5):e359-386.
[2] 左婷婷,郑荣寿,曾红梅,等.中国食管癌发病状况与趋势分析[J].中华肿瘤杂志,2016,38(9):703-708.
[3] 赵树立,陈仕林,许林,等.胸腔镜术与右侧开胸术对中早期食管癌患者微转移相关因子水平影响的随机对照研究[J].现代生物医学进展,2015,15(26):5103-5106.
[4] 董跃华,魏玉磊,王大伟,等.肋间神经冷冻与静脉自控镇痛在胸外科术后镇痛效果的比较[J].重庆医学,2014,43(15):1866-1867,1870.
[5] 王友于,曾富春,丛伟,等.胸腹腔镜技术在食管癌手术中的应用[J].中国胸心血管外科临床杂志,2015,22(6):610-612.
[6] 王道猛,钱斌,吴俊,等.胸腹腔镜联合治疗食管癌的临床价值[J].中华消化外科杂志,2015,14(12):1012-1015.
[7] 徐迅.不同术式对食管癌患者机体代谢及转移相关指标的影响[J].海南医学院学报,2014,20(10):1392-1393,1396.
[8] 马玉泉,刘晖,刘煜,等.胸段食管癌喉返神经旁淋巴结转移特点及临床意义[J].河北医科大学学报,2013,34(8):931-933.
[9] 聂军,周波,王露.不同淋巴结清扫术式对老年胸中上段食管癌患者淋巴结转移复发率、生存时间及并发症的影响[J].实用癌症杂志,2017,32(8):1267-1269.
[10] 杨请杰,张强,郭明.胸段食管癌腹部淋巴结转移规律临床分析[J].中国肿瘤临床,2014,41(17):1108-1110.
[11] 盛岩.术后系统疼痛干预对食管癌患者术后疼痛及康复的影响[J].国际护理学杂志,2014,33(7):1767-1769.
[12] 钱斌,王道猛,吴俊,等.县级医院行微创食管癌根治术84例手术并发症临床分析[J].河北医科大学学报,2016,37(1):80-82.
[13] 臧豹,赵建强,侯予龙,等.食管癌微创与开放根治术在淋巴结清扫和术后早期并发症的对比研究[J].中国微创外科杂志,2016,16(3):205-208.
[14] Ma GW,Situ DR,Ma QL,et al. Three-field vs two-field lymph node dissection for esophageal cancer:a meta-analysis[J]. World J Gastroenterol,2014,20(47):18022-18030.
[15] 苏立伟,张冬梅,李玮,等.微创食管癌切除术与开放食管癌切除术的近期疗效比较[J].武警医学,2017,28(7):664-667,671.
[16] 万军,康宁宁,葛威,等.胸腹腔镜联合食管癌根治术的手术方法安全性及临床效果分析[J].安徽医学,2016,37(6):649-651,652.