腰背部疼痛是中老年人的常见病,大约60%的人在70岁之前会出现腰痛症状。引起腰背部疼痛的主要原因是椎间盘发生了退行性改变,而导致椎间盘退变的因素包括正常的老化过程、椎体生物力学性能改变、椎间盘营养供给异常以及椎间盘细胞外基质代谢失衡等,其中椎间盘营养供给异常是导致椎间盘退变的重要因素。椎间盘主要通过软骨终板以弥散的方式在椎体与椎间盘之间进行物质交换。软骨终板的增厚、钙化将严重影响其弥散营养物质的能力,导致椎间盘营养障碍,从而加速椎间盘退变的进程[1]。本课题组前期研究结果显示卵巢切除(ovariectomy,OVX)大鼠椎体骨量减少与椎间盘退变呈正相关性,应用骨质疏松药物[阿仑膦酸钠、鲑鱼降钙素、甲状旁腺素(parathyroid hormone,PTH)(1-34)]进行干预,可以有效延缓卵巢切除大鼠腰椎间盘退变进程[2-8]。因此,本研究旨在观察PTH(1-34)对卵巢切除大鼠软骨终板Ⅰ型胶原及Ⅹ型胶原表达的影响。
1 材料与方法
1.1 动物来源及分组 30只3月龄雌性Sprague-Dawley(SD)大鼠,SPF级,购自北京维通利华实验动物技术有限公司,随机分为3组,每组10只:假手术组(Sham)、卵巢切除组(OVX)和卵巢切除+甲状旁腺组(OVX+PTH)。所有大鼠均分笼饲养,自由摄食水,室温(24±2) ℃,自然光照,动物饲料购自北京维通利华实验动物技术有限公司。
1.2 骨质疏松大鼠模型制备 用10%的水合氯醛按3 mL/kg剂量对大鼠腹腔麻醉,取侧卧位,以后方髂骨嵴上2 cm、脊柱旁1 cm处为中心备皮,碘伏消毒术区,铺手术巾。以后方髂骨嵴上2 cm、脊柱旁1 cm处纵行切开,依次切开皮肤、皮下组织及筋膜组织,钝性分离肌层,暴露腹腔。于切口下方脂肪组织中暴露卵巢及输卵管(成熟卵巢为淡红色菜花状,黄豆大小,与输卵管相连,表面有不规则结节状卵泡),用镊子将卵巢及其周围的软组织提起后,丝线结扎周围组织及输卵管,切除卵巢,将切除卵巢后的组织还纳回腹腔,逐层缝合手术切口,关闭腹腔。应用碘伏对切口周围进行消毒。对侧卵巢切除依照此方法进行。Sham组只行背部切开手术,即暴露卵巢但不切除。
1.3 药物干预及标本采集 卵巢切除术后12周,OVX+PTH组皮下注射甲状旁腺素(1-34)(美国Sigma公司),剂量为30 μg·kg-1·d-1。再连续给药12周后以过量麻醉的方法处死所有大鼠。切开大鼠背部皮肤,锐刀分离附着在脊柱上的肌肉及其他软组织,L4~5椎体及其椎间盘置于10%福尔马林中性缓冲液中保存。固定完成后将标本置于10%EDTA脱钙液中进行脱钙,每3 d更换1次脱钙液,大约3个月左右脱钙完成。之后对标本依次进行冲洗、梯度脱水、透明、浸蜡、石蜡包埋等处理。使用切片机对包埋好的蜡块进行切片。石蜡切片进行van Gieson染色,Ⅰ型胶原、Ⅹ型胶原进行免疫组织化学染色。
1.4 检测方法
1.4.1 椎间盘van Gieson染色 石蜡切片常规脱蜡至水。Weigert铁苏木素染5~10 min,水洗。1%盐酸酒精分化,流水冲洗。van Gieson染液染1~2 min;倾去染液,直接用95%酒精急速分化数秒;无水酒精脱水,二甲苯透明,中性树胶封片。光镜下观察。
1.4.2 免疫组织化学染色 石蜡切片常规脱蜡至水。3%过氧化氢封闭,复合酶消化,滴加抗兔Ⅰ型胶原及Ⅹ型胶原多克隆抗体(购自武汉博士德),4 ℃冰箱过夜。滴加生物素标记的二抗。滴加链霉素抗生物素-过氧化物酶溶液。DAB显色。苏木精复染,盐酸酒精分化,梯度酒精脱水,二甲苯透明,中性树胶封片。光镜下观察。
1.5 统计学方法 应用SPSS 15.0统计学软件分析数据。计量资料比较分别采用F检验和LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 软骨终板组织学观察结果 卵巢切除术后24周,椎间盘软骨终板经van Gieson染色结果显示:Sham组椎间盘软骨终板结构正常,软骨终板内含有大量的透明软骨细胞,细胞排列规则;OVX组软骨终板内可见透明软骨层中大量骨样组织形成,在骨样组织中可见髓腔及血细胞;与OVX组相比,OVX+PTH组软骨终板可见少量的骨样组织及髓腔形成,透明软骨细胞排列较规则(图1)。
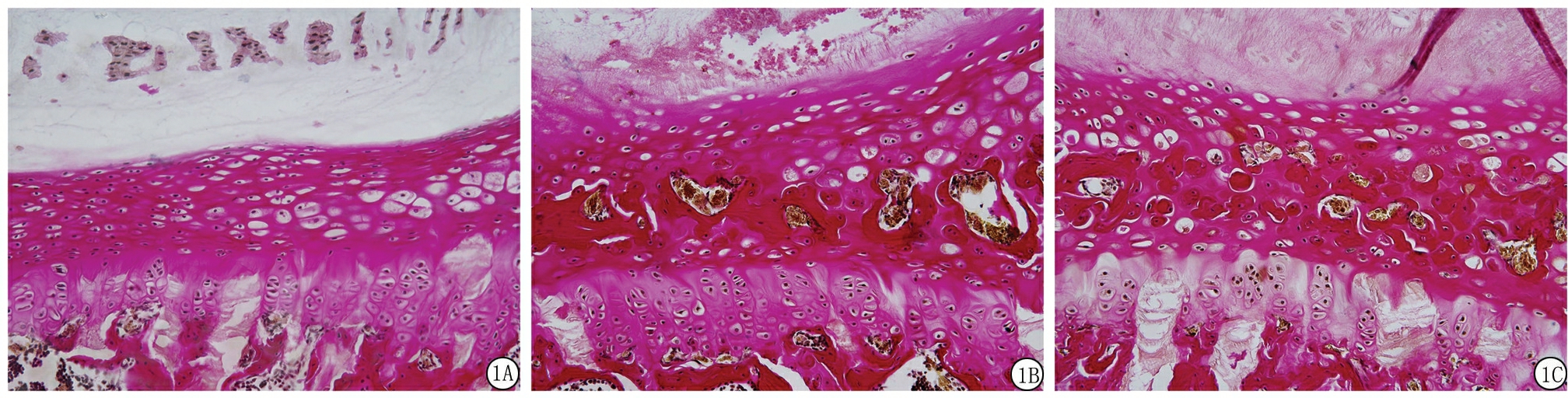
图1 各组大鼠腰椎间盘软骨终板van Gieson染色结果( ×200)
A.Sham组;B.OVX组;C.OVX+PTH组
Figure 1 van Gieson staining of cartilage endplate in each group( ×200)
2.2 软骨终板免疫组织化学染色结果 对大鼠软骨终板进行Ⅰ型胶原及Ⅹ型胶原免疫组织化学染色结果发现:Sham组软骨终板中Ⅰ型胶原及Ⅹ型胶原表达较弱;OVX组软骨终板内Ⅰ型胶原及Ⅹ型胶原表达显著高于Sham组(P<0.05),呈强阳性表达;与OVX组相比,OVX+PTH组软骨终板内Ⅰ型胶原及Ⅹ型胶原表达较弱(图2)。OVX组Ⅰ型胶原及Ⅹ型胶原表达显著高于Sham组,OVX+PTH组Ⅰ型胶原及Ⅹ型胶原表达显著低于OVX组,差异均有统计学意义(P<0.05),见表1。
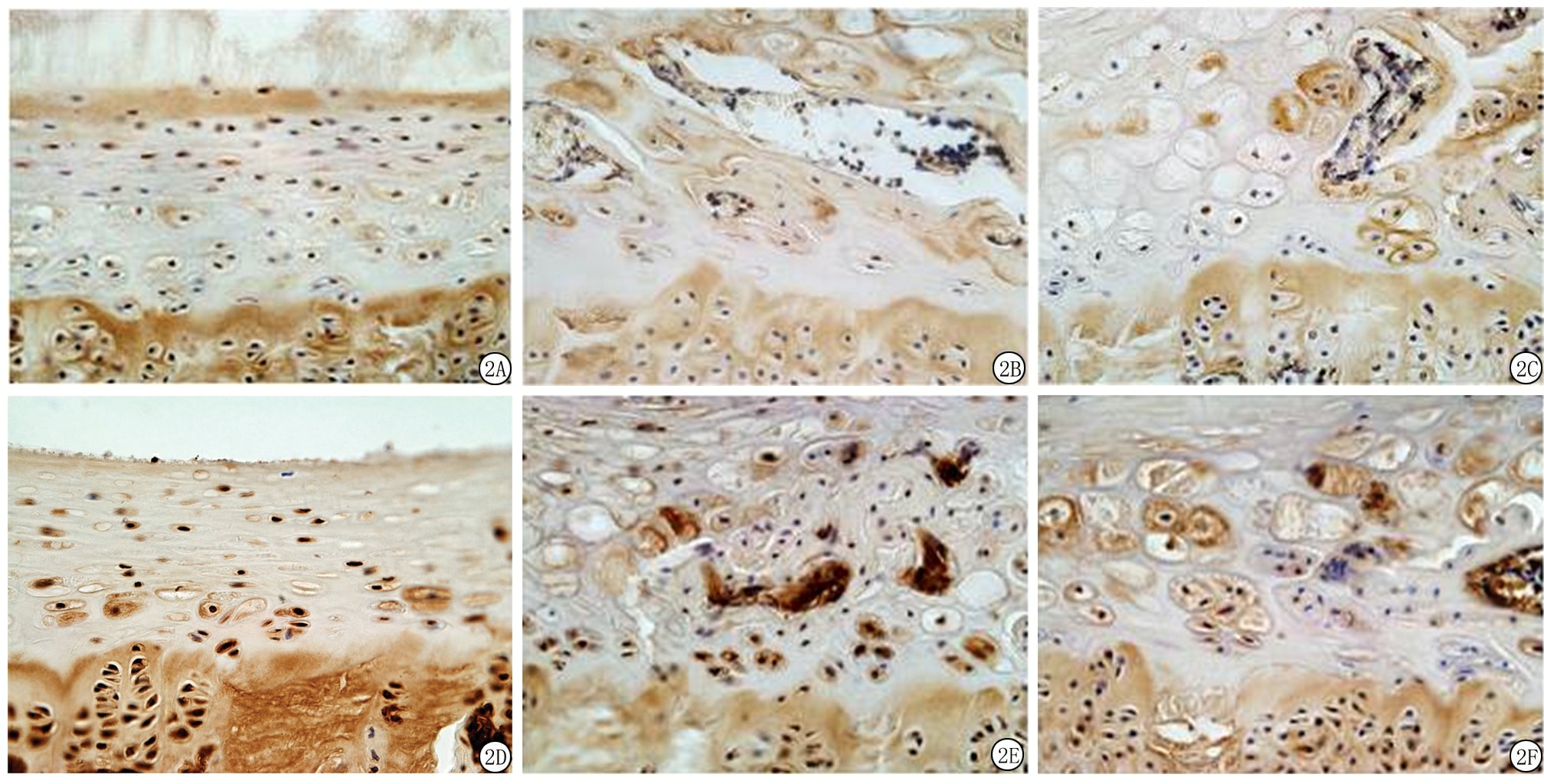
图2 各组大鼠软骨终板Ⅰ型胶原、Ⅹ型胶原免疫组织化学染色结果 ( ×400)
A.Sham组Ⅰ型胶原;B.OVX组Ⅰ型胶原;C.OVX+PTH组Ⅰ型胶原;D.Sham组Ⅹ型胶原;E.OVX组Ⅹ型胶原;F.OVX+PTH组Ⅹ型胶原
Figure 2 Immunohistochemistry assay for type I collagen and type X collagen in the cartilage endplate among the three
groups( ×400)
表1 各组大鼠软骨终板Ⅰ型胶原、
Ⅹ型胶原免疫组织化学染色积分光密度值
Table 1 The IOD of type Ⅰ collagen and type Ⅹ collagen in immunohistochemical staining![]() 值)
值)
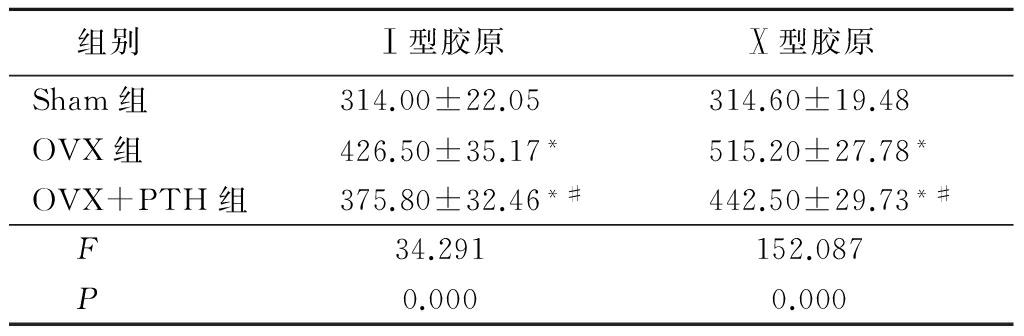
*P<0.05与Sham组比较 #P<0.05与OVX组比较(LSD-t检验)
3 讨 论
椎间盘退变的具体发病机制尚不清楚,椎间盘退变的病因、发病机制成为近年来研究的重点。目前,用于研究椎间盘退变的动物模型有很多种,如纤维环穿刺法[9-13],软骨终板损伤法[14],髓核注射消化酶法[15-18]等。本课题组前期研究结果显示,卵巢切除大鼠椎体骨量减少与椎间盘退变呈正相关性[2,4-7]。并且经骨质疏松治疗药物(阿仑膦酸钠或鲑鱼降钙素)干预可有效延缓卵巢切除大鼠腰椎间盘退变进程。椎间盘作为人体内最大的无血管器官,其营养主要通过软骨终板将椎体血窦中的营养物质以弥散的方式进行供给,如果椎间盘软骨终板发生改变,将进一步影响椎间盘的营养供给[19]。因此,本研究通过卵巢切除术建立骨质疏松相关椎间盘退变动物模型,应用PTH(1-34)进行干预,通过组织学染色及免疫组织化学染色等方法,进一步说明PTH(1-34)对卵巢切除大鼠软骨终板营养代谢的影响。
椎间盘退变的具体发病机制尚不明确,在引起椎间盘退变的各种原因中,软骨终板结构和功能的完整性在椎间盘退变过程中的作用越来越受到了人们的重视。软骨终板是位于椎体与椎间盘之间的薄层透明软骨,厚度约为1 mm,软骨终板上存在许多微孔,是椎间盘进行营养物质交换及代谢产物进出的通道。软骨终板下层的微小血管是椎间盘营养主要来源,营养物质经软骨终板的弥散作用进入到椎间盘。椎间盘的营养通路包含软骨终板营养通路与纤维环外侧营养通路。软骨终板对于维持脊柱生物力学传导、应力重新分布的过程起着至关重要的作用,与椎间盘一起共同维持着脊柱的正常形态和生理功能。
正常情况下,软骨终板退变是一个自然老化的过程,但同时受到多种因素的影响,并且在受到炎症、异常应力分布等情况下加速其退变过程。软骨终板退变在椎间盘退变过程中发挥着重要的作用。软骨终板的退变早于椎间盘的退变,有证据显示椎间盘退变是从软骨终板开始的[20]。各种因素作用于软骨终板引起软骨终板细胞外基质成分减少、水分丢失、细胞凋亡,导致钙化软骨层逐渐增厚,而钙化软骨的增多将引起软骨终板营养通路受阻,椎间盘营养减少及代谢废物的集聚,最终导致椎间盘细胞代谢障碍而出现凋亡坏死,引起椎间盘退变的发生。在本研究中,大鼠椎间盘软骨终板经van Gieson染色后发现,OVX组软骨终板内可见透明软骨层中大量骨样组织形成,在骨样组织中可见髓腔及血细胞;与OVX组相比,OVX+PTH组软骨终板可见少量的骨样组织及髓腔形成,透明软骨细胞排列较规则。
椎间盘退变过程中,软骨终板细胞外基质代谢的改变亦发挥着重要的作用。软骨终板属于透明软骨,主要由透明软骨细胞及丰富的细胞外基质组成,不含有神经、血管等组织。当软骨细胞功能发生改变时,基质的合成及代谢过程亦会发生相应的改变,从而导致软骨终板生物力学功能及生理功能随之发生变化,进一步导致椎间盘退变的发生。Ⅰ型胶原是脊椎动物体内最丰富的胶原,主要由成骨细胞、成纤维细胞合成。正常椎间盘软骨终板内主要为Ⅱ胶原表达,当软骨终板出现钙化时,钙化组织及其周边细胞外基质中出现Ⅰ型胶原表达。Ⅰ型胶原的表达提示软骨终板退变的发生。此外,本研究同时对软骨终板内Ⅹ型胶原进行免疫组织化学染色及定量分析。Ⅹ型胶原的表达与软骨终板钙化密切相关。Ⅹ型胶原在人类出生后即从椎间盘的基质中消失,而当椎间盘发生退变时,在软骨细胞中重新出现。Ⅹ型胶原是由肥大软骨细胞合成分泌的,在软骨骨化和基质钙化过程中发挥着重要的作用。Ⅹ型胶原与基质血管相连可能会激活钙通道,引起钙离子快速流入基质血管,同时钙离子可以促进Ⅹ型胶原的产生[21]。Ⅹ型胶原的增加为钙化提供适宜的环境,不正常的钙化可能会影响椎间盘的营养,从而引发病理变化[22]。Ⅹ型胶原的表达与椎间盘软骨终板钙化密切相关。在本研究中,OVX组与Sham组相比,软骨终板内骨样组织及其周边的软骨基质中Ⅰ型胶原及Ⅹ型胶原呈强阳性表达,而OVX+PTH组软骨终板内Ⅰ型胶原及Ⅹ型胶原表达明显低于OVX组。提示PTH可有效抑制卵巢切除大鼠椎间盘软骨终板的退变进程。
综上所述,皮下注射甲状旁腺素(1-34)可有效抑制卵巢切除大鼠腰椎间盘软骨终板内钙化组织的形成,并可有效降低Ⅰ型胶原及Ⅹ型胶原的表达。
[参考文献]
[1] 彭宝淦,施杞,沈培芝,等.软骨终板钙化与椎间盘退变关系的实验研究[J].中华外科杂志,1999,37(10):613-616.
[2] Tian FM,Li SY,Yang K,et al. Orally administered simvastatin partially preserves lumbar vertebral bone mass but not integrity of intervertebral discs in ovariectomized rats[J]. Exp Ther Med,2017,13(3): 877-884.
[3] Liu CC,Tian FM,Zhou Z,et al. Protective effect of calcitonin on lumbar fusion-induced adjacent-segment disc degeneration in ovariectomized rat[J]. BMC Musculoskelet Disord,2015,16:342.
[4] Luo Y,Zhang L,Wang WY,et al. The inhibitory effect of salmon calcitonin on intervertebral disc degeneration in an ovariectomized rat model[J]. Eur Spine J,2015,24(8):1691-1701.
[5] Zhou Z,Tian FM,Wang P,et al. Alendronate Prevents Intervertebral Disc Degeneration Adjacent to a Lumbar Fusion in Ovariectomized Rats[J]. Spine(Phila Pa 1976),2015,40(20):E1073-1083.
[6] Tian FM,Yang K,Wang WY,et al. Calcitonin suppresses intervertebral disk degeneration and preserves lumbar vertebral bone mineral density and bone strength in ovariectomized rats[J]. Osteoporos Int,2015,26(12):2853-2861.
[7] Song H,Luo Y,Wang W,et al. Effects of alendronate on lumbar intervertebral disc degeneration with bone loss in ovariectomized rats[J]. Spine J,2017,17(7):995-1003.
[8] Zhou Z,Tian FM,Gou Y,et al. Enhancement of Lumbar Fusion and Alleviation of Adjacent Segment Disc Degeneration by Intermittent PTH(1-34) in Ovariectomized Rats[J]. J Bone Miner Res,2016,31(4):828-838.
[9] Lei T,Zhang Y,Zhou Q,et al. A novel approach for the annulus needle puncture model of intervertebral disc degeneration in rabbits[J]. Am J Transl Res,2017,9(3):900-909.
[10] Yang CH,Chiang YF,Chen CH,et al. The effect of annular repair on the failure strength of the porcine lumbar disc after needle puncture and punch injury[J]. Eur Spine J,2016,25(3):906-912.
[11] Xin L,Zhang C,Zhong F,et al. Minimal invasive annulotomy for induction of disc degeneration and implantation of poly lactic-co-glycolic acid) (PLGA) plugs for annular repair in a rabbit model[J]. Eur J Med Res,2016,21:7.
[12] Xin L,Xu W,Yu L,et al. Effects of annulus defects and implantation of poly(lactic-co-glycolic acid) (PLGA)/fibrin gel scaffolds on nerves ingrowth in a rabbit model of annular injury disc degeneration[J]. J Orthop Surg Res,2017,12(1):73.
[13] 王字兴,蔚芃.建立纤维环穿刺法椎间盘退变模型[J].中国组织工程研究,2017,21(12):1855-1860.
[14] Fern ndez-Susavila H,Pardo-Seco JP,Iglesias-Rey R,et al. Model of disc degeneration in rat tail induced through a vascular isolation of vertebral endplates[J]. J Invest Surg,2017,25:1-10.
ndez-Susavila H,Pardo-Seco JP,Iglesias-Rey R,et al. Model of disc degeneration in rat tail induced through a vascular isolation of vertebral endplates[J]. J Invest Surg,2017,25:1-10.
[15] Oehme D,Ghosh P,Goldschlager T,et al. Reconstitution of degenerated ovine lumbar discs by STRO-3-positive allogeneic mesenchymal precursor cells combined with pentosan polysulfate[J]. J Neurosurg Spine,2016,24(5):715-726.
[16] Peeters M,Detiger SE,Karfeld-Sulzer LS,et al. BMP-2 and BMP-2/7 Heterodimers Conjugated to a Fibrin/Hyaluronic Acid Hydrogel in a Large Animal Model of Mild Intervertebral Disc Degeneration[J]. Biores Open Access,2015,4(1):398-406.
[17] Detiger SE,Helder MN,Smit TH,et al. Adverse effects of stromal vascular fraction during regenerative treatment of the intervertebral disc: observations in a goat model[J]. Eur Spine J,2015,24(9):1992-2000.
[18] Gullbrand SE,Malhotra NR,Schaer TP,et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration[J]. Osteoarthritis Cartilage,2017,25(1):146-156.
[19] 邹岩,任栋,王鹏程.椎间盘损伤的研究进展[J].河北医科大学学报,2014,35(12):1475-1479.
[20] 陆华拓,徐永清.椎间盘软骨终板退变及其相关研究的进展[J].西南国防医药,2009,19(6):654-656.
[21] Enomoto A,Watahiti J,Nampo T,et al. Mastication markedly affects mandibular condylar cartilage growth,gene expression,and morphology[J]. Am J Orthod Dentofacial Orthop,2014,146(3):355-363.
[22] 张恒,周庄,勾禹,等.甲状旁腺激素对椎间盘退变的影响及研究进展[J].中国综合临床,2015,31(4):375-378.