近年来,乳腺癌发病率呈增长趋势,已成为严重危害女性生命健康的第一大疾病[1]。对于临床分期Ⅰ期或部分Ⅱ期患者,单独的手术治疗具有显著的疗效,但对于Ⅲ期患者,需在术前进行新辅助化疗(neoadjuvant chemotherapy,NAC),即采用细胞毒性药物进行全身系统性的治疗,以缩小病灶直径或清除微转病灶,提高治疗效果和患者远期生存率[2]。然而,由于化疗周期长,疗效个体差异大,故临床迫切需要寻找简单、有效且重复性好的指标评估NAC疗效,以指导后期化疗方案的制定,达到减少或避免无效化疗的目的。触诊和病理学检查是临床NAC疗效评估的主要方法,但触诊受医师的主观因素影响大,而病理学检查具有滞后性[3]。随着影像学技术的快速发展,CT、磁共振成像、超声造影、剪切波弹性成像(shear-wave elastography,SWE)、超声光散射成像技术(US-diffuse optical tomography,US-DOT)等逐渐用于NAC疗效评估中。SWE技术通过测定乳腺癌病灶硬度(组织弹性模量值)评估肿瘤的病理进程,研究显示良恶性病变具有显著不同的组织弹性模量值[4],这为SWE技术用于NAC疗效评估肿瘤进程奠定了理论基础[5]。本研究采用SWE技术评估乳腺癌NAC疗效,并分析弹性模量值与肿瘤总血红蛋白浓度(total hemoglobin concentration,HbT)的相关性,旨在探讨SWE定量分析在乳腺癌辅助化疗疗效评估中的应用价值。
1 资料与方法
1.1 一般资料 选择2015年1月—2016年1月我院收治的乳腺癌患者56例,共56个病灶。患者年龄33~64岁,平均(49.6±4.6)岁;病灶位于左侧40例,右侧16例;病理类型:浸润性导管癌21例,原位癌20例,腺癌11例,浸润性小叶癌4例;病灶直径1~8 cm,平均(4.0±0.9) cm。
纳入标准:①符合中国抗癌协会乳腺癌诊治指南与规范(2015版)[6]中的诊断标准;②经病理证实为原发性浸润性乳腺癌;③单发病灶;④首次发病,无乳腺癌病史;⑤临床分期Ⅲ期;⑥自愿参与本研究,并签署知情同意书。排除标准:①合并其他类型恶性肿瘤者;②临床分期Ⅰ期或Ⅱ期者;③不接受NAC治疗者;④合并肝、肾、心脑血管疾病患者;⑤合并免疫性疾病患者;⑥孕妇或妊娠期妇女。
本研究经医院伦理委员会批准。
1.2 方法
1.2.1 治疗方案 所有患者均经NAC后进行外科手术切除。化疗方案:静脉注射环磷酰胺500 mg/m2、多西他赛70 mg/m2,3周为1个周期,共4个周期。化疗结束后2周进行手术切除。
1.2.2 SWE检查 化疗前后,由2名高年资医师(工作10年以上)采用SWE检查测定组织弹性模量值。应用PHILIPS EPIQ 7超声诊断仪,配备L12-5线阵弹性探头,频率4~15 MHz。患者仰卧位,充分露出乳腺和腋窝。采用常规超声模式扫描,了解乳腺癌病灶的声像表现,记录声像图和病灶直径。然后切换至弹性成像模式,在病灶处连续平行缓慢移动探头,不同切面扫描并静置3 s,找到弹性值颜色最深的切面,图像稳定后记录探头位置和方向,并定帧存图。采用设备提供的测量方法,选择直径为2 mm的圆形取样框,在弹性值颜色最深区域选择感兴趣区,测定感兴趣区的最大弹性模量值。每个病灶重复测定3次,记录平均值,病灶的最大弹性模量值为2名医师测定的最大弹性模量值的平均值。计算最大弹性模量值降低率(%)=(化疗前最大弹性模量值-化疗后最大弹性模量值)/化疗前最大弹性模量值×100%,肿瘤直径降低率(%)=(化疗前肿瘤直径-化疗后肿瘤直径)/化疗前肿瘤直径×100%。
1.2.3 HbT测定 化疗前后,由2名高年资医师(工作10年以上)采用OPTLMUS-Ⅱ型超声光散射乳腺成像系统(新奥博为技术有限公司)测定病灶的HbT值。患者平卧,常规超声检查确认病灶的位置,存储声像图,然后启动光学装置,进行多波段激光慢散色断层成像,记录病灶的光学信号,并扫描对侧正常乳腺组织作为对照。采用软件自带的图像处理系统进行图像重建,生成组织血液功能三维断层图像,并输出报告,给出HbT水平。每个病灶由每个医师测定3次,共测定6次,计算6次测定的平均值,计算HbT降低率(%)=(化疗前HbT-化疗后HbT)/化疗前HbT×100%
1.3 判断标准 病理学疗效判断标准(金标准):采用Miller & Payne分级,分为G1级(没有或仅个别肿瘤细胞发生变化,肿瘤细胞数量无减少)、G2级(肿瘤细胞减少<30%)、G3级(30%≤肿瘤细胞减少<90%)、G4级(90%≤肿瘤细胞减少<100%)、G5级(无肿瘤细胞存在)。将G3+G4+G5归为病理反应显著;G1+G2归为病理反应非显著。
1.4 NAC疗效评价标准 采用实体瘤疗效评价标准RECIST 1.1(Response Evaluation Criteria in Solid Tumors 1.1,2009年修订)[7]评估:完全缓解(complete remission,CR),病灶消失,无新病灶出现;部分缓缓解(partial remission,PR),病灶直径综合低于基线≥30%);稳定(stable disease SD),不符合CR、PR和进展(progressive disease,PD);PD,目标病灶直径总和增大20%或出现新病灶。将CR+PR归为病理反应显著;SD+PD归为病理反应非显著。
SWE技术测定的最大弹性模量值判定NAC疗效标准[8]:最大弹性模量值降低率≥30%归为病理反应显著;最大弹性模量值降低率<30%或为负值归为病理反应非显著。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用独立样本的t检验和配对t检验;相关性采用Pearson相关性分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 NAC疗效评估 以组织病理学疗效标准评估NAC疗效,56例患者经NAC化疗后,G1级4例,G2级8例,G3级31例,G4级10例,G5级3例,即病理反应显著44例,病理反应非显著12例;以RECIST1.1标准评估NAC疗效,CR 3例,PR 34例,SD 12例,PD 7例,即病理反应显著37例,病理反应非显著19例。SWE技术测定最大弹性模量值的典型图像,见图1。
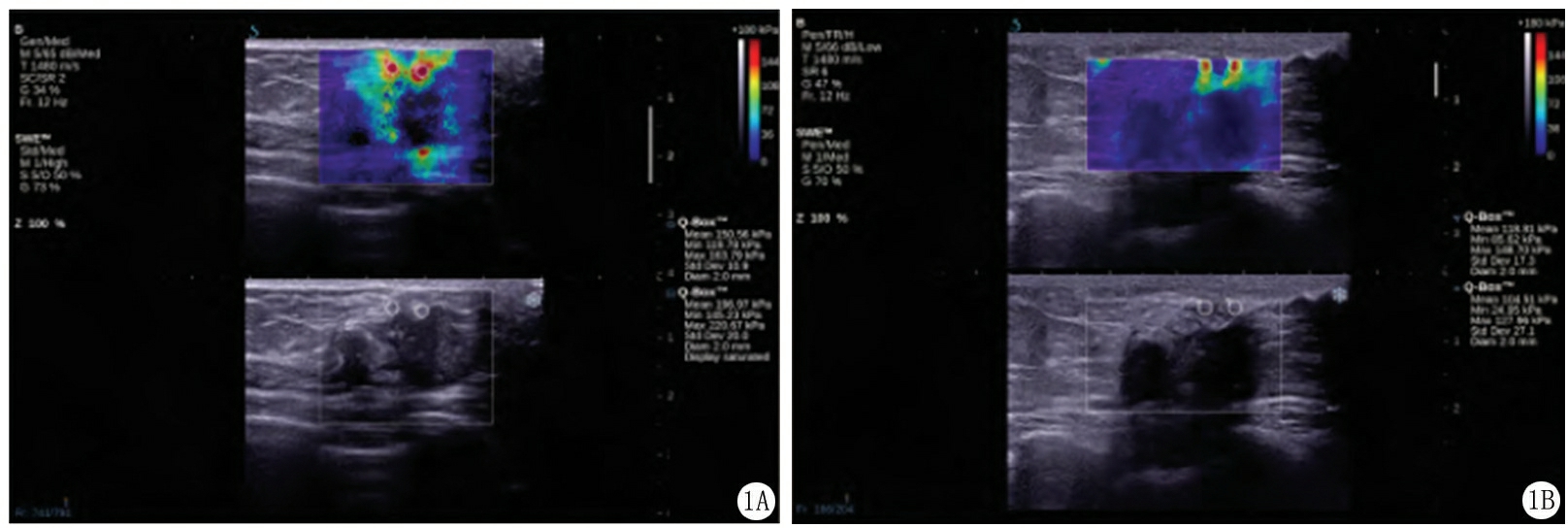
图1 新辅助化疗前后剪切波弹性成像图
A.化疗前;B.化疗后,乳腺癌最大弹性模量值降低,病灶硬度减小,最大弹性模量值降低率为40%,病理显示残留肿瘤细胞比例为22%,病理疗效分级为G3级。
Figure 1 Shear wave elastic imaging of patients before and after neoadjuvant chemotherapy
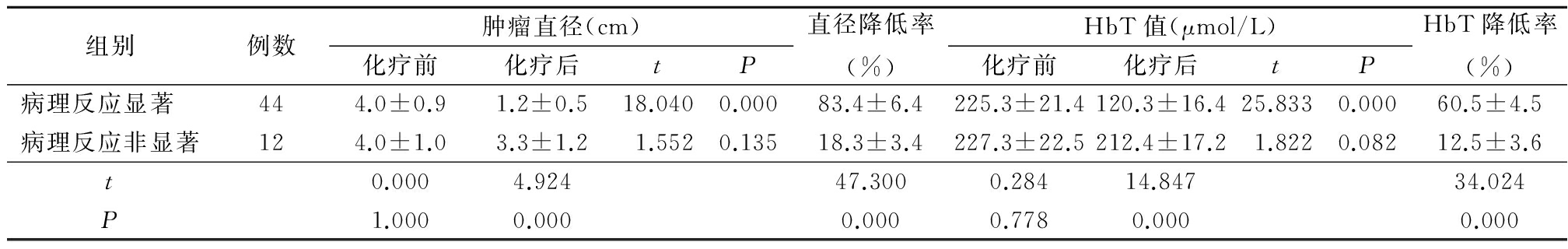
2.2 不同病理学疗效分组肿瘤直径、HbT值比较 病理反应显著组化疗后肿瘤直径、HbT值显著降低(P<0.05),且化疗后的肿瘤直径及肿瘤直径降低率、HbT值及HbT值降低率与病理反应非显著组差异有统计学意义(P<0.05),见表1。
表1 不同分组肿瘤直径和HbT比较
Table 1 Comparison of tumor diameter and HbT level in different groups
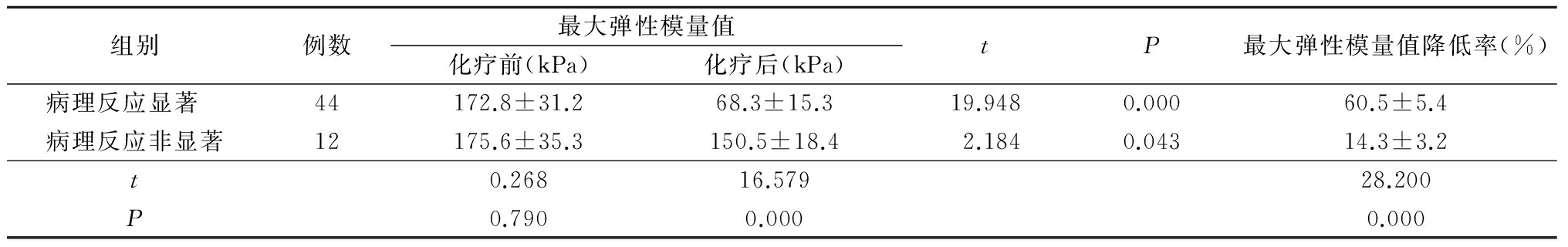
2.3 不同病理学疗效分组最大弹性模量值比较 2组化疗后最大弹性模量值均显著降低(P<0.05),但病理反应显著组化疗后最大弹性模量值及最大弹性模量值降低率与病理反应非显著组差异有统计学意义(P<0.05),见表2。
表2 不同分组最大弹性模量值比较
Table 2 Comparison of maximum modulus of elasticity in different groups![]()
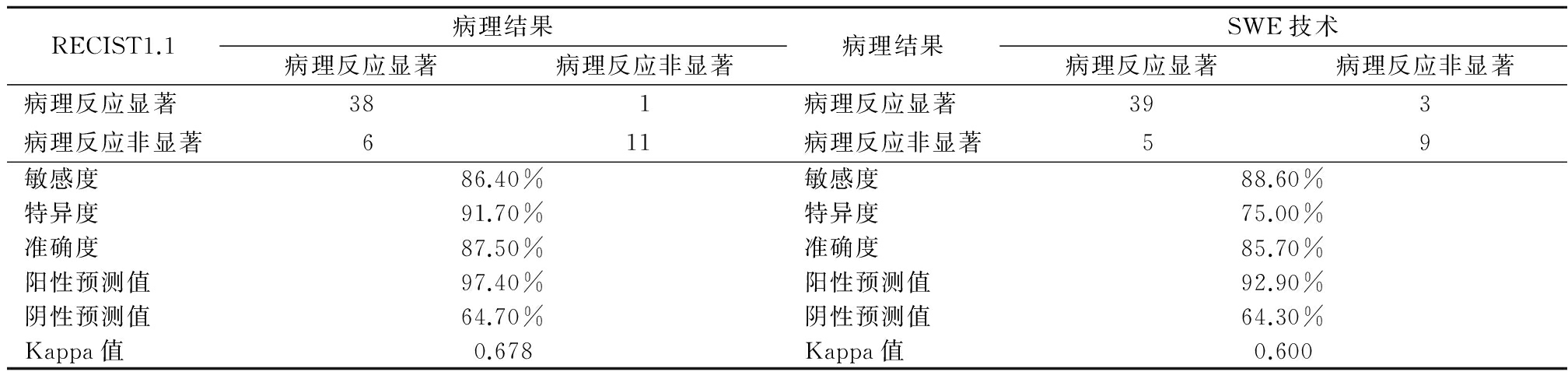
2.4 不同疗效评估方法评估NAC疗效效能比较 分别采用RECIST 1.1、SWE技术评估NAC疗效,其敏感度、特异度、准确度差异均无统计学意义(P>0.05),见表3。
表3 不同疗效评估方法评估效能比较
Table 3 Comparison of evaluation efficacy of different evaluation methods (例数)
2.5 最大弹性模量值与HbT的相关性分析 Pearson相关性分析表明,NAC化疗前后肿瘤直径降低率与HbT降低率呈正相关(r=0.776,P=0.000), 最大弹性模量值降低率与肿瘤直径降低率呈显著正相关(r=0.833,P=0.000),最大弹性模量值降低率与HbT降低率呈显著正相关(r=0.785,P=0.000),见图2。
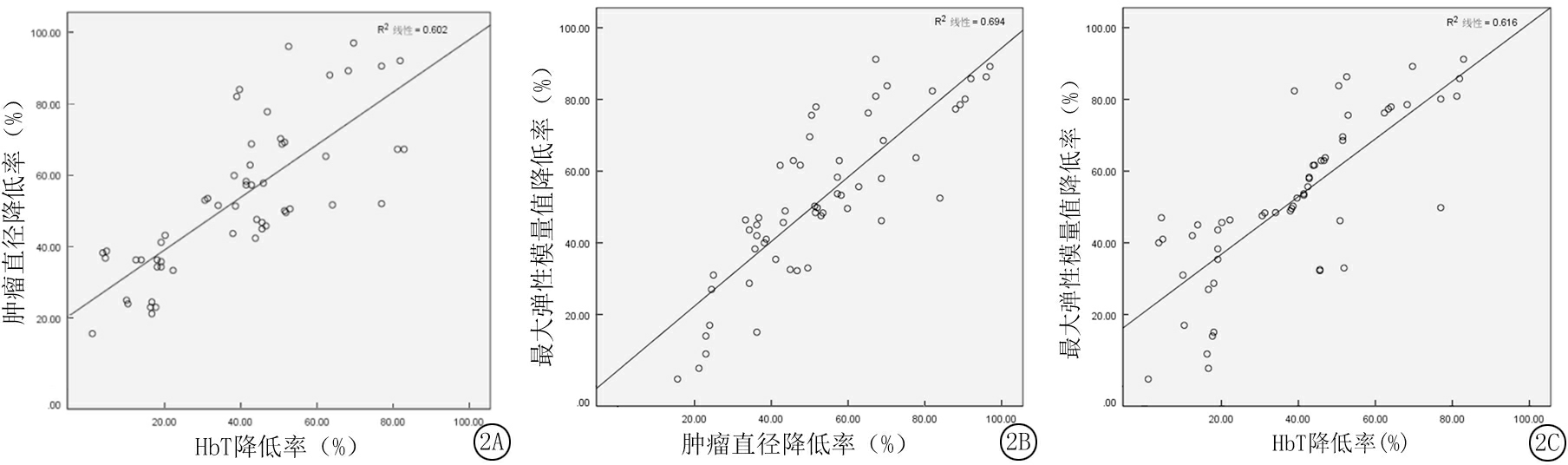
图2最大弹性模量值与肿瘤直径相关性分析
A.肿瘤直径与HbT相关性分析;B.最大弹性模量值与肿瘤直径相关性分析;C.最大弹性模量值与HbT相关性分析
Figure 2 Correlative analysis of maximum elastic modulus value and HbT
3 讨 论
乳腺癌新辅助化疗通过缩小病灶体积为手术切除创造了有利条件,提高了保乳手术率,并改善预后,但仍存在一定的不足,20%的患者对NAC药物不敏感,其长时间、多疗程的化疗会延误局部治疗时机,降低疗效[9]。因此,采取适宜的手段评估NAC治疗个体疗效,以停止无效的化疗疗程或变更化疗方案,对于提高乳腺癌治疗效果具有重要价值。NAC疗效评估的方法有很多,但目前尚无业界公认的评估方法。有研究显示,乳腺癌病灶内部和周边的基质信号有助于NAC疗效的预测,而SWE技术则能够充分评估乳腺癌肿块中心到周围基质成分硬度的变化情况,可作为NAC疗效预测的影像学手段[10]。
SWE技术是近年来新发展起来的一种新的弹性成像技术,通过测定组织的杨氏模量的绝对值(kPa)评估组织的硬度[11]。据报道,恶性肿块细胞含量多,基质结构紧密,在组织学上表现出不均一性,容易形成淋巴细胞浸润和坏死,硬度较良性病变大,故在SWE图像上显示为不均一的硬(红),弹性模量值较高,这是SWE技术用于乳腺癌病灶诊断的基础[12]。袁沙沙等[13]报道,SWE测定的ROI部位、取样框的选择均会影响乳腺癌病灶弹性模量平均值的测量,而病灶的最大弹性模量值只有一个。因此,本研究选择最大弹性模量值为指标,以评估SWE技术预测NAC疗效的预测效果,结果发现病理反应显著组与病理反应非显著组化疗后最大弹性模量值均显著降低(P<0.05),但病理反应显著组最大弹性模量值降低率显著高于病理反应非显著组(P<0.05)。提示乳腺癌病灶NAC治疗过程中,病灶的最大弹性模量值变化与乳腺癌NAC疗效密切相关。将最大弹性模量值降低率≥30%归为病理反应显著,结果发现SWE技术评估NAC疗效的敏感度、特异度、准确度和Kappa值分别为88.6%、75.0%、85.7%和0.600,与临床常用的RECIST1.1标准评估NAC疗效的敏感度、特异度、准确度和Kappa值比较,差异均无统计学意义(P>0.05)。表明SWE技术评估NAC疗效,与通过测量病灶的最大直径评估NAC疗效,无明显的高估或低估,其评估NAC疗效效果良好。
乳腺癌NAC过程中的生物学特征转归较病灶直径的变化更早,故以病灶的生物学特征评估疗效和指导治疗,较形态学更具有临床意义[8]。乳腺癌是一种血管依赖病变,血管新生对于肿瘤的发生和发展至关重要。恶性肿瘤血管生长旺盛,其肿瘤血红蛋白含量可间接反映病灶血管的变化情况,对于肿瘤转化和NAC疗效预测具有重要作用。有研究显示,乳腺癌化疗过程中HbT的变化与病灶直径变化和疗效密切相关[14]。本研究显示SWE技术测定的最大弹性模量值评估NAC疗效效果良好,而最大弹性模量值变化是否能够反映HbT的变化,目前尚无文献报道。本研究病理反应显著组与病理反应非显著肿瘤直径降低率、HbT值降低率之间差异有统计学意义(P<0.05),肿瘤直径降低率与HbT降低率呈正相关(r=0.776,P=0.000)。表明NAC化疗过程中,随着肿瘤HbT降低,病灶直径减小,与董彦等[8]研究结果一致。本研究进一步相关性分析发现,最大弹性模量值降低率与HbT降低率呈显著正相关(r=0.785,P=0.000)。表明最大弹性模量值可在一定程度上反映乳腺癌的HbT含量。分析认为,乳腺癌经NAC后,化疗药物破坏新生血管,使得肿瘤细胞增殖减慢、坏死,病灶HbT水平和肿瘤细胞数量减少,基质结构变得松散,体积减小,硬度降低,故最大弹性模量值减小。
总之,SWE技术测定乳腺癌病灶NAC过程中最大弹性模量值的变化,与肿瘤血红蛋白含量变化密切相关,可间接反映病灶血管新生情况和NAC中癌细胞的残留量变化,为NAC疗效评估提供了一种快速、准确、无创的新方法。
[参考文献]
[1] 王展海,钱龙江,左益华,等.益肾健脾汤辅助治疗乳腺癌术后化疗所致不良反应疗效观察[J].河北医科大学学报,2012,33(10):1189-1190.
[2] 杨良权,娄欢欢,周东光,等.不同分子分型乳腺癌新辅助化疗对TopⅡα蛋白表达的影响[J].河北医科大学学报,2017,38(2):230-233.
[3] 石桥,黄嵘,郭丽,等.MR多参数联合评估局部进展期乳腺癌新辅助化疗疗效的应用价值[J].临床放射学杂志,2015,34(4):539-543.
[4] Chang JM,Park IA,Lee SH,et al. Stiffness of tumours measured by shear-wave elastography correlated with subtypes of breast cancer[J]. Eur Radiol,2013,23(9):2450-2458.
[5] Sim YT,Vinnicombe S,Whelehan P,et al. Value of shear-wave elastography in the diagnosis of symptomatic invasive lobular breast cancer[J]. Clin Radiol,2015,70(6):604-609.
[6] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2013,25(9):692-754.
[7] Eisenhauer EA,Therasse P,Bogaerts J,et al. New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J]. Eur J Cancer,2009,45(2):228-247.
[8] 董彦,常才,强金伟,等.超声光散射技术对于乳腺癌新辅助化疗临床疗效的评价作用[J].中华超声影像学杂志,2014,23(12):1065-1069.
[9] 崔建春,李立,董齐.乳腺癌新辅助化疗效果评价方法的研究进展[J].肿瘤研究与临床,2017,29(2):133-137.
[10] Liu C,Li X,Hua W,et al. Porous Matrix Stiffness Modulates Response to Targeted Therapy in Breast Carcinoma[J]. Small,2016,12(34):4675-4681.
[11] Cosgrove DO,Berg WA,Doré CJ,et al. Shear wave elastography for breast masses is highly reproducible[J]. Eur Radiol,2012,22(5):1023-1032.
[12] 樊智颖,王学梅,康姝,等.乳腺浸润癌剪切波弹性成像与临床病理,免疫组化特征相关性分析[J].中国医科大学学报,2014,43(4):344-346.
[13] 袁沙沙,程莹莹,杨春雪,等.剪切波弹性成像评价乳腺癌新辅助化疗的疗效[J].中国医学影像技术,2016,32(1):71-74.
[14] 毛世华,张涛,谈宗国,等.178例宫颈癌放疗疗效及预后相关因素分析[J].实用癌症杂志,2014,18(7):829-831.