急性心肌梗死(acute myocardial infarction,AMI)是一种严重威胁人类健康的常见心血管疾病。AMI病理基础是指冠状动脉突发闭塞,导致心肌供血消失,进而导致心肌发生缺血坏死[1],心肌梗死预后差,除持久的胸痛症状外,其可能伴发一系列危及生命的并发症,如恶性心律失常、心脏破裂、急性心力衰竭、心源性休克以及猝死等[2]。因此,尽早开通梗死相关动脉(infarct related artery,IRA),恢复血供,对挽救残存心肌、减小梗死面积、改善患者预后至关重要。但IRA的开通并不代表着心肌灌注的恢复,无复流现象是影响心肌灌注的重要因素。无复流现象明显降低了急诊 经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)对 AMI 患者的获益,影响AMI患者预后。这也就意味着,AMI 再灌注治疗不仅要开通IRA,同时还要重建心肌微循环以保证心肌组织灌注。AMI 患者常并发SHG,其可诱发一系列不良生理反应,进而明显降低缺血预处理对心肌缺血-再灌注损伤的益处,加重心肌受损[3]。另外,SHG可明显增加PCI术中无复流现象的发生,进而影响AMI患者的预后[4]。因此,如何有效降低此类患者无复流发生及改善患者预后是一个亟待解决的问题。本研究旨在观察胰岛素强化治疗SHG对AMI患者急诊PCI术中无复流以及术后心肌灌注的影响,评估该治疗的安全性及有效性。
1 资料与方法
1.1 一般资料 选择2013年7月—2016年7月于我院接受急诊PCI治疗的合并SHG的ST段抬高的心机梗死(ST segment elevation myocardial infarction,STEMI)患者106例,所有患者均符合1999年美国心脏病学会(American College of Cardiology,ACC)/美国心脏协会(American Heart Association,AHA)关于AMI的诊断标准,随机分为2组。治疗组56例,男性37例,女性39例,年龄53~76岁,平均(64.28±10.02)岁;体质量指数(body mass index,BMI)24.6±2.7;高血压39例,高脂血症29例,吸烟者35例;Killip分级Ⅰ级35例,Ⅱ级11例,Ⅲ级8例,Ⅳ级2例。对照组50例,男性32例,女性34例,年龄56~76岁,平均(65.68±8.97)岁;BMI 25.1±2.3;高血压34例,高脂血症25例,吸烟者25例;Killip分级Ⅰ级30例,Ⅱ级12例,Ⅲ级5例,Ⅳ级3例。2组性别、年龄、BMI、高血压、高血脂症、吸烟者、Killip分级等差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准;患者均签署知情同意书。
1.2 入选标准和排除标准 入选标准:AMI发生12 h内入院,符合SGH诊断标准[5](随机血糖≥11.1 mmol/L)。排除标准:糖尿病、糖化血红蛋白>6.5%、2周后行口服糖耐量实验异常、陈旧性心肌梗死、既往行冠状动脉搭桥、严重心功能不全、严重瓣膜性心脏病、严重肝肾功能不全、合并重症感染、血液系统疾病、恶性肿瘤、严重内分泌代谢疾病和需使用糖皮质激素治疗疾病者。
1.3 治疗
1.3.1 基础治疗 所有入选的AMI患者均接受急诊冠状动脉造影检查,根据造影情况决定PCI,治疗目的是开通IRA恢复心肌血供。急诊手术中只处理梗死相关动脉。入选患者均接受标准的AMI药物治疗:抗凝、双联抗血小板治疗,使用β受体阻滞剂、他汀类降脂药和血管紧张素转化酶抑制剂等。
1.3.2 胰岛素治疗 ①对照组给予糖尿病饮食,随机血糖<18 mmol/L时,暂不用胰岛素治疗;随机血糖>18 mmol/L时,临时给予诺和锐皮下注射。血糖控制标准:空腹<10 mmol/L,餐后血糖<18 mmol/L。②治疗组给予糖尿病饮食,入组后立即给予诺和锐泵入,起始剂量0.1 U·kg-1·h-1,随后根据随机血糖调整泵速。血糖控制标准:餐前4.0~6.1 mmol/L,餐后4.0~9.0 mmol/L。胰岛素强化治疗时间为7 d。
1.4 观察指标 观察2组入院至球囊扩张时间、发病至球囊扩张时间、术后TIMI分级(TIMI<2级定义为无复流)、病变血管数、植入支架数、靶病变血管数、应用主动脉内球囊反搏(intra-aortic balloon pump,IABP)数、应用临时起搏器数;比较2组术前和术后超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin 6,IL-6)水平;对比2组心肌显像峰值强度、曲线上升至平台期的平均斜率、峰浓度、达峰时间和心肌灌注血流量;2组术前、术后30 d行心脏彩色超声检查,采集左心室射血分数(left ventricular ejection fraction,LVEF)、左心室收缩末容积指数(Left ventricular end systolic volume index,LVESVI)、室壁运动积分指数(wall motion score index,WMSI);患者出院后随访12个月,记录随访期间新发的主要不良心血管事件(major adverse cardiovascular events,MACE),包括靶血管再次重建、再发AMI、恶性心律失常(心跳骤停、室性心动过速、心室颤动、Ⅱ度或Ⅲ房室传导阻滞)、急性心力衰竭、肺水肿、死亡等。
1.5 统计学方法 应用SPSS 19. 0软件分析数据。计量资料比较分别采用独立样本的t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组PCI术中术后资料比较 2组入院至球囊扩张时间、发病至球囊扩张时间、术后TIMI分级、病变血管数、植入支架数、靶病变血管数、 应用IABP数、应用临时起搏器数差异均无统计学意义(P>0.05),见表1。
按TIMI<2级定义为无复流,治疗组无复流24.0%(12/56),低于对照组的40.0%(20/50),差异有统计学意义(χ2=2.323,P<0.05)。
表1 2组PCI术中术后资料比较
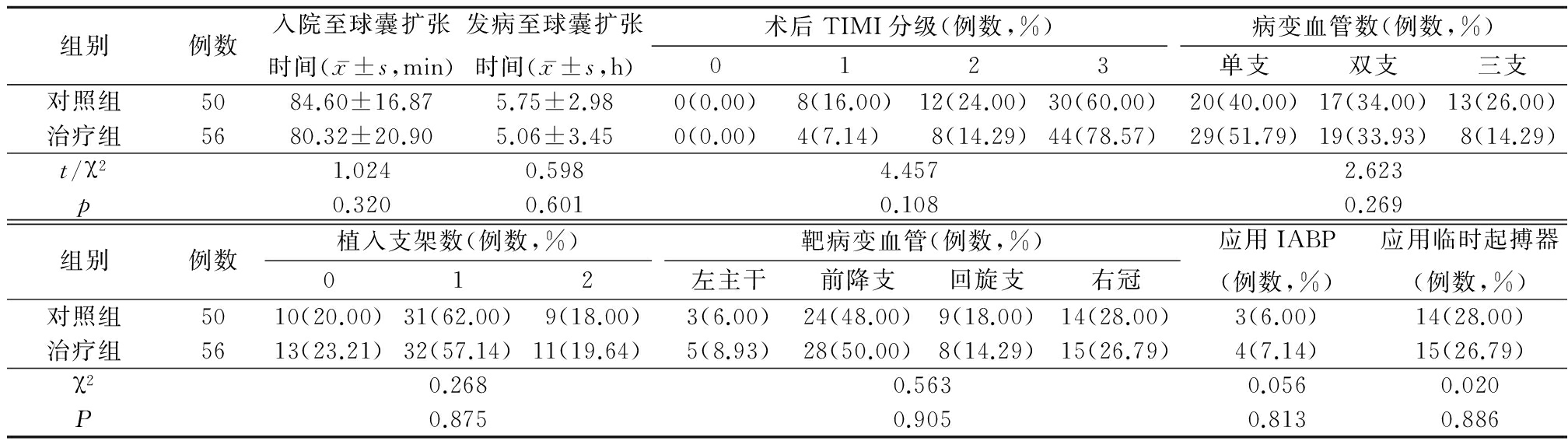
2.2 2组hs-CRP、TNF-α、IL-6水平变化 术前2组hs-CRP、IL-6和TNF-α差异均无统计学意义(P>0.05);术后1周2组hs-CRP、IL-6和TNF-α均较术前降低(P<0.05),但治疗组降低幅度更大,术后1周治疗组hs-CRP、TNF-α、IL-6水平均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组术前、术后各时点hs-CRP、IL-6、TNF-α水平变化![]()
*P<0.05与术前比较(配对t检验)
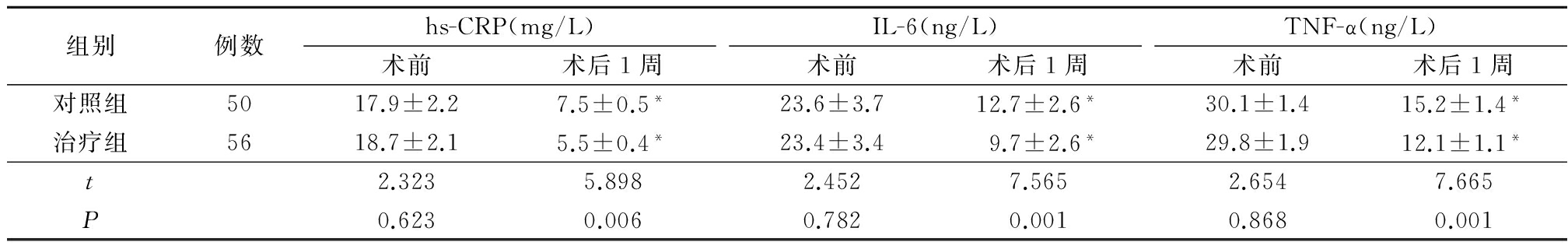
2.3 2组心肌灌注指标比较 术后1周治疗组心肌显像峰值强度、曲线上升至平台期的平均斜率、峰浓度、心肌灌注血流量均明显大于对照组,达峰时间明显短于对照组,差异有统计学意义(P<0.05),见表3。
表3 2组治疗后心肌灌注指标比较![]()
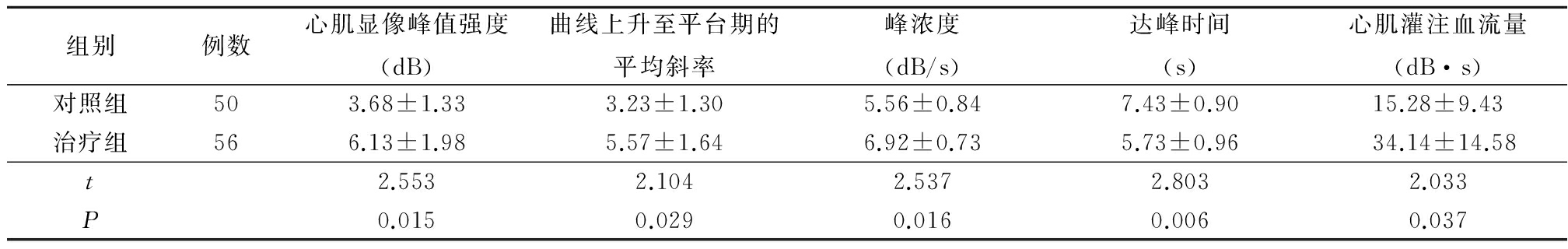
2.4 2组心脏彩色超声结果比较 2组术前LVEF、LVESVI和WMSI差异均无统计学意义(P>0.05)。术后30 d 2组 LVEF 水平明显升高,LVESVI水平明显下降,WMSI变化不大;术后30 d治疗组LVEF和 WMSI水平差异无统计学意义(P>0.05),而治疗组LVESVI低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 2组心脏超声结果比较![]()
*P<0.05与术前比较(配对t检验)
2.5 2组MACE发生率比较 在12个月的随访中,治疗组发生MACE 8例(14.3%),对照组发生MACE 12例(24.0%),2组MACE发生率差异无统计学意义(χ2=1.628,P>0.05)。
3 讨 论
SHG多发于严重疾病或创伤的危重症患者,是机体在应激状态下出现血糖升高的一种现象,是一种代偿表现。其病理机制为:当机体处于较高的应激反应下,出于机体自身保护,胰高血糖素、儿茶酚胺、皮质醇等升糖激素释放增多,而胰岛素分泌减少,此过程中伴有多种炎性细胞因子的大量释放,以上激素以及炎症因子协同作用导致了SHG[6-7]。研究表明,SHG能明显影响AMI患者心肌微循环灌注。其可能原因如下:高血糖影响冠状动脉微血管的内皮功能,从而导致微循环障碍[8];SHG可增强AMI后缺血缺氧所致的氧化应激反应,使以上微循环损伤加重[9];再灌注后黄嘌呤氧化酶的激活使得内皮细胞进一步激活[10],形成正反馈效应,进一步增强氧化应激反应,加重内皮细胞损伤;高糖可增强血小板活化,导致微血栓,同时释放的血栓素A2和5-羟色胺等血管活性物质增加微血管痉挛[11];心肌细胞膜钙超载、水钠潴留以及能量代谢异常等[12]。内皮细胞受损后,中性粒细胞浸润,引起局部炎症反应,同时炎症反应增加血管通透性,进而导致血细胞进入血管外,引起间质出血和血肿,导致血管外压迫[13],影响微循环。SHG具有加剧内皮细胞损伤、增强氧化应激,导致过度炎症反应以及过度激活血小板等不良影响,这些影响均是导致无复流现象的可能机制。
胰岛素除了降糖作用外,还有改善免疫功能、抗炎、抗氧化、抑制细胞凋亡、舒张血管等功能。胰岛素治疗可降低SGH对机体的损害,其可能机制是:通过增加单核细胞表面受体表达、调控细胞增殖和分化、抑制细胞凋亡,进而改善应激状态所致的免疫抑制,减轻高血糖引起的氧化应激反应[14]。此外,研究发现胰岛素还有明显的抗炎作用,可抑制机体过度的炎症反应,而其抗炎机制可能通过促进外周中性粒细胞凋亡、下调血浆TNF-α和CRP水平实现[15]。AMI患者应用胰岛素强化治疗SHG除了降低高糖影响外,还有改善免疫功能、抗炎、抗氧化等作用。以上作用可以改善心肌微灌注,减少心肌细胞损伤,延缓心肌细胞凋亡,进而改善患者预后。
本研究结果显示,应用胰岛素短期强化治疗AMI合并SHG,使血糖平稳下降至正常水平,治疗组无复流24.0%(12/56)低于对照组的40.0%(20/50)(χ2=2.323,P<0.05);治疗组AMI患者术后1周炎性指标hs-CRP、IL-6和TNF-α均较术前和对照组明显降低(P<0.05);治疗组术后1周心肌微灌注指标心肌显像峰值强度、曲线上升至平台期的平均斜率、峰浓度、心肌灌注血流量均明显大于对照组,达峰时间短于对照组(P<0.05);术后30 d 2组LVEF水平明显升高,LVESVI水平明显下降,WMSI变化不大,术后30 d治疗组LVEF和WMSI水平差异无统计学意义(P>0.05),而治疗组LVESVI低于对照组(P<0.05);随访12个月2组MACE事件发生率差异无统计学意义。表明AMI合并SHG立即泵入胰岛素,可以降低高糖引起的不良损害,降低机体过度的炎症反应,减弱氧化应激反应,进而改善心肌微灌注和心功能,减少患者并发症和提高患者生存质量。
综上所述,早期胰岛素强化治疗SHG对改善AMI患者心肌微灌注及预后具有的重要临床意义。
[参考文献]
[1] Chen Y,Yang X,Meng K,et al. Stress-induced hyperglycemia after hip fracture and the increased risk of acute myocardial infarction in nondiabetic patients[J]. Diabetes Care,2013,36(10):3328-3332.
[2] Koraĉeviĉ G,Vasiljeviĉ S,Velickoviĉ-Radovanoviĉ R,et al. Stress hyperglycemia in acute myocardial infarction[J]. Vojnosanit Pregl,2014,71(9):858-869.
[3] 郭瑄,高延,王鸿,等.NT-proBNP水平对ACS患者冠脉病变及介入治疗后左室功能的预测价值[J].山西医科大学学报,2013,44(1):24-28.
[4] 杨颖,宋达,耿巍,等.应激性高血糖对急诊冠状动脉介入治疗后无复流现象及预后的影响[J].贵州医药,2017,41(3):301-302.
[5] 丁峰,吴亚杰,樊朝美,等.急性心肌梗死合并糖尿病患者血浆B型钠尿肽水平预测主要心脏不良事件的价值[J].中华老年心脑血管病杂志,2014,16(5):494-496.
[6] 李林,王长强.胰岛素强化治疗危重创伤患者应激性高血糖的效果[J].天津医药,2014,42(4):365-368.
[7] 何招辉,霍亚南.危重症患者血糖控制水平探索[J].江西医药,2014,49(9):931-935.
[8] Zein AF,Nasution SA,Purnamasari D,et al. The influence of hyperglycemia at admission on in-hospital arrhythmia patients with acute coronary syndrome[J]. Acta Med Indones,2015,47(4):291-296.
[9] Terlecki M,Bryniarski L,Bednarek A,et al. The risk of diabetes development in long-term observation of patients with acute hyperglycaemia during myocardial infarction[J]. Kardiologia Pol,2015,73(8):606-612.
[10] Morciano G,Giorgi C,Bonora M,et al. Molecular identity of the mitochondrial permeability transition pore and its role in ischemia-reperfusion injury[J]. J Mol Cell Cardiol,2015,78(8):142-153.
[11] Iwakura K. Stress hyperglycemia and microvascular obstruction after acute myocardial infarction[J]. J Cardiol,2015,65(4):270-271.
[12] Mapanga RF,Essop MF. Damaging effects of hyperglycemia on cardiovascular function:spotlight on glucose metabolic pathways [J]. Am J Physiol Heart Circ Physiol,2015,310(2):153-173.
[13] Kaszaki J,Wolf rd A,Szalay L,et al. Pathophysiology of ischemia-reperfusion injury[J]. Transplant Proc,2006,38(3):826-828.
rd A,Szalay L,et al. Pathophysiology of ischemia-reperfusion injury[J]. Transplant Proc,2006,38(3):826-828.
[14] Kulkarni R,Acharya J,Ghaskadbi S,et al. Thresholds of oxidative stress in newly diagnosed diabetic patients on intensive glucose-control therapy[J]. PLoS One,2014,9(6):e100897.
[15] 刘同华.胰岛素强化治疗对严重创伤伴有应激性高血糖患者中性粒细胞凋亡和炎症反应的影响[J].实用医学杂志,2013,29(20):3328-3330.