二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)是ω-3多不饱和脂肪酸的重要组成部分,对炎症的发展有重要的调控作用。爱斯基摩人有大量摄入海洋类动物的饮食习惯,最终发现爱斯基摩人的喘息性哮喘、红斑狼疮和风湿性关节炎等慢性炎症性疾病发病率显著下降,这与其饮食中含有丰富的DHA和EPA有重要关系。随着对ω-3多不饱和脂肪酸研究的不断深入,发现其衍生物消退素在急性肾损伤、急性肺损伤、溃疡性结肠炎、神经退行性病变的动物模型中均展示出良好的抗炎效果,为治疗炎症性疾病提供了新的思路。现就消退素的分类、生物合成、受体、作用机制以及在相关疾病中的作用综述如下。
1 消退素的分类以及生物合成
在炎症性疾病中,多种器官中均有天然表达的消退素,如视网膜、肾脏、血液以及呼吸道等。从细胞层面上看,在高表达LO的多形核细胞以及高表达阿司匹林乙酰化的环加氧酶(aspirin-cyclooxygenase-2,Aspirin-COX2)的血管内皮细胞内,能够产生相应的消退素类型。但是从体内获得的消退素非常有限,可以从深海鱼油等富含DHA和EPA的食物中摄取。
1.1 EPA的分类及生物合成 衍生于EPA的是消退素E(resolvin E,RVEs)系列,即RVE1~3。EPA在内皮细胞和白细胞的相互作用下由Aspirin-COX2、5-脂氧合酶(5-lipoxygenase,5-LOX)催化下形成RVE1以及RVE2。此外,也可以通过细胞色素P450单氧化酶以非依赖阿司匹林的方式催化而成。RVE1和RVE2均是依赖于炎症过程中有所增加的5-LOX合成的。但是RVE3有所不同,其合成不需要5-LOX,而是18-HEPE通过12/15-LOX产生的。RVE3可以在嗜酸性粒细胞中合成。
1.2 DHA的分类及生物合成 衍生于DHA的是消退素D(resolvin D,RVDs)系列,目前共发现6种,即RVD1~6。此外,通过阿司匹林诱导,消退素D还可以产生阿司匹林诱发型消退素D(aspirin triggered resolvin D,AT-RVDs),即AT-RVD1~4。RVDs的合成分为2种:阿司匹林依赖途径和非阿司匹林依赖途径。在非阿司匹林依赖途径中,DHA通过15-LOX和5-LOX的催化下形成RVD1、RVD2。与RVEs系列的合成一样,这些步骤可以发生在单个细胞内(如中性粒细胞、巨噬细胞),也可以发生在细胞之间(白细胞-内皮细胞,中性粒细胞-巨噬细胞)。关于RVD3~6的合成途径目前仍未有报道。在阿司匹林依赖途径中,DHA在Aspirin-COX2的催化下,经过类似的环氧化、脂氧化、水解过程,最终形成AT-RVD1-D4。
2 消退素的受体
目前消退素的受体还未得到全部的分离确认,RVD1的受体有2种:脂氧素A4受体(lipoxin A4 receptor,ALX)以及G蛋白偶联受体GPR32。RVD1与ALX、GPR32的结合具有剂量依赖性。AT-RVD1也可以激活ALX。ALX主要表达于单核细胞以及中性粒细胞上[1]。GPR32在巨噬细胞表达非常丰富。最近,RVD3、RVD5被证明也可以激活GPR32。有研究证明RVD2的受体为另外一个G蛋白偶联受体即GPR18,大多表达在单核细胞、巨噬细胞和中性粒细胞中[2]。RVE1的受体同样有2种,分别是趋化样因子受体1(chemokine-like receptor-1,CMKLR1/ChemR23)和白三烯B4受体(leukotriene B4 receptor 1,BLT1),均属于G蛋白偶联受体。RVE1与ChemR23的亲和力较强,并且ChemR23与ALX有36%的序列同源性。ChemR23主要表达在单核细胞类型的细胞上,如巨噬细胞、小胶质细胞、树突状细胞。BLT1主要分布于单核巨噬细胞、中性粒细胞、效应T细胞以及肥大细胞表面,RVE1激活BLT1引起的下游信号转导的能力显著低于白三烯B4(leukotriene B4,LTB4),所以在炎症反应中,RVE1能够通过抑制LTB4的致炎效应发挥抗炎作用。RVE2类似于RVE1,也可以作用于BLT1[3]。
3 消退素参与的炎症信号通路
3.1 核因子-κB(nuclear factor kappa B,NF-κB)信号通路 NF-κB参与调节肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin-2,IL-2)、IL-6、单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)、IL-8、E选择素、趋化因子、黏附分子的表达,而消退素可以抑制NF-κB信号通路,发挥抗炎作用,目前干扰NF-κB信号通路已被假定为炎症性疾病的可行性治疗策略。消退素可以作用于NF-κB信号途径中不同的位点来抑制信号的转导。RVD2通过减少小胶质细胞中Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB 途径p65的核易位而下调TLR4/NF-κB p65 mRNA表达,阻断了NF-κB信号通路的传导[4]。RVD1与ALX/FPR2受体结合后可减少NF-κB 蛋白的表达水平,增加NF-κ B抑制蛋白的表达,并可被ALX/FPR2受体的拮抗剂及ALX/FPR2 siRNA作用后所消除[5]。AT-RVD3减少了NF-κB(S536)的磷酸化和促炎因子IL-6(pNF-κB的促炎性靶标)的表达[6]。
3.2 磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)信号通路 PI3K被生长因子、细胞因子、激素等细胞外信号刺激激活后可以调控细胞的增殖、分化、黏附、迁移及凋亡。RVE1可通过PI3K/AKt通路增强巨噬细胞的吞噬功能。在转染ChemR23受体的卵巢细胞内,发现RVE1可以增强AKt磷酸化,且通过使用AKt磷酸化抗体,发现RVE1影响AKt磷酸化以及核糖体蛋白S6磷酸化[7]。在心肌梗死及干燥综合征的动物模型中,RVD1减少心肌梗死面积及减少TNF-α介导对唾液上皮形成的破坏,但是此作用可以被LY-294002所废除。LY-294002是PI3K选择性抑制剂,竞争性结合酶的ATP结合位点[8]。
3.3 丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路 MAPK是一组能够被不同细胞外刺激激活的丝苏氨酸蛋白激酶。目前研究发现了JNK/SAPK通路、ERK信号通路、p38MAPK通路等多条并行的MAPK信号通路,由于受到的细胞外刺激不同,激活的MAPK信号通路不同。在IL-1β诱导的骨关节炎模型中,RVD1可以通过阻断IL-1b诱导的p38MAPK、JNK磷酸化降低促炎介质的生成[9]。在受到TNF-α刺激后,活化蛋白1和p38MAPK的磷酸化增加,它们的活化形式参与气道炎症因子的基因的转录,引发支气管炎症,但是在经RVD2干预后,能够减少AP-1和p38MAPK的活化。RVE1与受体ChemR23结合后抑制伤害性热刺激感受器调节背根神经节中ERK的活性,产生镇痛效果。RVE1可以直接阻止血小板衍生生长因子刺激的ERK和AKT通路的持续活化,阻止细胞周期进展所需分子的上调和细胞周期进展分子抑制剂的下调。
3.4 其他信号途径 细胞凋亡的标记物,包括天冬氨酸特异性的半胱氨酸蛋白酶3/9(caspases-3/9)、B细胞淋巴瘤/白血病2(B-cell lymphoma-2,Bcl-2)、乳酸脱氢酶(lactic dehydrogenase,LDH)、AKT。RVD1、RVE1能够降低caspases-3/9的活性和减少LDH的释放;此外,RVD1还可以增加抗凋亡因子Bcl2的表达,抑制细胞凋亡信号[9]。RVD2通过与其受体GPR18结合后可以增加Rac与GTP结合,激活Rac/eNOS通路[10]。PPAR-γ抑制剂GW9662可以部分逆转RVD1对NF-κB通路p65的核易位,提示RVD1可以通过PPAR-γ途径发挥抗炎作用。并且RVD1还促进了PPARγ介导的巨噬细胞转移到M2表型[11]。
4 消退素在疾病中的作用
4.1 消退素的抗炎作用 消退素是一种具有强大抗炎效果的脂质介质,其在临床的应用前景备受人们的重视和期待。目前在多数炎症性疾病的动物模型中,消退素均可以通过不同的机制发挥其对机体的保护作用。在葡聚糖硫酸钠和三硝基苯磺酸诱导的结肠炎中,RVE1、AT-RVD1和RVD2可以通过下调IL-12、TNF-α、IL-1β、趋化因子配体2、角质形成细胞趋化因子和诱导型一氧化氮合成酶减轻炎症[12-13]。AT-RVD1和RVD2还可以通过抑制黏附分子如血管细胞黏附分子1、细胞间黏附分子1、淋巴细胞功能相关抗原1的表达阻断中性粒细胞浸润,抑制结肠炎的发展。RVD1和AT-RVD1在肺部炎症中可以通过改善上皮细胞和内皮细胞的完整性降低中性粒细胞的浸润,减轻炎症[14-15]。RVD1显著下调了促炎症因子IL-8和MCP-1在人主动脉内皮细胞中的表达,减弱动脉粥样硬化的发生发展。Jung等[16]证实,RVD1预处理后,可以通过JNK介导的通路减弱HepG2细胞内质网应激状态下的细胞凋亡、脂质累积,减少胱冬酶3活性,保护HepG2细胞,减缓非酒精性脂肪肝的发展。在心脏缺血再灌注前给予RVE1可以改善再灌注的损伤和限制心肌梗死的面积,降低缺氧或者缺氧/复氧诱导的心脏胚胎成肌细胞H9c2心肌细胞的凋亡[17]。在体外,RVD1治疗显着降低了血管平滑肌中TNF-α诱导的超氧化物产生。在体内,RVD2处理的兔动脉中损伤诱导的ROS产生也显着减少[18]。此外,RVD1还可以抑制由脂多糖诱导的血管内皮细胞紧密连接蛋白破坏,降低血管内皮细胞渗透性[19]。
4.2 消退素的抗纤维化作用 多种器官功能受损发展到一定阶段均会出现纤维化。RVD1可以减少肺胶原含量和IL-1b、转化生长因子β1、结缔组织生长因子和Ⅰ型胶原mRNA表达,显著减少肺纤维化。且RVD1抑制炎症细胞浸润可以被ALX/FPR2受体的拮抗剂废除。在纤维化晚期阶段应用17(R)-RVD1也可改善肺衰竭[20]。Yang等[21]还发现,呼吸道分泌物中检测出RVE1的肺囊性纤维化患者比不能检测出RVE1的患者肺功能好。D类消退素可发挥抑制肾组织中白细胞的聚集、浸润,降低白细胞活性,阻断Toll样受体介导的巨噬细胞激活,抑制肾间质纤维化。在缺血再灌注损伤前或开始时,给予外源性D类消退素可以显著减弱急性肾损伤减少纤维化。在单侧输尿管梗阻引发的肾脏纤维化小鼠模型中,RVE1与RVD1可通过抑制肾脏肌成纤维细胞的增生及平滑肌肌动蛋白和Ⅳ型胶原的沉积起到直接的抗纤维化作用[22]。
4.3 消退素的镇痛作用 预先在足底注射低剂量的RVE1(20 ng),能抑制角叉菜胶诱导的小鼠足底炎症,减少中性粒细胞浸润以及促炎因子和趋化因子如IL-1、IL-6、TNF-α和MCP-1在肿胀组织中的表达,减轻疼痛。RVD1通过选择性抑制脊髓背角和背根神经节伤害性热刺激感受器V3和机械刺激感受器TRPAl、TRPV4的活性,发挥镇痛作用[23]。Huang等[24]发现RVD1可抑制ERK 磷酸化,降低兴奋性突触后N-甲基-D天冬氨酸电流,从而抑制突触的可塑性,对术后产生明显的镇痛作用。
4.4 消退素在代谢性疾病中的作用 在瘦素受体缺陷(db/db)的肥胖小鼠模型中,RVD1可通过改善脂肪组织中的葡萄糖耐量、胰岛素敏感性,增加脂联素的生成,降低IL-6促炎因子的水平,加速糖尿病小鼠切口的愈合。在这个过程中,RVD1减少CD11和增加巨噬细胞半乳糖型C型凝集素1,促进M1向M2型的转化以及增强巨噬细胞的吞噬功能[25]。RVE1可以增加脂联素、GLUT-4、IRS-1和PPAR-γ在脂肪组织中的表达,减轻肥胖诱导的胰岛素抵抗[26]。RVE1可以增加中性粒细胞的数目和对牙龈卟啉单胞菌的吞噬功能[27]。
综上所述,消退素是一类具有强大抗炎作用的脂质介质,其作用于受体后可通过对NF-κB、PI3K、MAPK、细胞凋亡、Rac、PPAR-γ等信号通路的影响,参与抗炎和促炎症消退,在炎症、纤维化、疼痛、代谢等疾病中均展示出了良好的效果,为疾病的治疗及预防提供了新的思路。
[参考文献]
[1] Serhan CN,Chiang N,Dalli J. The resolution code of acute inflammation:Novel pro-resolving lipid mediators in resolution[J]. Semin Immunol,2015,27(3):200-215.
[2] Chiang N,Dalli J,Colas RA,et al. Identification of resolvin D2 receptor mediating resolution of infections and organ protection[J]. J Exp Med,2015,212(8):1203-1217.
[3] Oh SF,Dona M,Fredman G,et al.Resolvin E2 formation and impact in inflammation resolution[J]. J Immunol,2012,188(9):4527-4534.
[4] Tian Y,Zhang Y,Zhang R,et al. Resolvin D2 recovers neural injury by suppressing inflammatory mediators expression in lipopolysaccharide-induced Parkinson's disease rat model[J]. Biochem Biophys Res Commun,2015,460(3):799-805.
[5] Kang JW,Lee SM. Resolvin D1 protects the liver from ischemia/reperfusion injury by enhancing M2 macrophage polarization and efferocytosis[J]. Biochim Biophys Acta,2016,1861(9 Pt A):1025-1035.
[6] Colby JK,Abdulnour RE,Sham HP,et al. Resolvin D3 and aspirin- triggered resolvin D3 are protective for injured epithelia[J]. Am J Pathol,2016,186(7):1801-1813.
[7] Ohira T,Arita M,Omori K,et al. Resolvin E1 receptor activation signals phosphorylation and phagocytosis[J]. J Biol Chem,2010,285(5):3451-3461.
[8] Gilbert K,Bernier J,Bourque-Riel V,et al. Resolvin D1 reduces infarct size through a phosphoinositide 3-kinase/protein kinase B mechanism[J]. J Cardiovasc Pharmacol,2015,66(1):72-79.
[9] Benabdoune H,Rondon EP,Shi Q,et al. The role of resolvin D1 in the regulation of inflammatory and catabolic mediators in osteoarthritis[J]. Inflamm Res,2016,65(8):635-645.
[10] Zhang MJ,Sansbury BE,Hellmann J,et al. Resolvin D2 enhances postischemic revascularization while resolving inflammation[J]. Circulation,2016,134(9):666-680.
[11] Taylor BK. Resolvin D1:a new path to unleash the analgesic potential of peroxisome proliferator-activated receptor-γ for postoperative pain in patients with diabetes[J]. Anesthesioloqy,2015,123(6):1231-1232.
[12] Arita M,Yoshida M,Hong S,et al. Resolvin E1,an endogenous lipid mediator derived from omega-3 eicosapentaenoic acid,protects against 2,4,6- trinitrobenzene sulfonic acid-induced colitis[J]. Proc Natl Acad Sci U S A,2005,102(21):7671-7676.
[13] Bento AF,Claudino RF,Dutra RC,et al. Omega-3 fatty acid-derived mediators 17(R)-hydroxy docosahexaenoic acid,aspirin-triggered resolvin D1 and resolvin D2 prevent experimental colitis in mice[J]. J Immunol,2011,187(4):1957-1969.
[14] Eickmeier O,Seki H,Haworth O,et al. Aspirin-triggered resolvin D1 reduces mucosal inflammation and promotes resolution in a murine model of acute lung injury[J]. Mucosal Immunol,2013,6(2):256-266.
[15] Xie W,Wang H,Wang L,et al. Resolvin D1 reduces deterioration of tight junction proteins by upregulating HO-1 in LPS-induced mice[J]. Lab Invest,2013,93(9):991-1000.
[16] Jung TW,Hwang HJ,Hong HC,et al. Resolvin D1 reduces ER stress-induced apoptosis and triglyceride accumulation through JNK pathway in HepG2 cells[J]. Mol Cell Endocrinol,2014,391(1/2):30-40.
[17] Keyes KT,Ye Y,Lin Y,et al. Resolvin E1 protects the rat heart against reperfusion injury[J]. Am J Physiol Heart Circ Physiol,2010,299(1):H153-164.
[18] Miyahara T,Runge S,Chatterjee A,et al. D-series resolvin attenuates vascular smooth muscle cell activation and neointimal hyperplasia following vascular injury[J]. FASEB J,2013,27(6):2220-2232.
[19] Zhang X,Wang T,Gui P,et al. Resolvin D1 reverts lipopolysaccharide-induced TJ proteins disruption and the increase of cellularpermeability by regulating IκBα signaling in human vascular endothelial cells[J]. Oxid Med Cell Longev,2013,2013:185715.
[20] Yatomi M,Hisada T,Ishizuka T,et al.17(R)-resolvin D1 ameliorates bleomycin-induced pulmonary fibrosis in mice[J].Physiol Rep,2015,3(12):e12628.
[21] Yang J,Eiserich JP,Cross CE,et al . Metabolomic profiling of regulatory lipid mediators in sputum from adult cystic fibrosis patients[J]. Free Radic Biol Med,2012,53(1):160-171.
[22] Qu X,Zhang X,Yao J,et al. Resolvins E1 and D1 inhibit interstitial fibrosis in the obstructed kidney via inhibition of local fibroblast proliferation[J]. J Pathol,2012,228(4):506-519.
[23] Lima-Garcia JF,Dutra RC,da Silva K,et al. The precursor of resolvin D series and aspirin-triggered resolvin D1 display anti-hyperalgesic properties in adjuvant-induced arthritis in rats[J]. Br J Pharmacol,2011,164(2):278-293.
[24] Huang L,Wang CF,Serhan CN,et al. Enduring prevention and transient reduction of postoperative pain by intrathecal resolvin D1[J]. Pain,2011,152(3):557-565.
[25] Tang Y,Zhang MJ,Hellmann J,et al. Proresolution therapy for the treatment of delayed healing of diabetic wounds[J]. Diabetes,2013,62(2):618-627.
[26] Gonz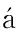 lez-Périz A,Horrillo R,Ferré N,et al.Obesity-induced insulin resistance and hepatic steatosis are alleviated by omega-3 fatty acids:a role for resolvins and protectins[J]. FASEB J,2009,23(6):1946-1957.
lez-Périz A,Horrillo R,Ferré N,et al.Obesity-induced insulin resistance and hepatic steatosis are alleviated by omega-3 fatty acids:a role for resolvins and protectins[J]. FASEB J,2009,23(6):1946-1957.
[27] Cl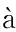 ria J,Dalli J,Yacoubian S,et al. Resolvin D1 and resolvin D2 govern local inflammatory tone in obese fat[J]. J Immunol,2012,189(5):2597-2605.
ria J,Dalli J,Yacoubian S,et al. Resolvin D1 and resolvin D2 govern local inflammatory tone in obese fat[J]. J Immunol,2012,189(5):2597-2605.