肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是发生于呼吸道和肺部的急性炎症,通常由肺炎支原体(mycoplasma pneumoniae,MP)引发,常同时有咽炎、支气管炎和肺炎[1]。MPP与儿童的多种疾病密切相关,如儿童慢性咳嗽、支气管哮喘、闭塞性支气管炎等,对患儿的健康造成了严重威胁[2-4]。临床上用于治疗MPP的药物通常为喹诺酮类药物,但由于其给患儿造成的诸多不良作用,限制了其在临床中的应用。所以,研究机体对于MPP的发病机制,可为寻找治疗儿童MPP的新方法提供理论依据和基础[5]。与MPP相关的模式识别受体(pattern recognition receptors,PRR)主要有Toll样受体(toll-like receptor, TLR)。肿瘤坏死因子α诱导蛋白8家族样蛋白2(tumor necrosis factor-alpha-induced protein-8 like-2 protein,TIPE2)是肿瘤坏死因子α诱导蛋白8家族成员之一[6]。研究发现,TIPE2可负调控TLR,而TLR在MPP发病机制中起着重要作用。根据以上研究推测TIPE2参与MPP的调控[7]。但关于TIPE2对于信号通路调控的报道有限。本研究旨在探讨TIPE2对肺MP感染的负向调控及其作用机制,以期为临床治疗提供指导。报告如下。
1 资 料 与 方 法
1.1一般资料 选取2015年1月—2016年1月上海市徐汇区中心医院收治的MPP患儿142例,根据临床表现分为普通MPP组78例和难治性肺炎支原体肺炎(refractory mycoplasma pneumoniae pneumonia,RMPP)组64例。普通MPP组男性43例,女性35例,年龄5~11岁,平均(7.6±1.1)岁;RMPP组男性34例,女性30例,年龄6~11岁,平均(7.8±1.3)岁。另选取同期于徐汇区中心医院体检的健康儿童65例作为对照组,男性34例,女性31例,年龄6~12岁,平均(7.8±1.5)岁。在患儿入院第1天采集患儿外周血,并及时分离淋巴细胞,冻存。本研究前均与患儿法定监护人签署知情同意书。
纳入标准:①符合第7版《诸福棠实用儿科学》诊断标准[8];②血清特异性MP-IgM抗体阳性(急性期滴度≥1∶160)和鼻咽吸出物和(或)支气管肺泡灌洗液MP-DNA经PCR荧光探针法测定阳性;③使用抗生素治疗7 d后患儿临床症状以及影像学诊断未出现缓解。
排除标准:①病原学检测发现并发其他感染的患儿;②肺炎恢复期时入院;③既往有重症肺炎病史尚未痊愈;④合并复发性呼吸道感染、免疫系统疾病、慢性肺病的患儿;⑤合并严重肝肾疾病和心血管疾病的患儿。
1.2细胞系及其培养 人单核细胞(悬浮生长)在含胎牛血清(Gibco)、青霉素(100 000 U/L)、链霉素(100 000 U/L)的RPMI 1640培养液中培养(37 ℃,CO2);将人急性单核细胞白血病细胞系(human acute monocytic leukemia cell line,THP-1)细胞在含Gibco(20%)及PMA(Phorbol-12-myristate-13-acetate,100 nmol/L)的培养基中培养(37 ℃,CO2),24~48 h细胞贴壁为巨噬细胞。MP菌种(美国,ATCC公司,29342,M129-B7)在支原体肉汤培养基中培养(37 ℃,CO2)。
1.3相关试利 Trizol(Invitrogen公司), DNA聚合酶、连接酶(TOYOBO公司),限制性内切酶(TAKA RA公司),引物(海生工生物工程有限公司)。
1.4方法
1.4.1外周血淋巴细胞分离 首先在离心管中加入适量的淋巴细胞分离液;再将EDTA抗凝血沿试管壁缓慢流于分层液面上,离心3 min。小心吸取单个核细胞转移到另一个干净的离心管中,使用生理盐水洗涤2次。由THP-1成为的巨噬细胞在不同浓度(0、1、10、20、50、100 CFU/cell)的MP刺激后检测TIPE2的表达情况。
1.4.2总RNA的提取及cDNA的制备 按Trizol试剂说明书进行。
1.4.3实时荧光定量PCR 以“1.4.2”步骤的cDNA作为模板,以响应引物进行定量PCR扩增,其仪器为SYBR Premix Ex TaqTM(TAKARA)。
1.4.4Western-blot印迹检测 将上述培养的细胞小心收集,使用磷酸盐缓冲液洗涤后在1∶200的cocktail蛋白抑制剂中重悬,并在4 ℃条件下培养30 min。裂解后离心(4 ℃,12 000 r/min)10 min,收集上清液。采用BCA法对蛋白样品进行定量采样。其具体方法为:将蛋白样品溶解于缓冲液中,溶液包括三羟甲基氨基甲烷(100 mmol/L)、二硫苏糖醇(200 mmol/L)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS,4%)、溴酚蓝(0.2%)、甘油(20%),pH=6.8,水浴煮沸5 min,进行10% SDS-PAGE电泳(300 mA,70 min)。后在相同条件下将蛋白质转移于硝酸纤维素并进行染色。在封闭液(5%BSA溶液)室温孵育2 h,将膜与适当浓度的一抗溶液在室温条件下共孵育2 h。使用TBST清洗5次后,与HRP标记的二抗共同室温孵育1 h,后再次使用TBST清洗5次,最后加入化学发光底物,1 min后迅速显影。
1.4.5细胞因子检测 1×106THP-1在12孔细胞培养板上进行接种,在含Gibco(10%)和PMA(100 nmol/L)培养基中培养24~48 h(37 ℃,5%CO2),细胞贴壁成为巨噬细胞。使用MP对上述细胞进行感染后取上清液并采用相同方法处理,分别转染TIPE2和空白对照,后使用MPP,收集上清液,严格按照ELISA试剂盒(Ebioscience)的方法步骤对子IL-6、TNF-α和IL-1β 3种炎症因子的水平进行检测。
1.4.6细胞转染和干扰 1×106THP-1接种于12孔细胞培养板,在含Gibco(10%)和100 nmol/L PMA)培养基中培养24~48 h(37 ℃,5%CO2),细胞成为巨噬细胞。TIPE2 siRNA(20~80 nmol/L)和阳离子脂质体试剂(4 μL)溶于200 μL OMEM培养基中并充分混匀,室温下静置10 min后加入待转染的细胞培养基中转染48 h。将人单核细胞系THP-1经过PMA诱导,后以TIPE2 siRNA为研究样品,以NC为对照样品,分别转染48 h,后分别使用MP刺激0、15、30、60、90、120 min,检测ERK、JNK、P38的活化水平。
1.5统计学方法 应用SPSS 19.0统计学软件分析数据。计量资料比较分别采用t检验、F检验和q检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1TIPE2表达情况比较 普通MPP组和RMPP组外周血单核细胞中TIPE2 mRNA表达水平低于对照组,RMPP组低于普通MPP组,差异有统计学意义(P<0.05),见表1。
表1 各组TIPE2表达情况比较
Table1Comparison of the expression levels of TIPE2in different groups ![]()
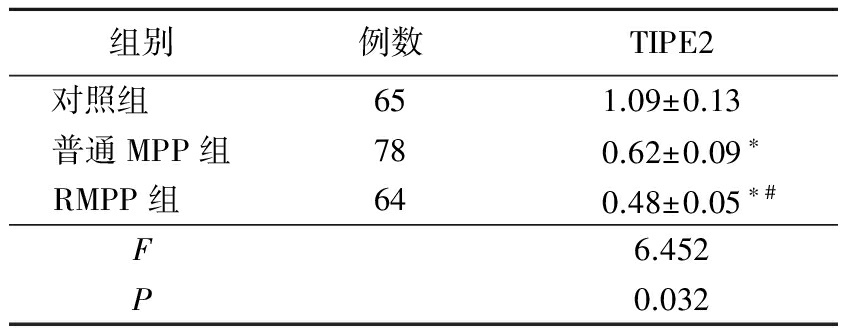
*P<0.05与对照组比较 #P<0.05与普通MPP组比较(q检验)
2.2MP刺激后巨噬细胞中TIPE2表达情况 随着MP浓度增加,THP-1细胞分化成的巨噬细胞TIPE2 mRNA及其蛋白灰度值逐渐降低,差异有统计学意义(P<0.05),见表2。
MP浓度与TIPE2 mRNA及其蛋白表达呈负相关(r=-0.852,P=0.031;r=-0.871,P=0.021)。
2.3MPP对巨噬细胞分泌炎性细胞因子的影响 感染MP后巨噬细胞分泌IL-6、TNF-α、IL-1β的量明显升高,MP浓度为50 CFU/cell浓度时,细胞因子IL-6、TNF-α、IL-1β分泌量最高,差异有统计学意义(P<0.05)。以MP在 50 CFU/cell浓度刺激巨噬细胞,随时间增加,IL-6、TNF-α、IL-1β水平明显升高,差异均有统计学意义(P<0.05)。见表3,4。
表2 不同MP浓度刺激后TIPE2表达水平比较
Table2Expression levels of TIPE2after stimulation with different concentrations of MP ![]()
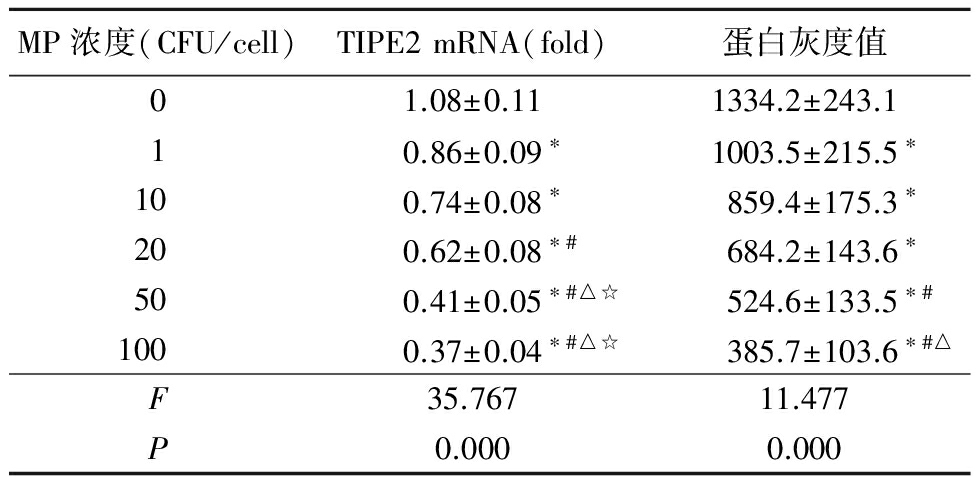
*P<0.05与0 CFU/cell比较 #P<0.05与1 CFU/cell比较 △P<0.05与10 CFU/cell比较 ☆P<0.05与20 CFU/cell比较(q检验)
表3 炎性细胞因子与MP浓度的关系
Table3Relationship between inflammatory cytokines and MP concentration ![]()
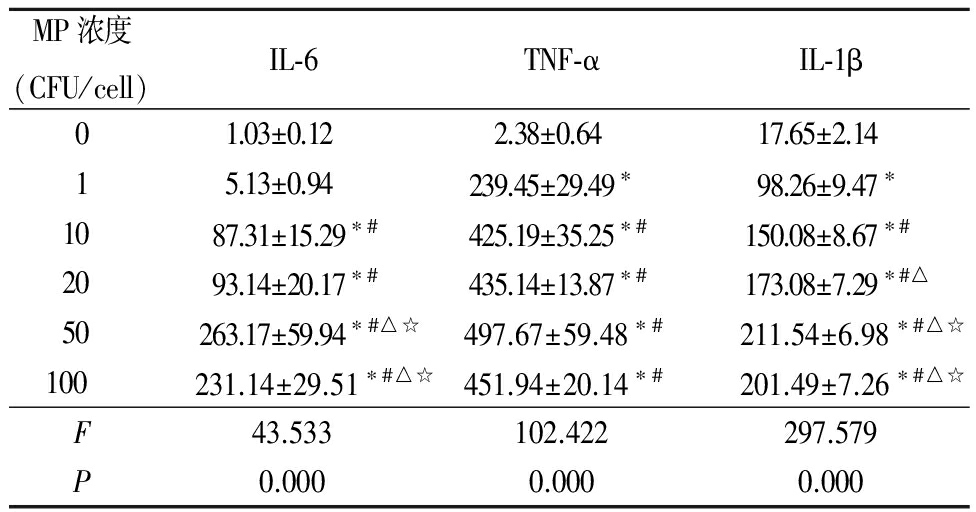
*P<0.05与0 CFU/cell 比较 #P<0.05与1 CFU/cell比较 △P<0.05与10 CFU/cell比较 ☆P<0.05与20 CFU/cell比较(q检验)
表4 炎性细胞因子与MP刺激时间的关系
Table4Relationship between inflammatory cytokines and MP stimulation time ![]()
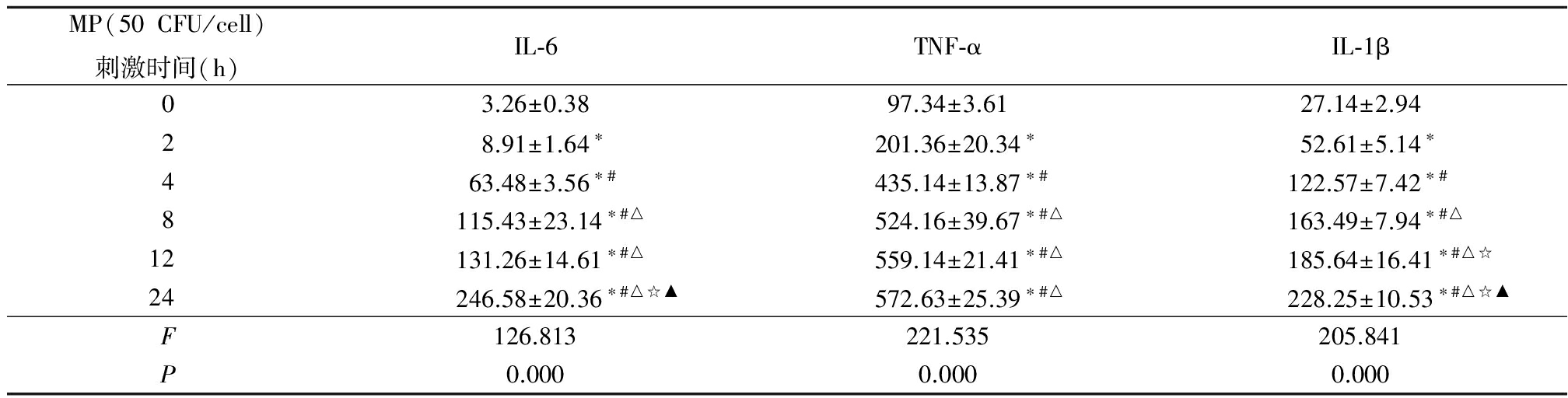
*P<0.05与0 h比较 #P<0.05与2 h比较 △P<0.05与4 h比较 ☆P<0.05与8 h比较 ▲P<0.05与12 h比较(q检验)
2.4TIPE2 RNA干扰对MP诱导的炎性细胞因子表达的影响 转染TIPE2 siRNA的THP-1细胞为SiRNA组,转染NC阴性对照的THP-1细胞为非SiRNA组。SiRNA组IL-6、TNF-α、IL-1β水平均明显高于非SiRNA组,差异有统计学意义(P<0.05),见表5。
表5 TIPE2 RNA干扰对MP诱导的炎性细胞因子表达的影响
Table5Effects of TIPE2RNA interference on the expression of inflammatory cytokines induced by MP ![]()
2.5TIPE2对丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的影响 在THP-1细胞转染阴性对照或TIPE2 siRNA 48 h后,随着MP刺激时间从0 min 增加至90 min时,转染TIPE2 siRNA的THP-1细胞,p-ERK1/2、p-JNK和p-P38表达量逐渐增大,随后在MP刺激120 min后表达量下降;而转染阴性对照的THP-1细胞,p-ERK1/2、p-JNK和p-P38表达量并不随着MP刺激时间增加而显著变化。见图1。
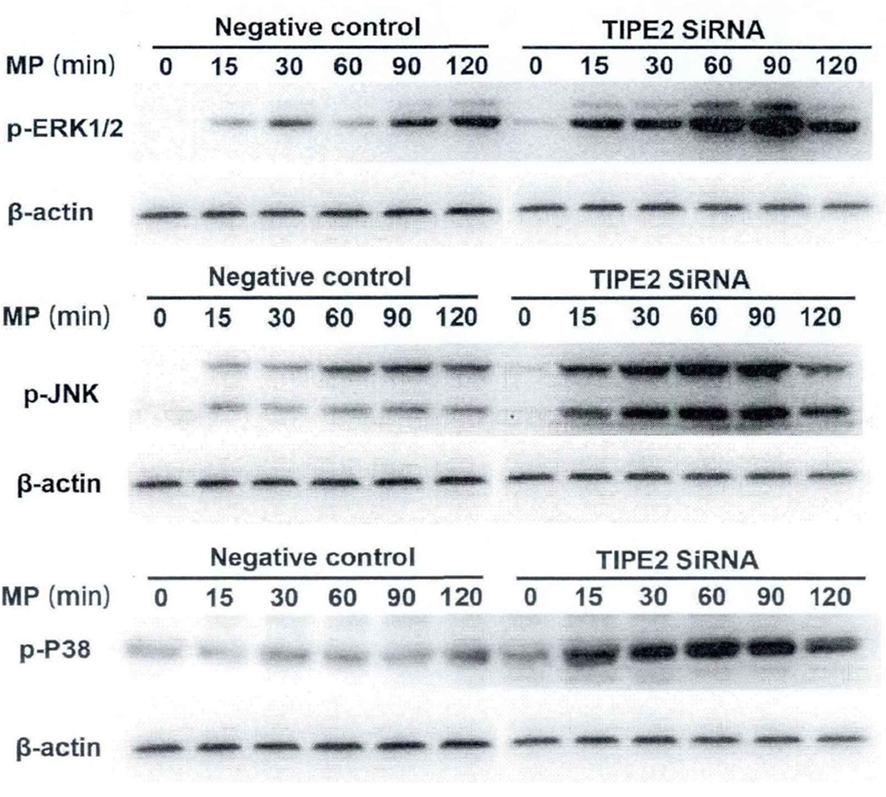
图1 TIPE2对MAPK信号通路的影响
Figure1The regulation of TIPE2on MAPK signaling pathway activation
3 讨 论
局部炎症反应调节失衡导致重症肺炎,机体的促炎反应相对活化而抑炎反应相对一致,从而导致肾脏功能受到损伤,在临床宏观上表现为重症肺炎。
人体的天然免疫系统是抵御病原微生物入侵的第一道防线。TLRs可识别许多保守的病原分子模式,因而在天然免疫中发挥着重要作用。巨噬细胞作为机体免疫的最重要细胞之一,在人体中广泛存在。巨噬细胞的强大吞噬功能可帮助机体免受病原微生物感染。当MP入侵人体时,MP表面的脂蛋白或脂肽可作用于巨噬细胞膜表面的TLR1、TLR2、TLR6受体,从而通过依赖性MyD88活化的MAPK和核因子κB (Neuclear factor kappa B,NF-κB)通路,上调IL-6、TNF-α、IL-1β等的表达水平[9-10]。
MP致病及难治性MPP的发生于TLR信号的过度活化有密切关系。TLR信号在适当时机停止对免疫通路的调节对于维持机体免疫自稳具有非常重要的做用。限制免疫激活的分子和负调节TLR信号通路的分子是维持机体免疫自稳的重要分子。主要包括抑制性细胞因子、肿瘤坏死因子α诱导蛋白(tumor necrosis factor alpha-induced protein,TNFAIP)以及基因编码的逆转录因子和Fas、Caspase-8和Caspase-3等[11]。其中,TIPE2属于TNFAIP8家族,并且其在多种自身免疫系统疾病如系统性红斑狼疮和哮喘中表达水平显著减低,这说明TIPE2可能与免疫性疾病的发病机制有关[12]。
最新研究表明,MP可黏附呼吸道上皮细胞从而激活免疫系统是其使患者发生炎症的主要方式[13],但关于MPP具体诱发机制和调控方法尚未发现。现阶段, PRR逐渐成为研究热点。研究发现启动机体固有免疫的的关键是PRR,与疾病的发生及治疗预后有着密切关系。在PRR中,与MP相关的受体主要为TLR。Toll与配体识别后,可通过跨膜结构将信号传递于细胞内,从而激活免疫系统。研究表明TLR信号通路的过渡活化是导致MPP难以治疗的重要原因之一[11]。TIPE2是肿瘤坏死因子 a 诱导蛋白 8家族成员之一,并且参与调节JNK、p38MAPK、NF-κB等信号通路[14]。
本研究结果显示,普通MPP组和RMPP组外周血单核细胞中TIPE2 mRNA表达水平明显低于对照组,RMPP组外周血单核细胞中TIPE2 mRNA表达水平明显低于普通MPP组。说明TIPE2的水平与MPP的严重程度有关。细胞实验表明THP-1在感染MP后TIPE2水平明显降低,且MP浓度与TIPE2mRNA及其蛋白表达呈负相关。
本研究通过人工合成靶向TIPE2的siRNA从而阻断THP-1内源性TIPE2的表达,在此基础上研究TIPE2对MP的调控作用,结果显示TIPE2对由MP引起的炎性细胞因子表达具有抑制的作用。
内源性TIPE2可活化MPP引起的MAPK通路,因而推测TIPE2可抑制MAPK信号通路,负向调节炎症因子的表达。但其具体调控机制有待进一步研究。
总之,感染MP后患儿TIPE2表达水平明显降低,并且与疾病严重程度呈负相关。体外实验验证MP感染可对TIPE2表达产生抑制作用,TIPE2可抑制MAPK通路,从而负调节炎症因子的水平。
[参考文献]
[1] 陈丽兰.常量甲泼尼龙治疗无效的儿童难治性肺炎支原体肺炎的临床特征和治疗方案探讨[J].河北医学,2016,22(1):147-150.
[2] 曾庆娣,林爱翠.肺炎支原体抗体C-反应蛋白及血清降钙素原检测在儿童呼吸道医院感染诊断中的应用评价[J].河北医学,2016,22(4):563-566.
[3] 张兆兰,李爱芳,任秀丽.支原体肺炎患儿血清白细胞介素6及C反应蛋白变化分析[J].河北医科大学学报,2013,34(7):774-776.
[4] 林蕤,顾卫,黄慧.丹参酮辅助阿奇霉素治疗对支原体肺炎患儿心肌酶及氧自由基的影响[J].中药材,2016,39(5):1179-1180.
[5] Lu A,Wang C,Zhang X,et al. Lactate dehydrogenase as a biomarker for prediction of refractory mycoplasma pneumoniae pneumonia in children[J]. Respir Care,2015,60(10):1469-1475.
[6] 游洁冰,孙忠文,杜鹃,等.罗格列酮、胰岛素对Ⅱ型糖尿病大鼠脑内TIPE2的表达和细胞凋亡的影响[J].山东大学学报:医学版,2015,53(4):43-48,60.
[7] Tarang S,Kumar S,Batra SK. Mucins and Toll-like receptors: kith and kin in infection and cancer[J]. Cancer Lett,2012,321(2):110-119.
[8] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:北京人民卫生出版社.2011:1204-1205.
[9] O′Callaghan P,Li JP,Lannfelt L,et al. Microglial Heparan Sulfate Proteoglycans Facilitate the Cluster-of-Differentiation 14(CD14)/Toll-like Receptor 4(TLR4)-dependent inflammatory response[J]. J Biol Chem,2015,290(24):14904-14914.
[10] Skevaki C,Pararas M,Kostelidou K,et al. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infectious diseases[J]. Clin Exp Immunol,2015,180(2):165-177.
[11] Cuda CM,Misharin AV,Gierut AK,et al. Caspase-8 acts as a molecular rheostat to limit RIPK1- and MyD88-mediated dendritic cell activation[J]. J Immunol,2014,192(12):5548-5560.
[12] Huang L,Chen J,Hong B. Down-regulation of TIPE2 promotes the proliferation and immune activity of T lymphocytes[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2016,32(7):886-890.
[13] 王绪栋,林荣军,王学山,等.肺炎支原体感染引起的小儿肺炎支原体肺炎与细胞因子的相关性分析[J].国际呼吸杂志,2015,35(10):746-748.
[14] 李志,焦治兴,齐忠权.免疫负调控分子TIPE2的研究进展[J].现代肿瘤医学,2015,23(13):1924-1928.