阿尔茨海默病(Alzheimer disease,AD)以进行性学习记忆和认知功能障碍为主要表现,是一种致命性中枢神经系统退行性病变,是继心脑血管疾病以及癌症之后老年人健康的第三大隐患[1]。AD的病因及发病机制尚不明确,但Aβ作为始动因子的观点被广泛认可[2]。Aβ在AD的发生发展过程中发挥极其重要的作用,引发炎症反应是Aβ引起神经损伤的重要机制之一,减轻Aβ的神经损伤作用是治疗AD的有效策略之一[3]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)存在于脐带中的华尔通胶中,其来源丰富、取材方便、免疫原性低、分化潜能大[4]。已有研究显示,hUCMSCs可改善学习记忆能力,发挥神经保护作用[5-6],但其作用机制尚不完全明确。本研究采用脑区立体定位注射法给AD模型鼠侧脑室注射hUCMSCs,通过Morris水迷宫观察hUCMSCs对Aβ损伤大鼠学习记忆能力的影响,旨在进一步探讨炎症因子及胶质细胞活化在hUCMSCs对抗Aβ神经损伤中的作用。
1 材 料 与 方 法
1.1材料
1.1.1实验动物及脐带样本 清洁级、雄性SD大鼠(体质量210~230 g,年龄6~7周)50只,由河北省实验动物中心提供(许可证号:SCXK(冀)2013-1-003;合格证号:1611276)。实验动物饲养于清洁级的环境中,室温保持23~25 ℃,自由进食进水,适应环境7 d后开始实验。人脐带样本(长度约20 cm)来自河北省石家庄市第三医院产科足月健康胎儿,产妇及家属知情同意;实验过程对动物的处置符合动物伦理学要求。
1.1.2实验试剂及实验仪器 Aβ25-35(Sigma,Lot.A4559),DMED/F12培养基(Hyclone,Lot.SH30023.01B),TNF-α及IL-1β酶联免疫吸附测定试剂盒(Excell Biology),兔抗GFAP多克隆抗体(Abcam,ab7260),兔抗Iba-1多克隆抗体(Abcam,ab153696),小鼠抗β-actin单克隆抗体(Abcam,ab8226);牙科手钻(Strong Power Unit SSH-90),酶标仪(TECAN),脑立体定位仪(江湾Ⅰ型通用立体定位仪),Morris水迷宫及图像分析系统(上海吉量软件科技公司),低温离心机(Thermo Fisher),电泳仪、半干式转膜仪(Bio-rad),Alpha Image成像分析系统(Alpha Inotech)。
1.2方法
1.2.1模型制备及实验分组 将1 mg Aβ25-35溶于0.5 mL蒸馏水,得Aβ25-35溶液(2 g/L),混匀、分装、-20 ℃冻存。用前将Aβ25-35溶液置于37 ℃孵育1周,使其老化、聚合。
实验动物经2%戊巴比妥钠(40~60 mg/kg)腹腔注射进行麻醉,之后固定于脑立体定位仪上,颅顶剪毛后常规消毒,沿其颅骨中线切开皮肤,钝性分离皮下组织,暴露前囟。参照大鼠脑区立体定位图谱海马CA1区位置,于前囟向后3.5 mm,中线左右2.0 mm处用牙科手钻开直径1 mm的骨窗,微量注射器垂直颅骨表面进针2.7 mm,即为海马CA1区位置,10 min内缓慢注入Aβ25-35溶液(5 μL),留针10 min使其充分扩散,缓慢撤针并缝合切口。手术过程中维持动物体温37 ℃左右,动物清醒前单独放置。
实验共分5组(每组10只):对照组、假手术组、溶剂对照组、Aβ损伤组及hUCMSCs保护组。对照组大鼠不进行任何处理,假手术组大鼠行海马定位注射的假手术(不注射任何液体),溶剂对照组大鼠双侧海马分别注射5 μL灭菌水,Aβ损伤组大鼠双侧海马分别注射5 μL(2 g/L)Aβ溶液,hUCMSCs保护组于Aβ损伤后1 d双侧侧脑室(坐标定位:AP 1.0 mm;DV 4.5 mm,±1.5 mm)分别注射10 μL悬浮于PBS的hUCMSCs(2×105个/侧)。于术后7~12 d通过Morris水迷宫行为学测试观察各组大鼠的空间学习记忆能力。行为学测试结束后,各组动物断头取脑,冰浴分离其双侧海马组织,-20 ℃冻存以供酶联免疫吸附测定及Western blot分析。
1.2.2hUCMSCs的分离与培养 采用组织块培养法进行hUCSMCs培养;超净台内洗去残血后将脐带剪为小段并沿纵轴剖开,剔除脐动脉和脐静脉,分离华尔通胶并将其剪为小组织块,均匀贴于细胞培养瓶。细胞于DMEM/F12培养基、37 ℃、5% CO2的培养箱中培养;长至约80%汇合后传代,取处于对数生长期的3~4代细胞进行实验。细胞经0.25%胰酶/EDTA消化后,用PBS漂洗并重悬,调整密度为2×107个/mL用于侧脑室注射。
1.2.3行为学测试 hUCMSCs移植后1周开始Morris水迷宫行为学测试。行为学测试共计6 d,其中前5 d进行定位航行实验,4次/d。将实验动物按固定的顺序面壁放入水中,记录大鼠从入水至找到隐匿平台所需的时间,即为逃避潜伏期;待大鼠找到隐匿平台之后,使其停留于平台上10 s;若大鼠在60 s内未能找到隐匿平台,则引导其至平台上,停留10 s,并记录逃避潜伏期为60 s。第6天为空间探索实验,撤去平台并记录动物90 s内穿越平台区的次数以及在平台所在象限(第四象限)停留的时间百分比。
1.2.4酶联免疫吸附测定 参照酶联免疫吸附测定试剂盒中说明书的步骤操作,测定大鼠海马组织炎症因子TNF-α及IL-1β含量。每个处理组以3孔并行进行实验。于450 nm波长依序测量各孔的光密度(optical density,OD)值,根据标准品的浓度与OD值得到标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.2.5海马组织总蛋白提取与Western blot分析 向海马组织中加入RIPA裂解液制备组织匀浆,4 ℃离心取上清(蛋白提取液),分装后-20 ℃保存。蛋白定量后,取等量蛋白上样。稳压电泳,20 V恒压半干转膜;之后将PVDF膜置于含5%脱脂奶粉的TTBS中,37 ℃封闭2 h后依次进行一抗(GFAP 1∶10 000;Iba-1 1∶2 000;β-actin 1∶5 000)、二抗(1∶5 000)结合反应。洗膜后,用化学发光试剂盒检测PVDF膜上抗原抗体结合区带。通过凝胶图像分析系统对Western blot免疫反应阳性条带进行积分光密度(integrated optical density,IOD)测定,以目的蛋白IOD值与内参β-actin IOD值的比值表示目的蛋白相对表达量,以假手术组相对表达量为100%。
1.3统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较分别采用重复测量的方差分析、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1hUCMSCs对Aβ损伤大鼠空间学习记忆能力的影响 各实验组大鼠的逃避潜伏期均随时间的延长而降低,Aβ损伤组及hUCMSCs保护组在组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05),见表1。
空间探索实验结果显示,对照组、假手术组以及溶剂对照组大鼠的平台区穿越次数及平台所在象限(第四象限)停留时间百分比差异无统计学意义(P>0.05)。Aβ损伤组大鼠穿越平台区的次数及在平台所在象限(第四象限)停留时间百分比均显著减少,分别为假手术组的40.5%(P<0.05)及44.7%(P<0.05)。hUCMSCs可逆转Aβ损伤大鼠平台区穿越次数及平台所在象限(第四象限)停留时间百分比减少的现象,其平台区穿越次数为Aβ损伤组的226.7%(P<0.05),平台象限(第四象限)停留时间百分比为Aβ损伤组的162.0%(P<0.05)。见表2。
表1 hUCMSCs对大鼠水迷宫实验逃避潜伏期的影响
Table1Effect of hUCMSCs on rat′s mean escape latency in navigation trials of Morris water maze behavioral task ![]()
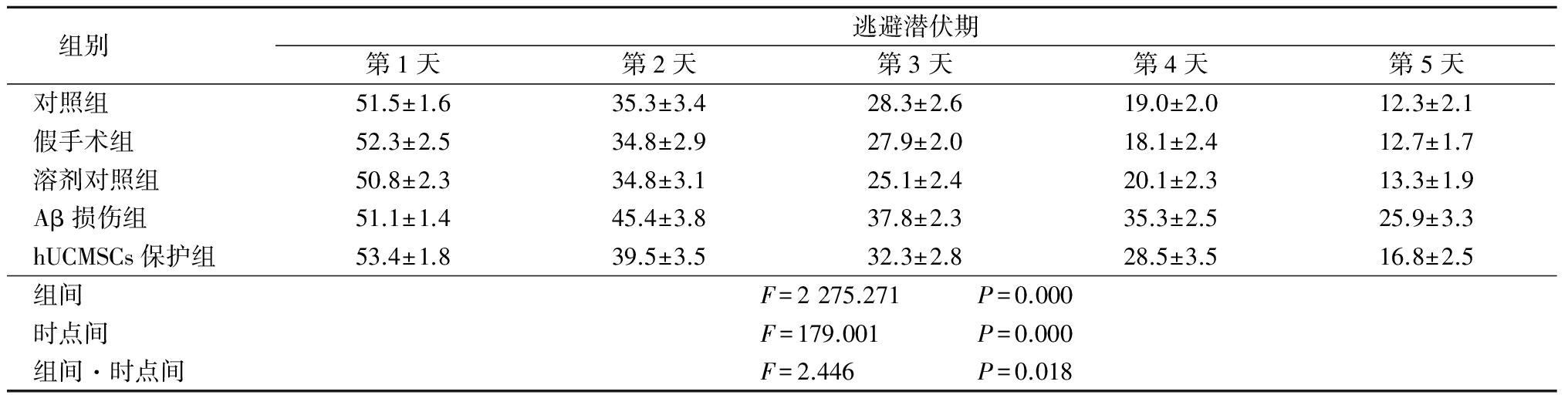
表2 hUCMSCs对大鼠平台区穿越次数及第四象限停留时间百分比的影响
Table2Effect of hUCMSCs on rat`s numbers of platform crossings andⅣtime ratio in probe trial of Morris water maze behavioral task ![]()
*P<0.05与Aβ损伤组比较 #P<0.05与假手术比较(q检验)
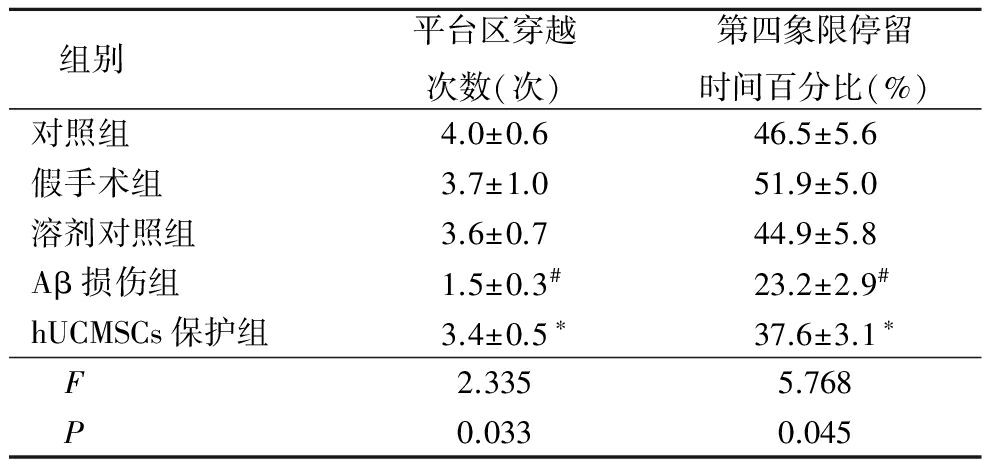
2.2hUCMSCs对Aβ损伤大鼠海马组织内炎症因子TNF-α 及 IL-1β表达水平的影响 酶联免疫吸附测定结果显示,对照组、假手术组及溶剂对照组大鼠海马组织内炎症因子TNF-α及IL-1β蛋白表达量较低,Aβ损伤大鼠海马织内二者表达均显著增加(P<0.05),分别为假手术组表达量的261.7%及341.0%;hUCMSCs保护组大鼠海马织内二者蛋白表达较Aβ损伤组显著降低,分别为Aβ损伤组的75.1%及78.6%(P<0.05)。见表3。
表3 hUCMSCs对大鼠海马组织TNF-α和IL-1β蛋白质表达的影响
Table3Effect of hUCMSCs on TNF-α and IL-1β expression in hippocampus of rats ![]()
*P<0.05与Aβ损伤组比较 #P<0.05与假手术组比较(q检验)
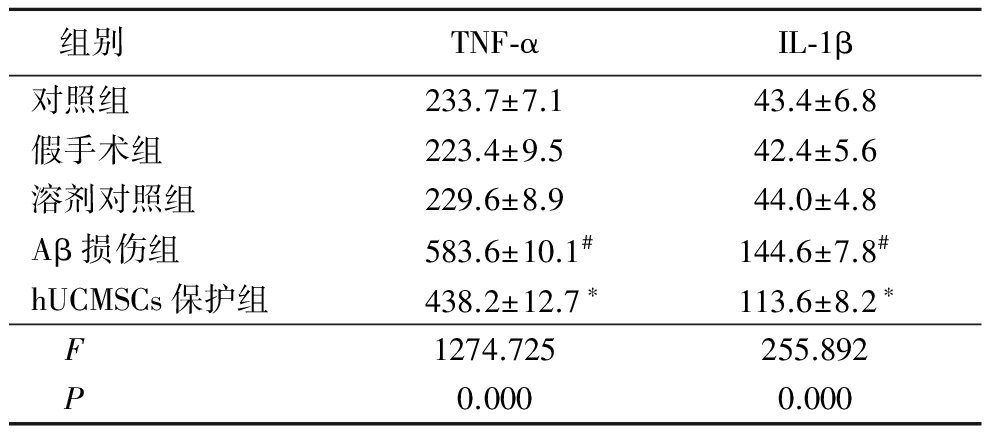
2.3hUCMSCs对Aβ损伤大鼠海马组织胶质细胞标志物表达的影响 Western blot结果显示,对照组、假手术组及溶剂对照组大鼠海马组织中即有基础量的星形胶质细胞标志物GFAP及小胶质细胞标志物Iba-1表达,Aβ损伤大鼠海马组织中二者表达显著增加,分别为假手术组的149.6%及199.8%(P<0.05);hUCMSCs保护组大鼠海马组织内GFAP表达较Aβ损伤组显著降低,为Aβ损伤组的91.2%(P<0.05),Iba-1表达与Aβ损伤组差异无统计学意义。见表4,图1。
表4 hUCMSCs对大鼠海马组织GFAP及Iba-1表达的影响
Table4Effect of hUCMSCs on GFAP and Iba-1expression in hippocampus of rats ![]()
*P<0.05与Aβ损伤组比较 #P<0.05与假手术组比较(q检验)
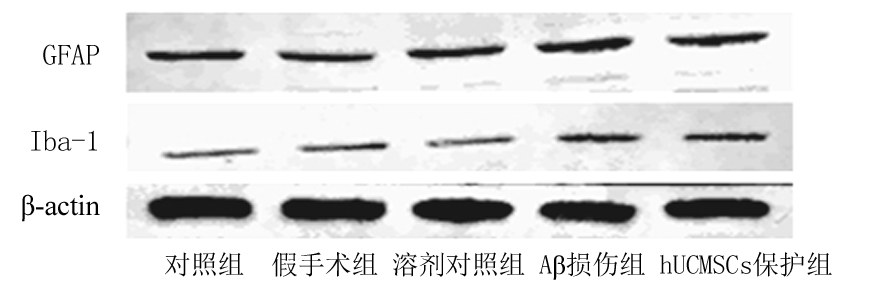
图1 Western blot检测GFAP及Iba-1表达
Figure1The relative amounts of GFAP and Iba-1protein levels were detected by Western blot analysis
3 讨 论
AD严重影响患者及家属的生活,对其进行有效的防治不仅为医学界所重视,同时也备受全社会关注[7]。Aβ的神经损伤作用是引起AD典型症状的核心机制,诱导神经炎症反应是Aβ产生神经损伤作用的重要途径[8-9]。通过侧脑室注射hUCMSCs,AD模型鼠的空间学习记忆能力得以有效改善[6]。本研究采用酶联免疫吸附测定法分析海马组织中炎症因子TNF-α及IL-1β表达情况,结果显示hUCMSCs保护组大鼠海马织内二者蛋白表达较Aβ损伤组显著降低;采用Western blot检测海马脑区星形胶质细胞标志物GFAP及小胶质细胞标志物Iba-1表达,结果显示hUCMSCs保护组大鼠海马组织内GFAP表达较Aβ损伤组显著降低,Iba-1表达与Aβ损伤组差异无统计学意义。故考虑hUCMSCs的保护作用与星形胶质细胞关系更为密切。抑制Aβ诱导的星形胶质细胞活化、进而减少星形胶质细胞活化引起的炎症因子释放可能是hUCMSCs改善Aβ损伤大鼠空间学习记忆能力的机制之一。
AD的发生与炎症反应密切相关,神经炎症可诱发或加重AD的发生发展,抑制神经炎症反应可有效改善AD样症状[10-11]。机体炎症反应旨在发挥保护作用,但Aβ过度激活胶质细胞后释放的大量炎症因子则会产生细胞损伤作用。中枢神经系统存在多种神经胶质细胞,其中最重要的两类为星形胶质细胞及小胶质细胞。星形胶质细胞体积最大、数量最多、分布最广,对神经元的营养代谢具有重要意义;小胶质细胞是中枢神经系统中主要的免疫效应细胞,对微环境变化最为敏感,接受刺激后迅速激活;二者的活化与AD等神经退行性疾病的发生发展关系密切。星形胶质细胞标志物GFAP及小胶质细胞标志物Iba-1在二者活化时表达均显著上调,故本研究通过检测GFAP及Iba-1表达水平推断星形胶质细胞标志物及小胶质细胞活化状态。体外实验从细胞及分子水平证实,抑制Aβ对星形胶质细胞细胞的活化可减弱其神经损伤作用[12-13]。本研究则通过在体实验从整体水平证实,hUCMSCs可减弱Aβ对星形胶质细胞的激活,进而改善Aβ损伤大鼠空间学习记忆能力。有研究显示,抑制小胶质细胞过度活化对中枢神经系统具有保护作用[14-15];Lee等[16]研究则显示,海马注射人脐带血来源的间充质干细胞后,APP/PS1小鼠皮层及海马内小胶质细胞标志物Iba-1表达上调。研究结果的不一致可能与小胶质细胞活化状态不同有关:激活后的小胶质细胞有2种状态,不同状态下的小胶质细胞作用不同。机体正常情况下,激活的小胶质细胞通过释放神经营养因子、诱导组织修复等途径发挥神经保护作用;病理状态下,小胶质细胞过度激活并释放大量的神经炎症因子,进一步加重组织损伤。本研究采用Western blot检测小胶质细胞标志物表达情况,于Aβ损伤后12 d未能观察到hUCMSCs移植对Aβ诱导的小胶质细胞活化具有上调或下调的作用。考虑与小胶质细胞活化状态有关。
综上所述,hUCMSCs移植可改善Aβ损伤大鼠的空间学习记忆能力,抑制胶质细胞活化引起的炎症因子释放,对抗Aβ引起的大鼠海马脑区星形胶质细胞活化。抑制星形胶质细胞活化及炎症因子释放可能是hUCMSCs改善Aβ损伤大鼠空间学习记忆能力,进而发挥神经保护作用的机制之一。
[参考文献]
[1] Querfurth HW,LaFerla FM. Alzheimer's disease[J]. N Engl J Med,2010,362(4):329-344.
[2] Hardy J,Selkoe DJ. The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J]. Science,2002,297(5580):353-356.
[3] De-Paula VJ,Radanovic M,Diniz BS,et al. Alzheimer's disease[J]. Subcell Biochem,2012,65:329-352.
[4] 韩华,薛改,张俊勤,等.人脐带间充质干细胞的分离、培养及鉴定[J].河北医科大学学报,2015,36(1):21-23.
[5] Yang H,Yang H,Xie Z, et al. Systemic transplantation of human umbilical cord derived mesenchymal stem cells-educated T regulatory cells improved the impaired cognition in AβPPswe/PS1dE9 transgenic mice[J]. PLoS One,2013,8(7):e69129.
[6] 刘莎,吴明,施兵奇,等.人脐带间充质干细胞通过上调神经营养因子表达改善Aβ损伤大鼠的学习记忆能力[J].中国药理学通报,2016,32(7):980-985.
[7] Prince M,Guerchet M,Prina M. World Alzheimer report 2013:Journey of caring:an analysis of long-term care for dementia[M]. Alzheimers Dis International,2013:1-92.
[8] Drouin-Ouellet J,Cicchetti F. Inflammation and neurodegeneration:the story retolled[J]. Trends Pharmacol Sci,2012,33(10):542-551.
[9] McManus RM,Heneka MT. Role of neuroinflammation in neurodegeneration:new insight[J]. Alzheimers Res Ther,2017,9(1):14.
[10] Bolós M,Perea J R,Avila J. Alzheimer's disease as an inflammatory disease[J]. Biomol Concepts,2017,8(1):37-43.
[11] Liu RX,Huang C,Bennett DA,et al. The characteristics of astrocyte on Aβ clearance altered in Alzheimer's disease were reversed by anti-inflammatory agent(+)-2-(1-hydroxyl-4-oxocyclohexyl) ethyl caffeate[J]. Am J Transl Res,2016,8 (10):4082-4094.
[12] 吴洁,吴红海,于洋,等.孕酮抑制Aβ诱导星形胶质细胞活化所致神经元损伤[J].中国药理学通报,2014,30(11):1539-1543.
[13] Hong Y,Wang X,Sun S,et al. Progesterone exerts neuroprotective effects against Aβ-induced neuroinflammation by attenuating ER stress in astrocytes[J]. Int Immunopharmacol,2016,33:83,89.
[14] 李琦军,常军英,吴永波,等.神经肽Y对小神经胶质细胞活化状态和生成TNF-α的影响及其作用机制[J].河北医科大学学报,2015,36(4):463-466.
[15] 李苑,易善勇,王松军,等.小胶质细胞介导的兴奋性氨基酸在大鼠DAI神经损伤中的作用[J].河北医科大学学报,2015,36(8):869-873.
[16] Lee HJ,Lee JK,Lee H,et al. Human umbilical cord blood-derived mesenchymal stem cells improve neuropathology and cognitive impairment in an Alzheimer's disease mouse model through modulation of neuroinflammation[J]. Neurobiol Aging,2012,33(3):588-602.