肾细胞癌是最常见的成人恶性肾肿瘤之一,发病率逐年上升。虽然根治性肾切除术可以有效治愈早期和局部肾细胞癌,但仍有30%患者术后会出现转移,这部分患者预后不佳,治疗方案有限[1]。因此,更好地了解肾癌的发病机制,从而制定预防和治疗肾癌的有效策略至关重要。Wnt/β-catenin信号传导通路被认为是经典的信号传导通路,其异常激活通常与肿瘤发生发展相关。本研究检测肾透明细胞癌(renal clear cell carcinoma,RCCC)及癌旁组织中分泌型卷曲相关蛋白1(secreted frizzled-related protein 1,SFRP1)和分泌型卷曲相关蛋白2(secreted frizzled-related protein 2,SFRP2)基因的甲基化状态及β-catenin蛋白的表达,探讨其与肾癌发生发展的关系及作用机制,旨在为深入揭示肾癌的发病机制以及为肾癌精准诊治和预后评估提供理论依据,现报告如下。
1 资 料 与 方 法
1.1一般资料 选择河北省石家庄市第一医院泌尿外科手术切除的122例RCCC组织标本,其中男性85例,女性37例;年龄30~79岁,平均年龄(54.5±14.4)岁;肾细胞癌采用世界卫生组织(WHO)/国际泌尿病理学会(ISUP)新的分级,G115例,G270例,G325例,G412例;根据2010年美国癌症联合委员会肾癌TNM分期,Ⅰ期 45例,Ⅱ期48例,Ⅲ期24例,Ⅳ期5例。选择癌旁组织(距离癌组织约2 cm)62例,其中男性41例,女性21例;年龄32~78岁,平均年龄(55.2±14.2)岁。所有癌及癌旁组织分成2份,一份-80 ℃冰箱保存,备用于DNA提取,另一份常规石蜡包埋,所有标本均经病理证实为RCCC,且癌旁组织未见癌侵犯。
1.2DNA提取及甲基化修饰 按照DNA提取试剂盒说明书操作,提取RCCC及癌旁组织中的DNA,并检测DNA的含量及纯度。对OD值在1.8~2.0的标本,按照甲基化DNA修饰试剂盒说明书操作进行亚硫酸氢盐修饰,经过修饰的DNA即刻进行甲基化特异性PCR检测,或-80 ℃冰箱保存。
1.3MSP检测 SFRP1甲基化PCR引物:5′-TGTAGTTTTCGGAGTTAGTGTCGCGC-3′(F),5′-CCTACGATCGAAAACGACGCGAACG-3′(R),产物126 bp,退火温度63.0 ℃;SFRP1非甲基化PCR引物:5′-GTTTTGTAGTTTTTGGAGTT-AGTGTTGTGT-3′(F),5′-CTCAACCTACAATC-AAAAACAACACAAACA-3′(R), 产物135 bp,退火温度62.0 ℃。SFRP2甲基化PCR引物:5′-GGGTCGGAGTTTTTCGGAGTTGCGC-3′(F),5′-CCGCTCTCTTCGCTAAATACGACTCG-3′(R),产物138 bp,退火温度65.0 ℃;SFRP2非甲基化PCR引物:5′-TTTTGGGTTGGAGTTTTTTG-GAGTTGTG-3′(F),5′-AACCCACTCTCTTCAC-TAAATACAACT-3′(R),产物145 bp,退火温度55.0 ℃。DNA在修饰前后分别经甲基化PCR和非甲基化PCR引物扩增,如修饰前无任何目的条带扩增,而修饰后有目的条带的扩增,则认为修饰完全。PCR反应条件:95 ℃,10 min;95 ℃,45 s;根据各基因退火温度45 s;72 ℃,1 min,40个循环;72 ℃,10 min。
1.4设立对照 抽取正常人外周血,乙二胺四乙酸抗凝,提取的有核细胞DNA经SssI甲基化酶处理后作为甲基化阳性对照,未经处理的正常人外周血DNA作为非甲基化的阴性对照,去离子水代替DNA模板作为空白对照,以消除假阳性的干扰。
1.5免疫组织化学SP法检测β-catenin表达情况 常规石蜡包埋组织,连续4 μm切片备用。SP法按试剂盒说明书操作进行。每次染色均设立阳性及阴性对照,选用已知阳性组织作为阳性对照,PBS代替一抗作为阴性对照。β-catenin染色部位为细胞膜,细胞膜呈棕黄色着色。细胞膜阳性>70%的为阳性,反之为表达缺失。细胞质或胞核阳性>10%视为异位表达。异位表达和表达缺失均视为异常表达。
1.6统计学方法 应用SPSS 19.0统计学软件分析数据,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1SFRP1、SFRP2基因在RCCC中的甲基化情况 甲基化存在3种情况:①甲基化,即MSP引物扩增出目的条带,而USP引物未扩增出目的条带;②非甲基化,即USP引物扩增出目的条带,而MSP引物未扩增出目的条带;③部分甲基化,即MSP、USP引物均有目的条带扩增,该情况记入甲基化。122例RCCC组织SFRP1基因和SFRP2基因甲基化发生率显著高于癌旁组织,差异有统计学意义(P<0.05)。见表1, 图1。
表1 SFRP1、SFRP2基因在RCCC及癌旁组织中的甲基化发生率比较
Table1The methylation rate of SFRP1and SFRP2genes in renal clear cell carcinoma and adjacent non-cancerous tissues(例数,%)
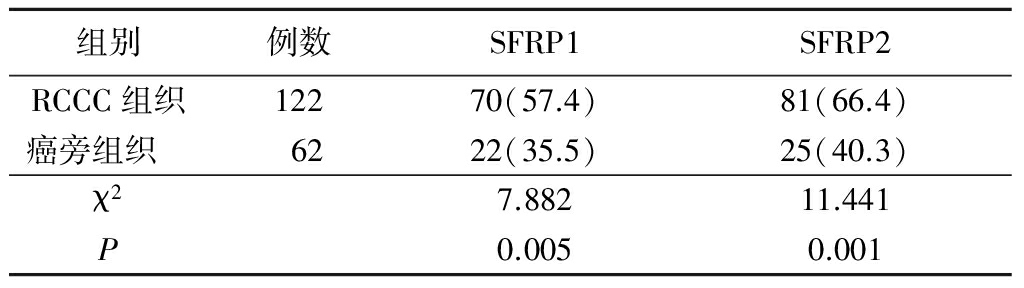
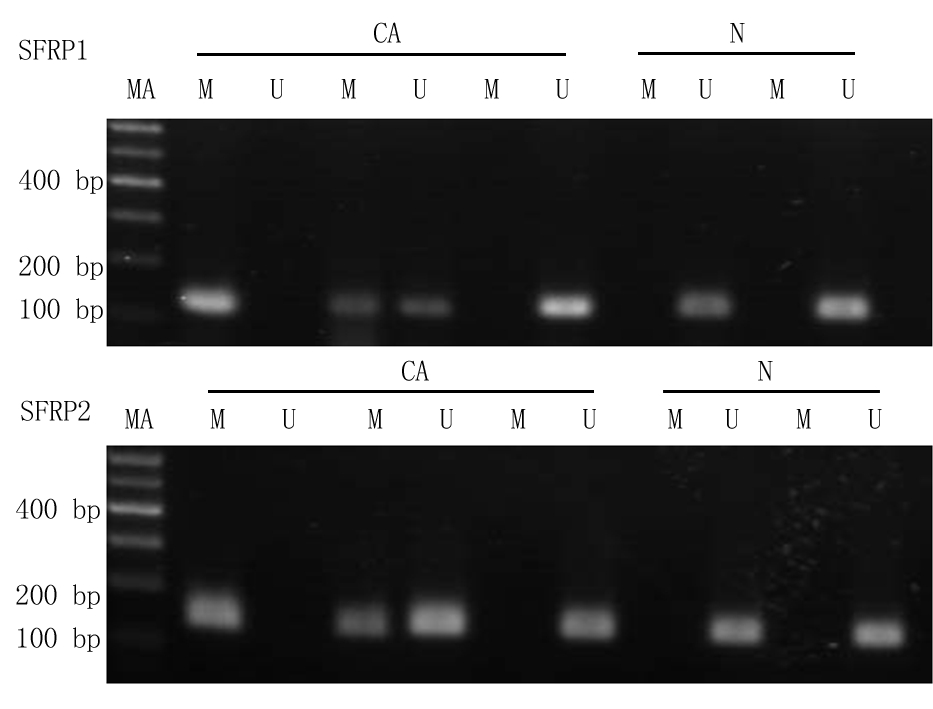
图1 SFRP1基因和SFRP2基因在RCCC组织及癌旁组织中的甲基化状态
MA:Maker;CA:肾癌组织;N:癌旁组织;M:甲基化;U:非甲基化
Figure1Methylation analysis of SFRP1SFRP2gene in RCCC and corresponding non-cancerous tissues
2.2不同临床分期和WHO/ISUP分级RCCC组织SFRP1、SFRP2基因甲基化发生情况 临床分期Ⅳ期RCCC组织SFRP1基因的甲基化发生率高于临床分期Ⅰ、Ⅱ、Ⅲ期,差异有统计学意义(P<0.05);不同WHO/ISUP 分级RCCC组织SFRP1基因甲基化发生率差异无统计学意义(P>0.05)。不同临床分期和WHO/ISUP 分级RCCC组织SFRP2基因甲基化发生率差异无统计学意义(P>0.05)。见表2。
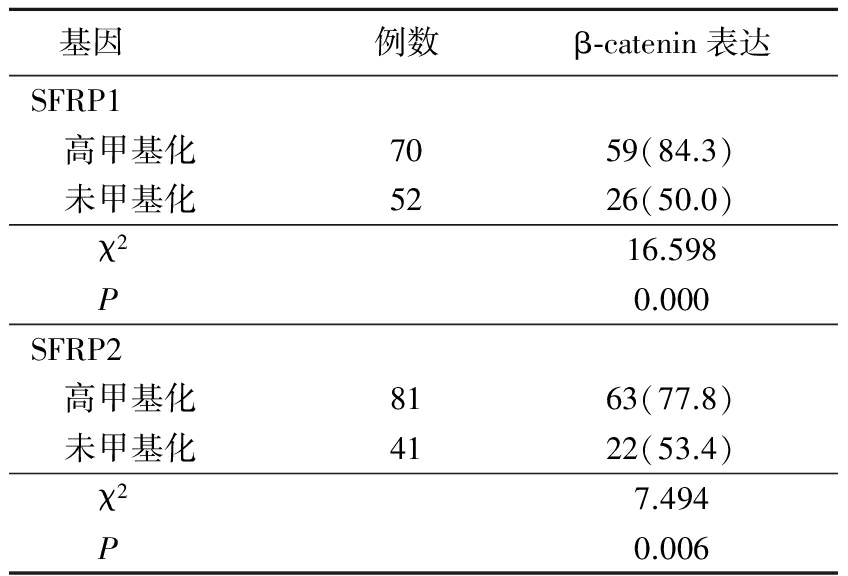
2.3β-catenin蛋白表达 RCCC组织中β-catenin蛋白的表达率为69.7%(85/122),明显高于癌旁组织的46.8%(29/62),差异有统计学意义(χ2=9.144,P=0.002)。高甲基化SFRP1基因在RCCC组织中β-catenin蛋白的表达率明显高于未甲基化的RCCC组织,高甲基化SFRP2基因在RCCC组织中β-catenin蛋白的表达率明显高于未甲基化的RCCC组织,差异有统计学意义(P<0.05)。见图2,表3。
表2 不同临床分期和WHO/ISUP 分级RCCC组织SFRP1、SFRP2基因甲基化发生率比较
Table2The incidence of methylation of SFRP1and SFRP2gene in different clinical stages and WHO/ISUP grading in RCCC tissues
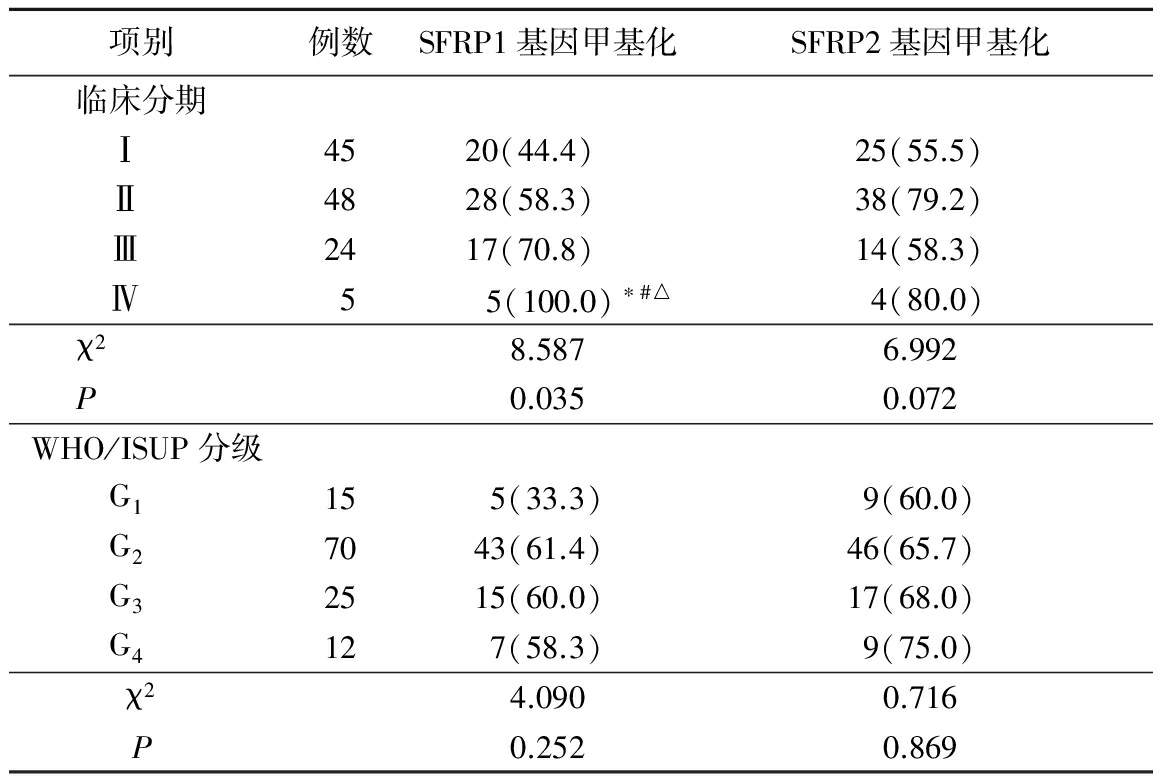
*P<0.05与Ⅰ期比较 #P<0.05与Ⅱ期比较 △P<0.05与Ⅲ期比较(χ2检验)
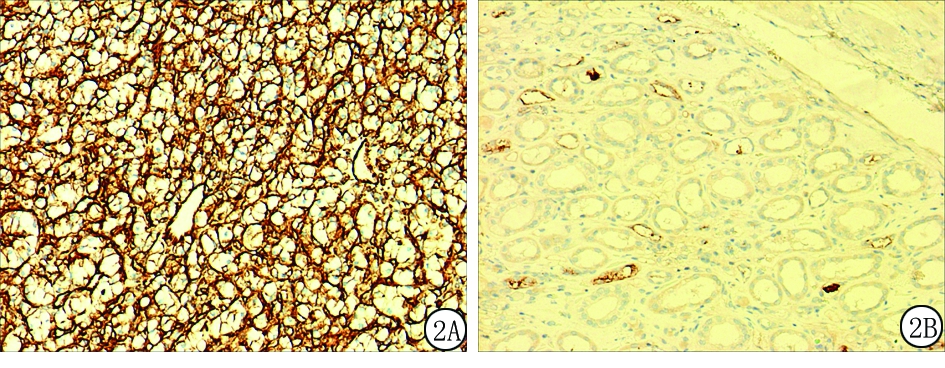
图2 RCCC组织及癌旁组织中β-catenin表达(SP ×100)
A.RCCC组别中β-catenin阳性表达;B.癌旁组织中β-catenin阴性表达
Figure2Expression of β-catenin in renal clear cell carcinoma and adjacent non-cancerous tissues(SP×100)
表3 RCCC中SFRP1,SFRP2基因在高甲基化及未甲基化中β-catenin表达情况
Table3The expression of β-catenin in hypermethylated and unmethylated SFRP1and SFRP2gene in RCCC
3 讨 论
肾癌又称肾细胞癌,发病率居泌尿系肿瘤第二位,且呈逐年上升的趋势。大约一半的肾细胞癌患者为局部肿瘤,而25%患者为局部侵袭性,其余25%诊断时已存在转移,主要转移部位是骨和肺。大约75%肾细胞癌患者为RCCC,且预后差异较大。由于缺乏特异性标记使得早期诊断困难,晚期肾细胞癌由于广泛转移,预后很差。 DNA甲基化作为表观遗传学4个步骤(组蛋白修饰、核小体重塑、 RNA 相关沉默、DNA 甲基化)之一,一直是众多学者关注的焦点。多种抑癌基因如VHL,RASSF1A基因等参与了肾癌的发生发展,并与临床分期及预后密切相关。
SFRP1、SFRP2基因为SFRPs家族的主要成员,研究发现其甲基化可对Wnt通路抑制减弱,引起该通路的异常活化,从而导致肿瘤的发生[2]。β-catenin蛋白作为癌基因,发挥着促进细胞增殖和抗细胞凋亡的重要作用,在正常组织中被抑制[3]。当功能障碍或Wnt通路被异常激活时,β-catenin由细胞膜进入细胞浆内,参与肿瘤发生,并增加侵袭及转移的风险[4]。
表观遗传学研究发现,SFRP1基因通过启动子区甲基化失活,肿瘤抑制基因在癌症中沉默,且在许多类型的癌症中,遗传(突变)和表观遗传(转录失活)水平的SFRP1缺陷[5]。徐成波等[6]研究发现SFRP1 基因在87例急性白血病患者中的甲基化阳性率为35.6%,同时在细胞总蛋白中β-catenin蛋白表达增加,启动细胞增殖、抗凋亡等恶性生物学效应。孟莹等[7]研究表明食管鳞癌细胞株中SFRP1 基因甲基化发生率高于正常细胞株。欧玉荣等[8]通过检测97例结直肠癌及40例正常肠黏膜组织中β-catenin、SFRP1的表达情况,发现SFRP1的表达与肿瘤浸润深度有关。以上研究均表明SFRP1可能促进肿瘤的侵袭和转移。本研究结果显示,122例RCCC组织SFRP1基因甲基化发生率显著高于癌旁组织,且与肿瘤患者的临床分期相关。由此可以推测SFRP1基因高甲基化状态可能促进了RCCC的发生发展、侵袭及转移。
SFRP2基因能竞争性地结合Wnt受体卷曲蛋白,在多种肿瘤中表达下调[9]。王志强等[10]研究表明在40例食管癌中SFRP2表达低于癌旁组织,提示SFRP2基因的低表达可能与食管癌的发生发展有关。宋毓飞等[11]研究发现,在胃癌患者血浆中SFRP2基因的甲基化发生率为67.2%,显著高于健康志愿者的37.3%。樊漪波等[12]研究显示,SFRP2基因在结直肠癌组、腺瘤组、非腺瘤样息肉组、健康对照组的甲基化发生率分别为79%、48%、4%、0。贾凤洁等[13]研究显示,52例大肠癌患者粪便中SFRP2基因甲基化发生率显著高于32例健康体检者,表明SFRP2基因甲基化可能是大肠癌进展过程的早期事件。本研究结果显示,SFRP2基因在RCCC中的甲基化发生率显著高于癌旁组织,由此推测SFRP2基因甲基化可能参与了RCCC的发生,且SFRP2 基因高甲基化与患者肿瘤临床分期和病理组织学分级无关,提示SFRP2 基因甲基化不能预测RCCC的恶性程度和预后。
β-catenin是Wnt通路活化的关键因子,该通路中任何一个信号分子发生异常均会导致β-catenin在胞质、胞核内聚集,增加下游靶基因的转录活性,使细胞发生异常增殖。β-catenin还可与细胞膜上的钙黏蛋白结合,调控细胞间黏附,影响肿瘤细胞的侵袭和转移。鉴于其在黏附和增生过程中的双重作用,成为肿瘤发生发展机制研究中的热点[14]。樊漪波等[12]研究显示在结直肠癌组、腺瘤组及非腺瘤样息肉组、健康对照组β-catenin蛋白表达率分别为74%、63%、8%、0, 提示SFRP2启动子区甲基化、β-catenin异常表达与结直肠癌发生有关。练鑫等[15]研究发现RCCC中Jade-1蛋白表达高级别组织显著低于低级别组织,β-catenin表达高级别组织显著高于低级别组织,提示肿瘤侵袭性越高,体内Wnt/β-catenin信号通路可能越活跃。
本研究结果发现β-catenin在RCCC组织中高表达,且明显高于癌旁组织,提示在肾癌中可能存在激活状态;发生SFRP1、SFRP2基因甲基化的RCCC组织中,β-catenin表达率明显高于未发生甲基化的RCCC组织,推测SFRP1、SFRP2基因的高甲基化有可能是引起β-catenin蛋白异常表达的分子机制之一,而且可能是通过Wnt/β-catenin通路的活化发生的。孙式伟等[16]研究表明应用脱甲基药物DAC或紫杉醇处理肾癌细胞株后,LEF1的表达明显降低,说明LEF1基因参与了DAC与紫杉醇抑制肾癌细胞生长的作用。本研究显示SFRP1、SFRP2基因的高甲基化状态与RCCC的发生相关,且有可能通过Wnt/β-catenin信号通路参与RCCC的发生,这将有助于从分子水平揭示肾癌的发病机制,为肾癌的早期诊断、早期治疗、预后评估提供理论依据,并为肾癌的靶向治疗提供前瞻性研究。
[参考文献]
[1] Nwadei IU,Lorentz A,Patil D,et al. Renal cell carcinoma with vena caval involvement:a contemporary clinicopathologic analysis of 53 cases[J]. Hum Pathol,2016,49:83-89.
[2] Valcz G,Patai AV,Kalmar A,et al. Myofibroblast-derived SFRP1 as potential inhibitor of coloreclal carcinoma field effect[J]. PLoS One,2014,9(11):e106143.
[3] 林辉,张祥贵.Wnt/β-catenin信号通路与肾脏疾病[J].海南医学,2017,28(2):267-271.
[4] Chen J,Muthukumar R,Xia H,et al. The microtubule-associated protein PRC1 promotes early recurrence of hepatocellular carcinoma in association with the wnt/β-catenin signaling pathway[J]. Gut,2016,65(9):1522-1534.
[5] Liu C,Li N,Lu H,et al. Circulating SFRP1 promoter methylation status in gastric adenocarcinoma and esophageal square cell carcinoma[J]. Biomedical Reports,2015,3:123-127.
[6] 徐成波,沈建箴,廖斌,等.Jurkat细胞SFRP基因甲基化及去甲基化诱导凋亡的研究[J].中华血液学杂志,2016,37(1):51-55.
[7] 孟莹,朱圣韬,李鹏,等.启动子区甲基化和组蛋白乙酰化对人食管鳞癌细胞SFRPl基因表达的影响[J].胃病学和肝病学杂志,2015,24(5):506-509.
[8] 欧玉荣,景桂英,刘娟,等.Wnt信号通路T细胞因子4、β-catenin与SFRPI在结直肠癌中表达及预后关系[J].生物医学工程学杂志,2015,32(4):854-861.
[9] Wu Y,Bai J,Hong L,et al. Low expression of secreted frizzled related protein 2 and nuclear accumulation of β-catenin in aggressive nonfunctioning pituitary adenoma [J]. Oncol Lett,2016,12(1):199-206.
[10] 王志强,喻国平,周斌峰,等.sFRP、WIF-1、CD133、CD44在食管癌中的表达及其临床意义[J].江西医药,2014,49(12):1410-1413.
[11] 宋毓飞,张谢,孙蓓蕾,等.联合检测血浆SFRP2、RNF180基因甲基化在胃癌临床诊断中的价值[J].胃肠病学,2015,20(1):19-23.
[12] 樊漪波,武丽娜,梁钢,等.分泌型卷曲相关蛋白启动子区甲基化与联蛋白异常表达在结直肠癌中的意义[J].中国药物与临床,2017,17(5):624-627.
[13] 贾凤洁,孙东生,徐龙健,等.粪便中SFRP2基因甲基化与大肠癌的相关性[J].中国老年学杂志,2015,35(5):1206-1207.
[14] Arya M,Thrasivoulou C,Henrique R,et al. Tangets of Wnt/β-catenin transcription in penile carcinoma[J]. PLoS One,2015,10(4):e124395.
[15] 练鑫,翁志粱,吴秀玲,等.Jade-1及β-catenin在肾癌组织中的表达及临床意义[J].医学研究杂志,2012,41(3):87-92.
[16] 孙式伟,李远,赵春利,等.LEF1在脱甲基化药物DAC和紫杉醇联合治疗肾癌中的作用分析[J].河北医科大学学报,2013,34(4):391-396.