妊娠期糖尿病(gestational diabetes mellitus,GDM)在我国的发生率为1%~14%[1-4],有逐年升高且年轻化的趋势。GDM可造成巨大儿、胎儿畸形、胎儿窘迫等多种不良妊娠结局,是孕期常见的合并症。随着我国“全面二孩”政策的实施,高龄孕产妇的增加,辅助生殖技术的广泛应用,外源性孕激素的使用率随之增高[5-6]。国外曾有报道外源性孕激素与妊娠期糖尿病发病有关。Rebarber等[7]回顾性研究发现,17-羟孕酮可降低复发性先兆流产的发生,但同时增加GDM的发生风险,17-羟孕酮组GDM发生率高于对照组。Waters等[8]的一项多因素Logstic回归分析发现,使用17-羟孕酮是GDM发病的独立危险因素,17-羟孕酮组GDM发生率高于对照组,且肌内注射的风险高于口服用药。目前孕激素的应用是否与妊娠期糖尿病的发病相关尚无定论。本研究比较孕早期应用孕激素孕妇与未应用孕激素孕妇GDM的发病率,探讨孕早期应用孕激素与GDM发病的关系,旨在规范孕早期孕激素的应用,并通过早期血糖管理降低GDM的发病率。
1 资 料 与 方 法
1.1一般资料 选择河北大学附属医院2015年9月—2017年9月孕早期孕酮低水平孕妇,剔除孕前糖尿病者11例及其他合并症(如多囊卵巢综合征、急性肝炎等)及不良妊娠结局(胚胎停育、死胎、流产等)者62例,符合条件者663例。孕早期应用孕激素者424例作为观察组,其中口服组185例,肌注组239例。未应用孕激素者239例作为对照组。观察组年龄24~37岁,平均(29.2±2.3)岁;孕次1~4次,平均(2.2±0.4)次;产次0~3次,平均(0.5±0.2)次。对照组年龄23~36岁,平均(28.3±2.2)岁;孕次1~4次,平均(2.0±0.3)次;产次0~3次,平均(0.6±0.1)次。2组年龄、孕次、产次等差异均无统计学意义(P>0.05),具有可比性。
1.2纳入和排除标准 纳入标准:①宫内妊娠;②孕早期孕酮小于正常范围,出现下腹疼痛、阴道出血等先兆流产的症状。排除标准:①孕前糖尿病及糖耐量异常;②有吸烟史[9]、多囊卵巢病史[10]、2型糖尿病家族史[11]及体质量指数大于23.9者;③胚胎停育、难免流产等不良妊娠结局;④妊娠期急性胰腺炎、妊娠期急性脂肪肝等[11]对孕期血糖影响较大的合并症。
1.3给药方案 以孕早期孕激素适应证确定是否应用孕激素;选择合理剂型;监测血孕酮水平,参考孕期对应孕周孕酮水平正常范围确定给药时间(给药1周为1个疗程,每个疗程结束测定血浆孕酮水平)。口服组统一给予黄体酮胶囊(浙江仙琚制药股份有限公司生产,国药准字H20041902,给药剂量200 mg/d,给药1周为1个疗程,给药时间1~2个疗程)。肌注组统一给予黄体酮注射液(浙江仙琚制药股份有限公司生产,国药准字H33020828,给药1周为1个疗程),肌注小剂量组:单次剂量20 mg/d,给药1~2个疗程;肌注中剂量组:单次剂量20 mg/d,给药3~4个疗程; 肌注大剂量组:单次剂量40 mg/d,给药8~10个疗程。对照组:无应用孕激素指征,未用药。
1.4相关检查、检测及统计 (1)停经6~8周(体外受精-胚胎移植术后于胚胎移植日):①行超声检查确定宫内妊娠良好;②采集静脉血5 mL,采用酶联免疫吸附测定法检测血浆孕酮水平(作为给药剂型的参考);③采集静脉血5 mL,采用葡萄糖酶化法测定空腹血糖值及糖化血红蛋白,排除孕前糖尿病和孕前糖耐量异常。(2)用药1个疗程后再次测定血浆孕酮水平(作为确定给药时间的参考)。(3)孕24~28周:行葡萄糖耐量试验并记录结果。(4)根据2014妊娠合并糖尿病诊治指南确定GDM病例,并统计各组发病率。
1.5统计学方法 应用SPSS 19.0统计软件处理数据。计量资料比较采用t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1GDM发病率比较 观察组GDM发病率高于对照组(χ2=15.299,P=0.000)。口服组GDM发病率与对照组差异无统计学意义(P>0.05);肌注组GDM发病率高于对照组,口服组GDM发病率低于肌注组,差异均有统计学意义(P<0.05)。见表1。
表1 口服组、肌注组及对照组GDM发病率比较
Table2Comparison of the incidence of GDM in oral,intramuscular and control groups(例数,%)
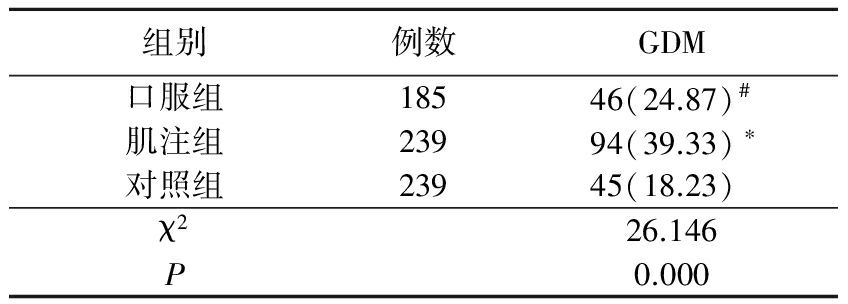
*P<0.05与对照组比较 #P<0.05与肌注组比较(χ2检验)
2.2不同肌注剂量组GDM发病率比较 肌注小剂量组GDM发病率低于中剂量组及大剂量组,肌注中剂量组GDM发病率低于大剂量组,差异均有统计学意义(P<0.05),见表2。
表2 不同肌注剂量组GDM发病率比较
Table2Comparison of the incidence of GDM in different intramuscular dose groups(例数,%)
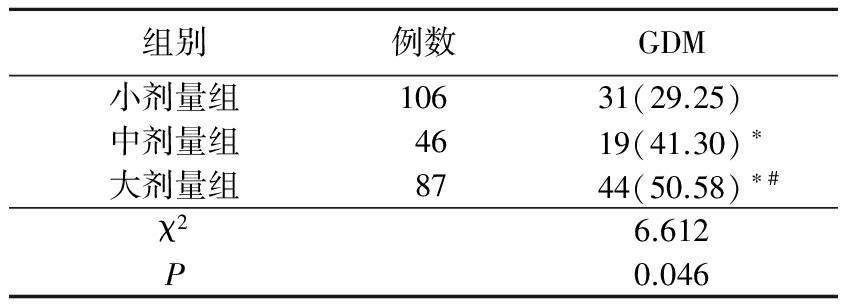
*P<0.05与小剂量组比较 #P<0.05与中剂量组比较(χ2检验)
3 讨 论
孕激素在孕早期由黄体分泌,维持胚胎发育,此时孕激素水平偏低可导致流产[12]。临床应用外源性孕激素治疗孕早期先兆流产、习惯性流产及胚胎移植后低孕酮血症,黄体功能不全时需应用外源性孕激素治疗,一般的给药方式为肌注或口服。
目前GDM发病机制尚未完全明确,有以下相关学说[13-18]:①遗传易感,HLAⅡ类基因、磺脲类受体1基因、FoxM1基因、肾上腺素能受体基因Trp64Arg均可增加GDM易感性,甘露糖结合凝集素基因多态性是GDM发病的高危因素;②氧化应激,细胞稳态被打破,导致蛋白折叠障碍或错误折叠,进而触发氧化应激,致糖代谢异常;③细胞因子分布及表达异常,炎症因子如C反应蛋白、肿瘤坏死因子、白细胞介素系统参与机体的炎症反应,参与GDM;④胎盘分泌的激素(如胎盘生乳素、雌激素、孕激素等)导致胰岛素抵抗,从而参与的发病。孕激素进入孕妇体内,可能直接或通过转换为17-羟孕酮导致胰岛素抵抗,从而影响孕妇血糖,其可能的机制为[19-22]:①孕激素通过影响细胞膜表面葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的易位、抑制胰岛素受体的酪氨酸激酶活性减少使胰岛素受体数量表达;②内源性孕激素通过影响瘦素的生物学功能、裂解长型跨膜瘦素受体产生可溶性瘦素受体,从而影响ADAM10,而ADAM10可导致孕期糖代谢异常;③抑制上皮细胞抗氧化作用,增加过氧化氢浓度,放大氧化应激信号;④导致脂肪负荷,从而致糖代谢异常。
本研究排除各组间年龄、孕次、产次等一般资料对GDM发病的影响,使各组GDM发病率具有可比性。结果显示观察组GDM发病率高于对照组(P<0.05),表明孕早期应用孕激素与GDM发病有关。口服组GDM发病率与对照组差异无统计学意义(P>0.05),表明口服给药对GDM发病率无影响,可能与首过效应有关,口服给药生物利用度极低,且个体差异大,肝脏首过代谢>90%[23]。肌注组GDM发病率高于对照组(P<0.05),表明肌注给药有增加GDM发病率的作用。口服组GDM发病率低于肌注组(P<0.05),说明口服给药GDM发病率低于肌注给药,可能与其生物利用度相关,国内研制的口服微分化黄体酮,其生物利用度仅为注射剂的6%~8%[24]。肌注小剂量组GDM发病率低于中剂量组及大剂量组、中剂量组GDM发病率低于大剂量组(P<0.05),表明GDM发病率与给药总剂量有关,总剂量越大,GDM发病率越高。本研究旨在探讨孕早期孕激素应用与GDM发病是否有关,从而规范孕早期孕激素的使用,以便针对其个体差异制定合理给药方案,原则上能口服给药尽量不肌注给药,能短时小剂量给药尽量不长期大剂量给药。另外,对于高危孕妇,应积极进行产前咨询,尤其肌注大剂量孕激素的孕妇大部分为体外受精-胚胎移植术后,胚胎移植后需应用孕激素人工助孕,故孕期应提高其血糖关注度,严格进行血糖监测,必要时进行葡萄糖耐量试验,通过合理饮食及适量运动,降低GDM发病率。
[参考文献]
[1] 刘伟.妊娠期糖尿病发病相关因素的研究进展[J].现代妇产科进展,2014,23(4):308-310.
[2] 魏玉梅,杨慧霞.《国际妇产科联盟妊娠期糖尿病实用指南》带来的启示[J].中华围产医学杂志,2016,19(5):321-322.
[3] 赵娜,李素梅.妊娠期糖尿病发病机制的研究进展[J].临床与病理杂志,2012,32(2):135-139.
[4] 罗艳.妊娠期糖尿病相关危险因子及危害性研究进展[J].医药前沿,2017,7(19):6-7.
[5] Chan JC,Zhang Y,Ning G. Diabetes in China: a societal solution for a personal challenge[J]. Lancet Diabetes Endocrinol,2014,2(12):969-979.
[6] 王宝林.妊娠糖尿病筛查与筛查阳性的危险因素分析[J].糖尿病新世界,2016,19(4):80-82.
[7] Rebarber A,lstwan NB,Russo Stieglitz K,et al. Increased incidence of gestational diabetes in women receiving prophylactic 17alpha-hydroxyl progesterone caproate for prevention of recur rent preterm delivery[J]. Diabetes Care,2007,30(9):2277-2280.
[8] Waters TP,Schultz BA,Mercer BM,et al. Effect of 17alpha-hydroxy progesterone caproate on glucose intolerance in pregnancy[J]. Obstet Gynecol,2009,114(1):45-49.
[9] 李宝娟,董玲.妊娠期糖尿病危险因素的研究进展[J].国际妇产科学杂志,2013,40(6):504-506.
[10] 张凯,薛晴,杨慧霞.多囊卵巢综合征与妊娠期糖尿病相关性的研究进展[J].中华妇产科杂志,2015,50(7):548-551.
[11] 李慧,陈惠,李淑英,等.妊娠期急性脂肪肝临床特征及预后不良相关因素探讨[J].四川大学学报,2017,48(5):806-808.
[12] 孙巧云.妊娠期合并糖尿病高龄初产对妊娠及其结局的影响[J].临床医学研究与实践,2016,23(1):73-74.
[13] 张国军,郑丽华,孙锡红.妊娠期糖尿病研究进展[J].河北医科大学学报,2015,36(7):862-866.
[14] 梁雪梅,王加,陆琳琳.妊娠期糖尿病胰岛素治疗对母婴结局的影响[J].中国医学创新,2013,10(3):62-63.
[15] Davis DB,Lavine JA,Suhonen JI,et al. FoxM1 is up-regulated by obesity and stimulates beta-cell proliferation[J]. Mol Endocrinol,2010,24(9):1822-1834.
[16] 石华.妊娠期糖尿病患者血清Chemerin的变化与胰岛素抵抗的关系[J].湖北民族学院学报:医学版,2016,33(2):43-45.
[17] 许恬怡,陈焱,施怡如,等.褪黑素受体1B基因rs10830962位点单核苷酸多态性与妊娠期糖尿病发病的关系[J].中华妇产科杂志,2016,51(6):461-464.
[18] Linnemann K,Malek A,Sager R,et al. Leptin production and release in the dually in vitro perfused human placenta[J]. J Clin Endocrinol Metab,2000,85(11):4298-4301.
[19] 陈正琼.妊娠期糖耐量异常患者血清E2、P、PRL水平变化及其与瘦素水平的关系[J].重庆医学,2006,35(6):528-529.
[20] 宋依临,马京梅,杨慧霞.妊娠期糖尿病孕妇外周血中Toll样受体4的表达及影响因素[J].中华妇产科杂志,2016,51(8):616-619.
[21] Kopp W. Role of High insulinogenic nutrition in the etlology of gestafionel diabetes mellims[J]. Med Hgpotheses,2005,(64):101-103.
[22] Schaab M,Kausch H,Klammt J,et al. Novel regulatory mechanisms for generation of the soluble leptin receptor: implications for leptinaction[J]. PLoS One,2012,7(4):47-48.
[23] Sun L,Jin Z,Teng W,et al.SHBG in GDM maternal serum, placental tissues and umbilical cord serum expression changes and its significance[J]. Diabetes Res Clin Pract,2013,99(2):168-173.
[24] 郑新,秦小莲,王缉义,等.黄体酮在妇产科外领域的研究及临床应用进展[J].中国药房,2016,27(16):2292-2295.