近年来,寻求安全、经济、有效的药物治疗糖尿病性视网膜病变已成为众多学者研究的热点。二十碳五烯酸(eicosapentaenoic acid,EPA)是人体正常饮食中不可缺少的不饱和脂肪酸,浓度≥0.15 g/L时,可抑制体外培养的人血管内皮细胞增殖。联合注药法建立的增殖型糖尿病性视网膜病变(proliferative diabetic rentinopathy,PDR)动物模型能够代表人类PDR。EPA 体内应用可以减轻糖尿病性视网膜病变(diabetic retinopathy,DR)背景期病变,阻止增殖性血管病变发生,对视网膜神经细胞有保护作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)、flk-1、bax、bcl-2在DR视网膜组织中的表达变化与DR关系密切。本研究观察EPA治疗后DR大鼠视网膜组织中VEGF、flk-1、bax、bcl-2的表达,报告如下。
1 材 料 与 方 法
1.1实验动物与主要试剂 8周龄清洁级健康SD大鼠,雌雄各半,180~250 g。购自河北省实验动物中心。VEGF蛋白购自美国Sigma公司;VEGF、flk-1、bax、bcl-2一抗购自博士德公司;PV-6001/6002免疫组织化学试剂盒购自北京中杉公司。
1.2方法 链脲佐菌素(streptozocin,STZ)60 mg/kg腹腔注射制备SD大鼠糖尿病模型[1]共36只,随机分为4组:C组12只成模后1个月VEGF(0.05 μg)双眼玻璃体注射;D组12只成模后1个月VEGF(0.05 μg)+EPA(0.5 μg)双眼玻璃体注射;E组8只成模后1个月VEGF(0.05 μg)双眼玻璃体注射,2周后EPA(0.5 μg)双眼玻璃体注射;F组4只成模后1个月VEGF(0.05 μg)双眼玻璃体注射,4周后EPA(0.5 μg)双眼玻璃体注射。
1.3取材 VEGF注射后2周、4周、8周分别处死每组各4只动物制作视网膜切片。行免疫组织化学染色,应用MIAS1998型图像分析系统(河北医科大学第三医院实验中心)测定VEGF、flk-1、bax、bcl-2在节细胞层、内网层的平均光密度值,观察视网膜节细胞层和视网膜内网层VEGF、flk-1、bax、bcl-2的表达。
1.4统计学方法 应用SPSS 13.0统计软件分析数据,计量资料比较分别采用t检验、F检验及SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1VEGF的表达
2.1.1光学显微镜观察 C组VEGF在视网膜除视杆视锥层外节之外的各层均有表达,节细胞层和神经纤维层表达最强,其次为Müller细胞(图1)。D、E、F组大鼠视网膜VEGF表达阳性部位均与C组相同。D组注射2周后视网膜层VEGF的表达强度较C组注射2周后VEGF的表达强度弱(图2),D组注射4周后除内网层以外表达强度较C组注射4周后弱,D组注射8周后内网层表达强度较C组注射8周后增强;E组注射4周后表达强度较C组明显减弱(图3),E组注射8周后则无明显改变;F组注射8周后内网层表达较C组注射8周后组增强(图4)。
2.1.2各组视网膜节细胞层和内网层VEGF的表达 在视网膜节细胞层,注射2周时D组VEGF的表达强度低于C组,注射4周时D组和E组VEGF的表达强度均低于C组,注射8周时D组VEGF的表达强度高于C组,E组和F组VEGF的表达强度均低于D组,差异有统计学意义(P<0.05);在视网膜内网层,注射2周时D组VEGF的表达强度低于C组,注射4周时D组和E组VEGF的表达强度均低于C组、E组又低于D组,注射8周时D组和F组VEGF的表达强度均高于C组、F组VEGF的表达强度高于E组,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠视网膜节细胞层和视网膜内网层的VEGF光密度值
Table1Optical density value of VEGF expression in ganglion cell layer and in IPL in each group ![]() 值)
值)
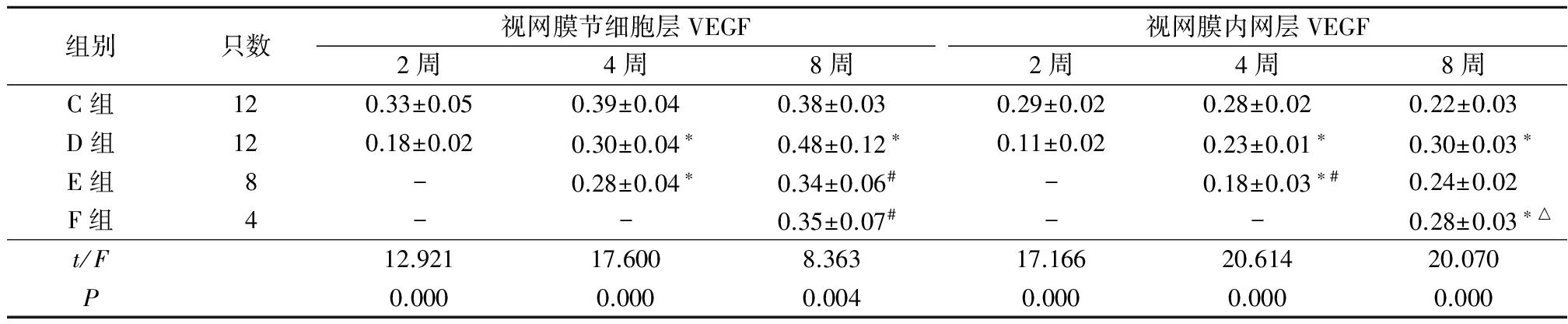
*P<0.05与C组比较 #P<0.05与D组比较 △P<0.05与E组比较(SNK-q检验)
2.2flk-1的表达
2.2.1光学显微镜观察 C组、D组、E组、F组flk-1在视网膜除视杆视锥层外节之外的各层均有表达(图5,6)。D组注射2周后表达强度与C组注射2周后比较无明显变化;D组注射4周后节细胞层表达强度与C组注射4周后比较略有增强(图6);D组注射8周后表达强度与C组注射8周后比较明显减弱(图7)。E组、F组表达强度与C组比较明显减弱(图8,9)。
2.2.2各组视网膜节细胞层和内网层flk-1的表达 在视网膜节细胞层,注射2周时C组与D组flk-1的表达强度差异无统计学意义(P>0.05),注射4周时D组flk-1的表达强度高于C组和E组,E组flk-1的表达强度低于C组和D组,注射8周时D组、E组和F组flk-1的表达强度均低于C组,E组flk-1的表达强度低于D组和F组,差异有统计学意义(P<0.05);在视网膜内网层,注射2周时C组与D组flk-1的表达强度差异无统计学意义(P>0.05),注射4周时D组flk-1的表达强度高于C组,E组flk-1的表达强度低于C组和D组,注射8周时D组、E组和F组flk-1的表达强度均低于C组,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠视网膜节细胞层和视网膜内网层的flk-1光密度值
Table2Optical density value of flk-1expression in ganglion cell layer and in IPL in each group ![]() 值)
值)
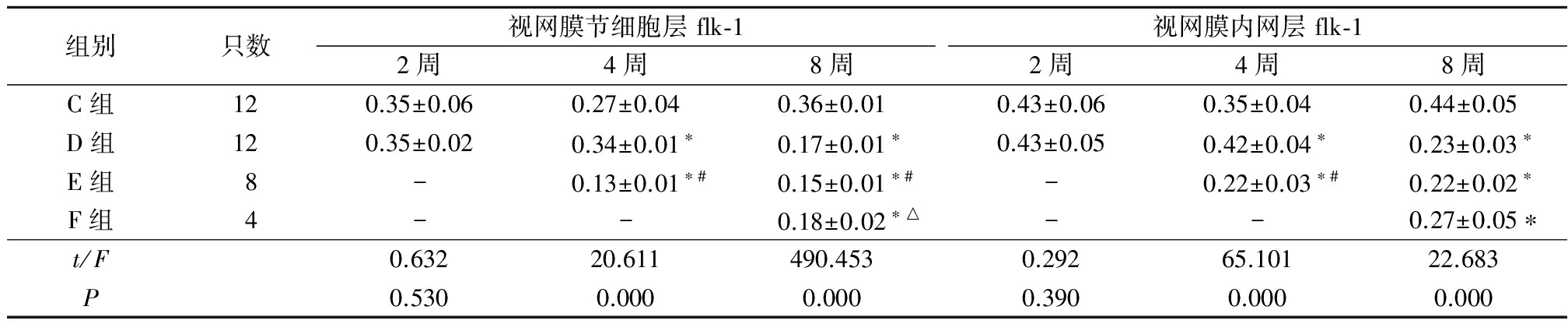
*P<0.05与C组比较 #P<0.05与D组比较 △P<0.05与E组比较(SNK-q检验)
2.3bax的表达
2.3.1光学显微镜观察 C组、D组、E组、F组bax在视网膜除视杆视锥外节之外的各层均有表达,其中属神经节细胞层和神经纤维层的表达最强(图10,11),但D组较C组各层表达强度均减弱(图11);E组注射4周后在内网层的表达强度减弱,其余各层无明显变化;E组注射8周后在各层表达强度均有所减弱;F组表达强度在各层均减弱。
2.3.2各组视网膜节细胞层和内网层bax的表达 在视网膜节细胞层,注射2周时D组bax的表达强度低于C组,注射4周时D组的bax表达强度低于C组,E组bax的表达强度高于D组和C组,注射8周时D组、E组和F组bax的表达强度均低于C组,E组和F组的bax表达强度均高于D组,F组又高于E组,差异有统计学意义(P<0.05);在视网膜内网层,注射2周时D组bax的表达强度低于C组,注射4周时D组和E组bax的表达强度低于C组,注射8周时D组、E组和F组的bax表达强度均低于C组,E组和F组的bax表达强度均高于D组,F组高于E组,差异有统计学意义(P<0.05)。见表3。
表3 各组大鼠视网膜节细胞层和视网膜内网层的bax光密度值
Table3Optical density value of bax expression in ganglion cell layer and in IPL in each group ![]() 值)
值)
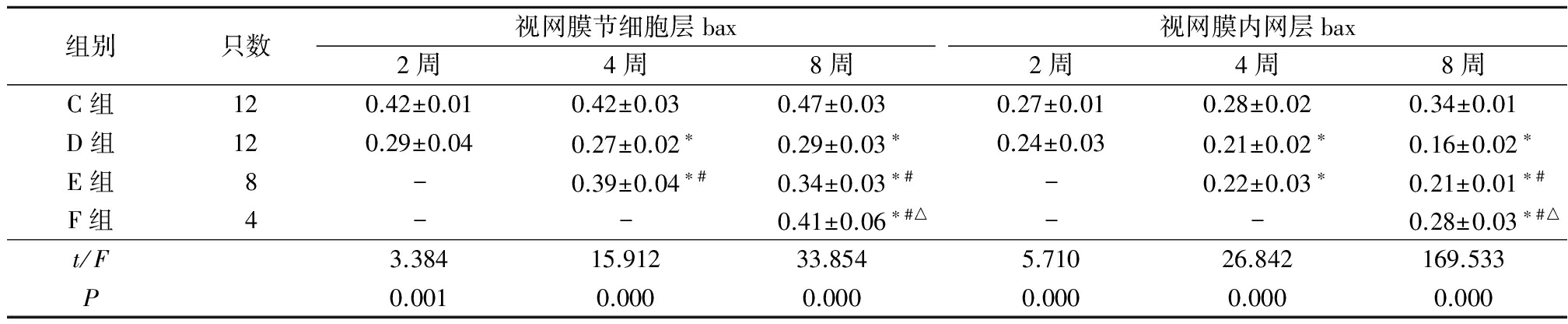
*P<0.05与C组比较 #P<0.05与D组比较 △P<0.05与E组比较(SNK-q检验)
2.4bcl-2的表达
2.4.1光学显微镜观察 C组bcl-2在视网膜除视杆视锥层外节之外的各层均有表达,C组注射2周后在节细胞层和神经纤维层的表达阳性程度明显强于其他各组;D组注射2周后各层阳性程度均较C组减弱(图12),D组注射4周、8周后仅在内网层表达强度减弱;E组在内网层的表达强度减弱;F组在各层表达强度均减弱。
2.4.2各组视网膜节细胞层和内网层bcl-2的表达 在视网膜节细胞层,注射2周时D组bcl-2的表达强度低于C组,注射4周时E组的bcl-2表达强度低于C组,注射8周时D组和F组的bcl-2表达强度均低于C组;在视网膜内网层,注射2周时D组的bcl-2表达强度低于C组,注射4周时D组和E组的bcl-2表达强度均低于C组,E组高于D组,注射8周时D组、E组和F组的bcl-2表达强度均低于C组,差异有统计学意义(P<0.05)。见表4。
表4 各组大鼠视网膜节细胞层和视网膜内网层的bcl-2光密度值
Table4Optical density value of bcl-2expression in ganglion cell layer and in IPL in each group ![]() 值)
值)
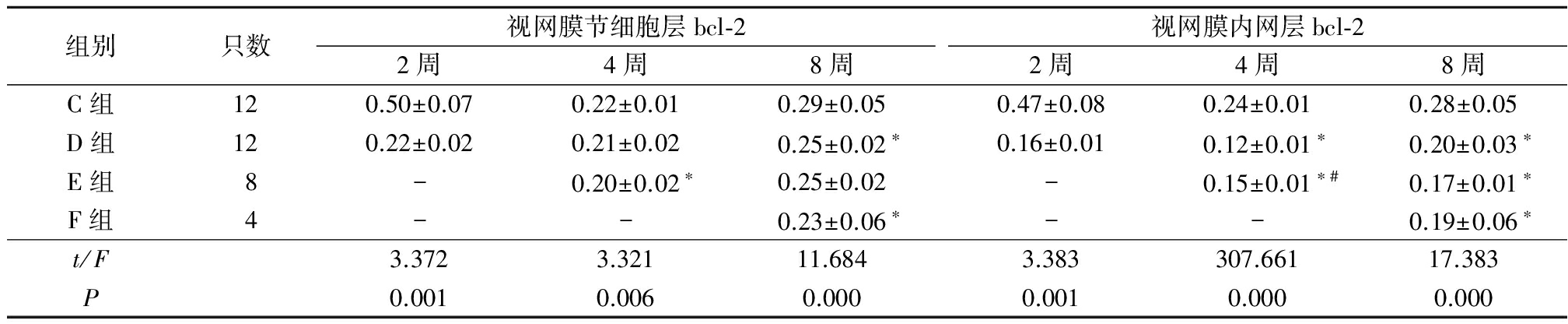
*P<0.05与C组比较 #P<0.05与D组比较 △P<0.05,与E组比较(SNK-q检验)
3 讨 论
3.1VEGF和flk-1表达的变化 VEGF是DR微血管病变的重要因子。大量研究表明,糖尿病时VEGF在视网膜的表达明显高于正常且随病程进展渐增,特异性酪氨酸激酶受体flk-1表达也随病程渐增强[2-5]。前期研究联合用药诱发的PDR大鼠模型视网膜组织VEGF及flk-1表达变化支持上述观点,并证实在背景期和增殖前期进行EPA玻璃体注射可以阻止增殖性血管病变发生[6]。为进一步明确EPA治疗PDR的机制,本研究对EPA治疗组大鼠视网膜组织VEGF和flk-1表达进行了免疫组织化学分析。
本研究显示,背景期治疗后2周、4周,增殖前期治疗后2周时节细胞层VEGF表达较对照组减弱;背景期、增殖前期治疗后2周时内网层VEGF表达较对照组减弱;背景期治疗后8周、增殖期治疗后4周时内网层VEGF表达较对照组增强。说明背景期治疗后4周内和增殖前期治疗后2周内视网膜内层VEGF表达减弱,阻止了PDR发生;而EPA治疗后8周对VEGF的影响作用消失,增殖期给药对抑制VEGF表达无效。
本研究显示,flk-1表达增强出现在注射VEGF后2周、8周,背景期治疗组2周、8周,增殖前期治疗组4周、8周时节细胞层flk-1的表达较对照组减弱。说明EPA在背景期、增殖前期给药后2周可有效抑制flk-1表达,从而抑制VEGF与受体结合发挥作用。背景期治疗组4周时表达增强,用EPA是受体封闭剂难以解释,具体机制尚待研究。病程发展到8周时flk-1表达较对照组减弱,8周时背景期、增殖前期、增殖期治疗组内网层VEGF表达均较对照组减弱。说明在任何期给予EPA治疗后,8周病程时内网层flk-1的表达均减弱,VEGF发挥作用受抑制。
3.2促凋亡基因bax和抑凋亡基因bcl-2表达的变化 bcl-2基因可保护视网膜神经细胞,抑制其凋亡[7-8]。bax是bcl-2的同种性蛋白,作用相反,二者之间的比例决定了细胞生存还是凋亡[9-10]。以往研究表明,bax在糖尿病大鼠[11-12]、和人[13]视网膜表达增加。bcl-2则存在争议:Drel等[14]发现,链脲佐菌素诱导的大鼠视网膜血管周细胞表达bcl-2降低;Wu等[15]和Han等[16]发现糖尿病患者的视网膜Muller细胞表达bcl-2降低;Shin等[17]则发现糖尿病患者神经视网膜表达bcl-2增加;Cai等[18]发现视网膜血管内皮细胞表达bcl-2先增加后降低。
本研究显示,联合注药组DR大鼠视网膜bax表达增加,随病程进展视网膜内层bcl-2表达增加,而外源性VEGF则在短期内使bcl-2表达增加。为明确EPA治疗PDR机制,本研究对EPA治疗组大鼠视网膜组织bax和bcl-2表达进行了免疫组织化学分析。
本研究显示,除增殖前期治疗后2周时内网层bax的表达与对照组比较无统计学意义外,其余各组节细胞层和内网层bax表达均较对照组减弱;当病程8周时背景期、增殖前期治疗组bax表达均较增殖期治疗组减弱。说明背景期与增殖前期治疗组相同DR病程状态下节细胞层和内网层bax的表达弱于增殖期治疗组。因此,EPA玻璃体注射8周内,可减弱bax在视网膜的表达抑制DR进展,背景期和增殖前期治疗效果优于增殖期,但机制待探讨。
本研究显示,背景期治疗后2周节细胞层和内网层bcl-2表达较对照组减弱。而前期研究结果发现注射VEGF 2周时bcl-2表达增强,由此可知EPA能下调VEGF引起的bcl-2高表达,可能机制是EPA封闭flk-1受体,阻止VEGF与之结合,抑制DR进展,机体代偿性bcl-2高表达减弱。背景期治疗后4周、增殖前期治疗后2周仅在内网层表达减弱,且背景期疗效更优。说明4周时背景期治疗对bcl-2表达的影响大于增殖前期治疗。增殖前期治疗后6周内网层bcl-2表达亦减弱,而背景期治疗后8周对bcl-2表达无影响,表明EPA体内给药6周时不再减弱bcl-2表达,对保护神经细胞免受损害有益。增殖期治疗后4周时节细胞层和内网层bcl-2表达均减弱。总之,EPA给药6周内,由于抑制DR进展,bcl-2在视网膜的代偿性高表达减弱,此作用8周时消失,bcl-2继续保护神经细胞,但机制待探讨;不仅如此,在8周时bax/bcl-2比值降低,可保护周细胞免缺失。(本文图见封三)
[参考文献]
[1] 董白霞,马景学,叶存喜.增殖型糖尿病性视网膜病变动物模型的建立[J].第三军医大学学报,2012,34(12):1218-1222.
[2] Amato R,Biagioni M,Cammalleri M,et al. VEGF as a survival factor in ex vivo models of early diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2016,57(7)3066-3076.
[3] Suzuki Y,Suzuki K,Kudo T,et al. Level of vascular endothelial growth factor the vitreous fluid of proliferative diabetic retinopathy patients and prognosis after vitrectomy[J]. Ophthalmologica,2016,236(3):133-138.
[4] 董白霞,包永琴,王振东,等.VEGF、flk-1、bax、bcl-2在不同类型DR大鼠模型视网膜组织中表达变化[J].河北医科大学学报,2016,37(11):1289-1293,1365.
[5] 王欢,张含,孙鹏,等.视网膜血管性疾病患者玻璃体液中血管内皮生长因子和肿瘤坏死因子-α的含量测定[J].中华眼底病杂志,2012,28(5):519-521.
[6] 董白霞,叶存喜,包永琴,等.二十碳五烯酸玻璃体注射治疗糖尿病性视网膜病变的实验研究[J].河北医科大学学报,2014,35(10):1148-1151.
[7] Park MH,Kim SY,Moon C,et al. Differential cell death and Bcl-2 expression in the mouse retina after glutathionedecrease by systemic D,L-buthionine sulphoximine administration[J]. Mol Cells,2013,35(3):235-242.
[8] Levkovitch-Verbin H,Waserzoog Y,Vander S,et al. Minocycline mechanism of neuroprotection involves the Bcl-2 gene family in optic nerve transaction[J]. Int J Neurosci,2014,124(10):755-761.
[9] Arend N,Wertheimer C,Laubichler P,et al. Idebenone Prevents Oxidative Stress,Cell Death and Senescence of Retinal Pigment Epithelium Cells by Stabilizing BAX/Bcl-2 Ratio[J]. Ophthalmologica,2015,234(2):73-82.
[10] Wang J,Hou J,Li Q,et al. Expression of Bcl-2 and Bax on retinal with rat model for ocular ischemicsyndrome[J]. Zhonghua Yan Ke Za Zhi,2015,51(12):912-917.
[11] Zeng K,Wang Y,Yang N,et al . Resveratrol inhibits diabetic-induced müller cells apoptosis through microrna-29b/specificity protein 1 pathway[J]. Mol Neurobiol,2017,54(6):4000-4014.
[12] Kim DY,Jung SY,Kim CJ,et al. Treadmill exercise ameliorates apoptotic cell death in the retinas of diabetic rats[J]. Mol Med Rep,2013,7(6):1745-1750.
[13] Hao M,Li Y,Lin W,et al. Estrogen prevents high-glucose-induced damage of retinal ganglion cells viamitochondrial pathway[J]. Graefes Arch Clin Exp Ophthalmol,2015,253(1):83-90.
[14] Drel VR,Pacher P,Ali TK,et al. Aldose reductase inhibitor fidarestat counteracts diabetes-associated cataractformation,retinal oxidative-nitrosative stress,glial activation,and apoptosis[J]. Int J Mol Med,2008,21(6):667-676.
[15] Wu M,Yang S,Elliott MH,et al . Oxidative and endoplasmic reticulum stresses mediate apoptosis induced by modified ldl in human retinal Müller cells[J]. Invest Ophthalmol Vis Sci,2012,53(8):4595-4604.
[16] Han N,Yu L,Song Z,et al. Agmatine protects Müller cells from high-concentration glucose-induced cell damage via N-methyl-D-aspartic acid receptor inhibition[J]. Mol Med Rep,2015,12(1):1098-1106.
[17] Shin ES,Huang Q,Gurel Z,et al. STAT1-mediated Bim expression promotes the apoptosis of retinal pericytes under high glucose conditions[J]. Cell Death Dis,2014,5:e986.
[18] Cai J,Ahmad S,Jiang WG,et al. Activation of vascular endothelial growth factor receptor-1 sustains angiogenesis and bcl-2 expression via the phosphatidylinositol 3-kinase pathway in endothelial cells[J]. Diabetes,2003,52(12):2959-2968.