近年来,脑转移瘤的发病率呈增长趋势。脑转移瘤是指源自于中枢神经系统以外发生的原发癌,其肿瘤细胞转移到颅内的一种常见恶性肿瘤,占脑瘤的10%~15%[1]。癌症患者有20%~40%发生脑转移[2]。脑转移瘤是恶性肿瘤的晚期表现,预后极差,患者如果不进行有效治疗,生存期仅为1个月[3],死亡原因大多是因为颅内转移瘤的进行性发展[4]。虽然关于全脑放疗的理想剂量分割模式仍存在争议,但是全脑放疗是以往治疗脑转移瘤的标准治疗方式。目前大多数学者认为2周内给予10×3 GY照射是标准的剂量分割方式[5]。研究证明短程放疗(如10×1 GY、2×6 GY、5×4 GY)与标准放疗模式的总生存率差异无统计学意义[6]。分次立体定向放疗(fractionted steretactic radiotherapy,FSRT)的出现为临床治疗脑转移瘤提供了一种有效选择。本研究将106例脑转移瘤患者分为标准全脑放疗组和FSRT联合短程全脑放疗组(FSRT联合放疗组)进行对比分析。
1 资 料 与 方 法
1.1一般资料 选择2004年6月—2013年7月哈励逊国际和平医院收治的脑转移瘤患者106例,均符合以下条件:原发肿瘤全部经病理证实;经MRI证实的脑转移瘤;颅内转移灶未经手术、放疗。随机分为2组。标准全脑放疗组53例,男性24例,女性29例,年龄37~77岁,平均(58.49±10.27)岁;原发肿瘤:肺癌38例,乳腺癌6例,消化道肿瘤3例,其他肿瘤6例。FSRT联合放疗组53例,男性25例,女性28例,年龄37~74岁,平均(57.40±9.99)岁;原发肿瘤:肺癌39例,乳腺癌5例,消化道肿瘤4例,其他肿瘤5例。2组临床资料差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法 标准全脑放疗组给予10×3 GY治疗,2周内完成。FSRT联合放疗组:首先制作FSRT治疗头罩并将患者头置其中,之后与适配器连接于CT扫描床,同时基准环连接定位板,以3 mm层厚进行连续扫描,将定位信息传输到TPS工作站,参考MRI确定靶区为CT增强区及其周围2~5 mm区域;将各层CT图像依次输入三维治疗计划系统(每一个层面由临床医师勾画靶区及其周围重要结构),勾画CT所示肿瘤范围并且确定为肿瘤区(gross target volume,GTV);计划靶区(planning target volume,PTV)根据GTV相应层面外扩展5~8 mm确定;设计4~7个共面或非共面野,每个照射野用不规则形状低熔点铅挡或多叶光栅动态适形,通过计算机三维图像重建成像,按剂量—体积直方图优化治疗方案,靶区在90%等剂量曲线内,取80%以上的等剂量线覆盖PTV,并以此作为处方剂量;肿瘤周围正常组织均在正常耐受量下;经过临床医师满意确认无误后存档,患者接受放疗,先给予5×4 GY短程放疗,1周内完成,然后给予FSRT治疗,40%~60%等剂量曲线包绕PTV,3 GY/次,隔日1次,3次/周,共4~5次,边缘剂量12~15 GY,中心剂量20~30 GY。放疗期间患者容易出现脑水肿,均接受甘露醇、地塞米松等脱水对症治疗。按放疗结束之日起计算中位生存期及1年生存期,并且对潜在的预后因素进行评估。
1.3观察指标 对比2组症状和体征缓解率、有效率、局部控制率、生存率及治疗费用。
1.4评价标准 ①随访:随访期1~2年,以门诊复查CT/MRI结果及患者症状、体征进行评估。②局部控制及有效率:治疗后1~3个月复查CT/MRI,以后3~6个月复查1次[7],按照WHO推荐的实体瘤客观疗效评价标准,病变持续4周以上完全消失为完全缓解(complete response,CR),病变缩小50%并且至少维持4周以上为部分缓解(partial reasonse,PR),肿瘤缩小50%或增大不超过25%为无变化(no change,NC),一个或多个病变增大25%以上或出现新病变为进展(prograssive disease,PD);缓解率(response rate,RR)=(CR+PR)例数×100%。③中位生存时间。④放疗不良反应:观察白细胞、血小板、局部皮肤变化及脑水肿、脑坏死等。
1.5统计学方法 应用SPSS 19.0统计软件分析数据,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
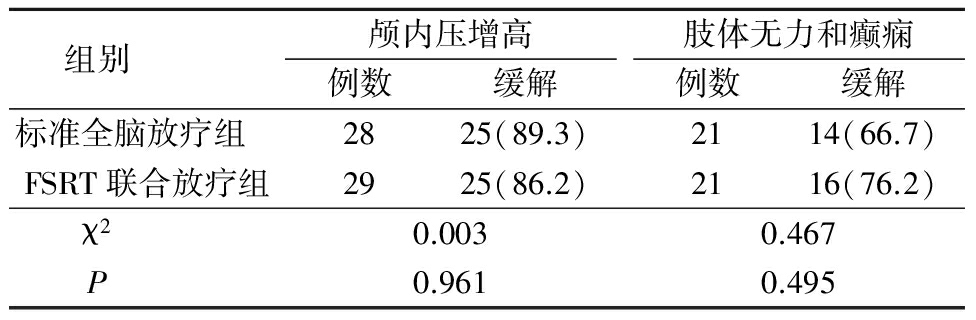
2.12组症状和体征缓解率比较 标准全脑放疗组和FSRT联合放疗组分别有28例和29例患者放疗前有不同程度头痛、头晕、恶心及呕吐等颅内压增高症状,放疗期间给予甘露醇、地塞米松或甲强龙对症治疗, 2组颅内压增高症状明显改善或消失,2组颅内压增高缓解率差异无统计学意义(P>0.05);2组分别有21例患者有肢体无力和间断性癫痫发作,对症治疗后其缓解率差异无统计学意义(P>0.05)。见表1。
表1 2组症状和体征缓解率比较(例数,%)
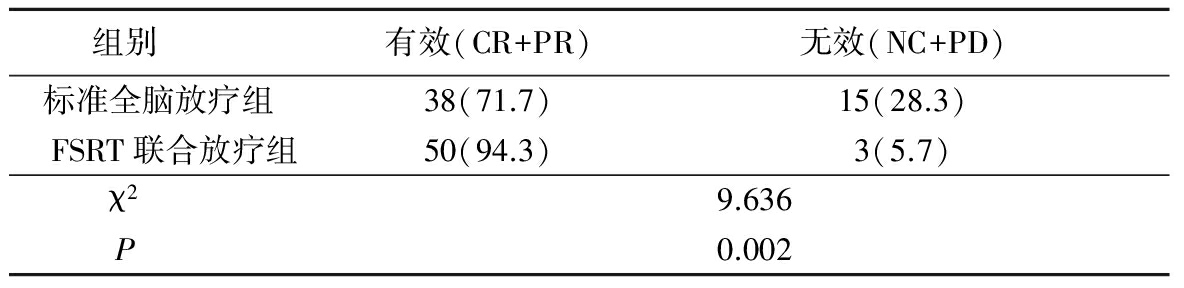
2.22组有效率比较 疗程结束后FSRT联合放疗组临床有效率优于标准全脑放疗组,差异有统计学意义 (P<0.05),见表2。
表2 2组临床有效率比较(n=53,例数,%)
2.32组局部控制率比较 2组KPS评分升高比例数和转移瘤减少比例差异无统计学意义(P>0.05);FSRT联合放疗组转移瘤直径缩小比例大于标准全脑放疗组,差异有统计学意义(P<0.05)。见表3。
表3 2组局部控制率比较

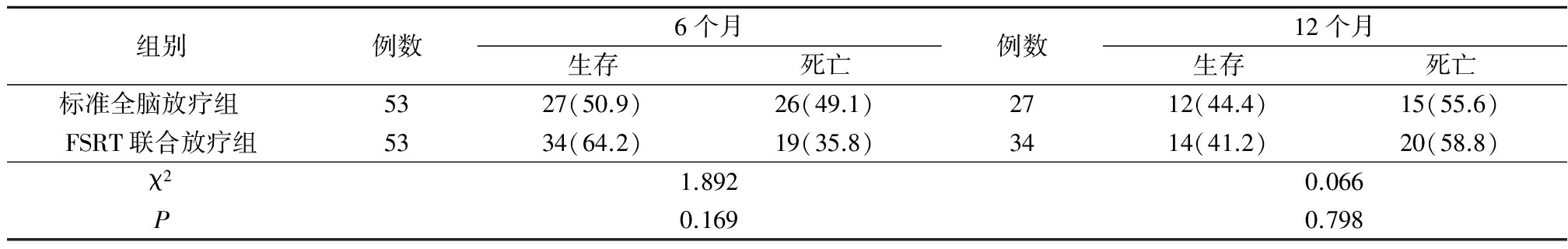
2.42组生存率比较 2组6个月和12个月生存率差异均无统计学意义(P>0.05),见表4。
2.52组治疗费用比较 标准全脑放疗组治疗费用平均(20 641.0±238.7)元, FSRT联合放疗组治疗费用平均(10 251.0±146.4)元,FSRT联合放疗组治疗费用明显低于标准全脑放疗组,差异有统计学意义(t=37.100,P<0.01)。
表4 2组6个月和12个月生存率比较(例数,%)
3 讨 论
恶性肿瘤晚期一旦出现脑转移瘤,未经治疗者中位生存期短,预后极差。无论原发病灶控制如何,脑转移瘤均成为严重威胁患者的致命因素,故在控制原发病灶的同时,积极控制颅内转移灶有利于提高脑转移瘤的局部控制率及总生存率。脑转移瘤是是成人最为常见的颅内肿瘤,其与颅内原发性脑肿瘤比例约为10∶1。肺癌、结直肠癌、黑色素瘤、肾癌及乳腺癌患者中有8.5%~9.6%会发生脑转移,具体到肿瘤的种类,肺癌脑转移发生率最高,为16.3%~19.9%, 且转移时间最短,从诊断原发灶到发现脑转移灶的平均时间为6~9个月[2]。 对于那些发生脑转移瘤的Ⅳ期肺癌患者,目前所能采取的治疗方法为姑息性治疗,治疗的主要目的为延长生存期,并不能根治。因此,研究有明确治疗效果并且可以改善患者生存质量的治疗方法是十分迫切和必要的[2]。小细胞肺癌已被证实对放疗敏感,而非小细胞肺癌脑转移瘤的治疗最为复杂[7-8]。治疗脑转移瘤的主要目的是为了消灭脑转移瘤的肿瘤细胞,大脑中存在血脑屏障,其会影响化疗药物的作用,而放疗不会受限制。另外,脑转移肿瘤细胞有丝分裂频率远高于周围脑细胞,故对放疗较为敏感。全脑放疗治疗脑转移瘤的历史悠久,大量研究结论认为全脑放疗可使50%患者改善症状,治疗后存活1~6个月,平均存活3个月。全脑放疗的不良反应有脱发、疲乏、厌食、恶心呕吐、闭经、听力丧失、亚急性脱髓鞘综合征、急性放射性脑病、放射性脑坏死、视神经萎缩、继发性脑卒、进行性痴呆、步态失调和大小便失禁等。全脑放疗疗程长,可能会延误原发癌治疗,而增加总剂量和分次照射的剂量并不能提高疗效,相反会增加不良反应,难于达到满意治疗效果[9-10]。目前,治疗脑转移瘤较为理想的模式是外科切除或立体定向放疗结合全脑放疗。FSRT是近年新发展起来的放疗技术,在保持立体定向放疗精确照射优点的同时采用分次照射, 这种方法更加符合肿瘤放射生物学特点,并尽可能保护正常组织,从而提高治疗增益比。自上世纪50年代以来,全脑放疗一直被认为是脑转移瘤的标准治疗手段,但其分割剂量方式仍存在争议。因此,本研究对比了全脑放疗与FSRT临床疗效的不同。在进行放疗时,等效生物剂量杀死肿瘤细胞需要的剂量是23.3 GY(5×4 CY)和32.5 GY(10×3 GY)、40 CY(20×2 CY),据此一般认为标准全脑放疗的预期治疗效果优于短程全脑放疗。在5×4 GY和10×3 GY放疗总生存率单因素分析中似乎短程更有意义,而多因素分析中其差异无统计学意义[11]。国外对442例不分年龄超3个脑转移患者的研究中,总生存率与局控率差异无统计学意义[12]。在进行单次立体定向放射治疗时病变体积大小限制所给放疗剂量,病变体积大就必须减量,而同样性质体积不同的病变,要想得到相同的肿瘤控制率,体积越大所应给予的剂量就越多,单次立体定向放疗没有办法解决这个矛盾,立体定向放疗的剂量和分次数必须依据肿瘤体积大小确定应成为以后脑转移瘤治疗中研究的重要方面,而近年来分次立体定向的不断完善和发展,为此理论研究提供了方向。有研究报道采用FSRT治疗恶性胶质瘤时总量24~35 GY,3~3.5 GY/次,没有发生Ⅲ级毒性反应以及因毒性反应需再次手术者[13-15]。
综上所述,脑转移瘤患者治疗时应根据患者的全身状况、原发灶、其他转移灶控制情况以及脑转移灶的大小、数量、部位等综合考虑,且此类患者大多体质差、预后不良,治疗原则应以延长患者生存期、提高其生活质量为主。本研究显示标准全脑放疗组和FSRT联合放疗组有效率均分别为71.7%、94.3%,疗程结束后FSRT联合放疗组临床有效率优于标准全脑放疗组, FSRT联合放疗组转移瘤缩小比例大于标准全脑放疗组, FSRT联合放疗组治疗费用较标准全脑放疗组明显下降,差异均有统计学意义(P<0.05)。本研究在不增加患者放射性损伤,不降低患者局控率及远期生存率的情况下,缩短了其治疗时间和成本,有效地提高了患者的生存质量,为其后续的治疗争取了宝贵的时机。表明FSRT联合短程全脑放疗是治疗脑转移瘤的一种安全、有效的治疗模式。
[参考文献]
[1] Mashimo T,Pichumani K,Vemireddy V,et al. Acetate is a bioenergetic substrate for human glioblastoma and brain metastases[J]. Cell,2014,159(7):1603-1614.
[2] Bertolini F,Spallanzani A,Fontana A.Brain metastases: an overview[J]. CNS Oncol,2015,4(1):37-46.
[3] Luo J,Zhu H,Tang Y,et al. Analysis of prognostic factors and comparison of prognostic index scores in patients with brain metastases after whole-brain radiotherap[J].Int J Clin Exp Med,2014,7(12):5217-5225.
[4] 王忠诚.神经外科学[M].2版.武汉:湖北科学技术出版社,1998:568-570
[5] Bentzen SM,Dörr W,Gahbauer R,et al. Bioeffect modeling and equieffective dose concepts in radiation oncology-- terminology,quantities and unit[J]. Radiother Oncol,2012,105(2):266-268.
[6] Varlotto JM,Yao AN,DeCamp MM,et al. Nodal stage of surgically resected non-small cell lung cancer and its effect on recurrence patterns and overall survival[J]. Int J Radiat Oncol Biol Phys,2015,91(4):765-773.
[7] Mak KS,Gainor JF,Niemierko A,et al. Significance of targeted therapy and genetic alterations in EGFR,ALK,or KRAS on survival in patients with non-small cell lung cancer treated with radiotherapy for brain metastases[J]. Neuro Oncol,2015,17(2):296-302.
[8] Fernandes AT,Mitra N,Xanthopoulos E,et al. The impact of extent and location of mediastinal lymph node involvement on survival in Stage Ⅲ non-small cell lung cancer patients treated with definitive radiotherapy[J]. Int J Radiat Oncol Biol Phys,2012,83(1):340-347.
[9] Liu WT,Huang CY,Lu IC,et al. Inhibition of glioma growth by minocycline is mediated through endoplasmic reticulum stress-induced apoptosis and autophagic cell death[J]. Neuro Oncol,2013,15(9):1127-1141.
[10] Santos T,Fang X,Chen MT,et al. Sequential administration of carbon nanotubes and near-infrared radiation for the treatment of gliomas[J]. Front Oncol,2014,4:180.
[11] Nieder C,Spanne O,Haukland E,et al. Does time between imaging diagnosis and initiation of radiotherapy impact survival after whole-brain radiotherapy for brain metastases?[J]. ISRN Oncol,2013,2013:214304.
[12] Le Rhun É,Dhermain F,Noel G,et al. ANOCEF guidelines for the management of brain metastases[J]. Cancer Radiother,2015,19(1):66-71.
[13] Back M,Gzell CE,Kastelan M,et al. Large volume re-irradiation with bevacizumab is a feasible salvage option for patients with refractory high-grade glioma[J]. Neurooncol Pract,2015,2(1):48-53.
[14] Sminia P,Mayer R. External beam radiotherapy of recurrent glioma: radiation tolerance of the human brain[J]. Cancers,2012,4(2):379-399.
[15] Hosogoe S,Soma O,Matsumoto T,et al. Salvage brachytherapy for castration-resistant and external beam radiotherapy-resistant local recurrence 17 years after radical prostatectomy[J]. Case Rep Urol,2015,2015:1-3.