乳腺癌是女性最常见的恶性肿瘤之一,严重威胁女性的生命和健康,且近年来呈现年轻化、非肥胖人群高发趋势,愈来愈引起人们的关注[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)被认为可能是最具代表性的促血管生成因子,与很多肿瘤的诊断和治疗关系密切,其中包括乳腺癌[2]。VEGF的表达可刺激内皮细胞增殖、促进新生血管生成、提高血管通透性从而增加肿瘤发生的风险[3]。本研究应用酶联免疫吸附测定法定量检测乳腺癌患者血清VEGF的表达水平,分析其与临床因素的关系,探讨血清VEGF在乳腺癌发生发展中的作用,旨在为乳腺癌的早期诊断、靶向治疗和预后评估提供理论依据。
1 资 料 与 方 法
1.1一般资料 收集2016年9月—2017年6月于承德医学院附属医院乳腺外科进行诊治的乳腺癌患者146例。纳入标准:①患者均为女性;②明确乳腺癌诊断;③接受乳腺癌手术治疗;④术前均无放化疗及内分泌治疗史;⑤患者临床病理资料完整;⑥无其他肿瘤疾病病史;⑦术前均完成血清VEGF检测;⑧取得患者知情同意。患者年龄30~79岁,平均(51.84±10.22)岁;TNM分期按照美国癌症联合委员会和国际抗癌联盟标准:Ⅰ期59例,Ⅱ期81例,Ⅲ期6例。另外选取同期乳腺良性疾病患者30例作为对照,年龄27~66岁,平均(48.07±9.20)岁。2组年龄差异无统计学意义(P>0.05),具有可比性。
1.2方法 试验组均于术前24 h清晨空腹抽取外周静脉血5 mL,对照组于入院后24 h内清晨空腹抽取静脉血5 mL,血液标本静置2 h后,以3 000 r/min离心5 min,取上清液。采用酶联免疫吸附测定法定量检测血清VEGF表达水平。以下临床因素包括年龄、组织学分级、TNM分期、人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阴性或阳性、雌激素受体阴性或阳性、孕激素受体阴性或阳性等直接从临床病历及病理报告中收集,由具有资质的病理医师完成病理取材与制片,由病理科副主任医师以上级别完成病理阅片,病理报告最终由病理科主任医师审核。
1.3统计学方法 应用SPSS 24.0统计学软件分析数据。非正态分布的计量资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.12组血清VEGF表达情况 乳腺癌患者血清VEGF表达水平明显高于乳腺良性疾病患者,差异有统计学意义(P<0.05),见表1。
表1 血清VEGF在乳腺良恶性疾病患者中的表达
Table1Expression of serum VEGF in patients with benignand malignant breast diseases[M(Q1,Q3), ng/L]
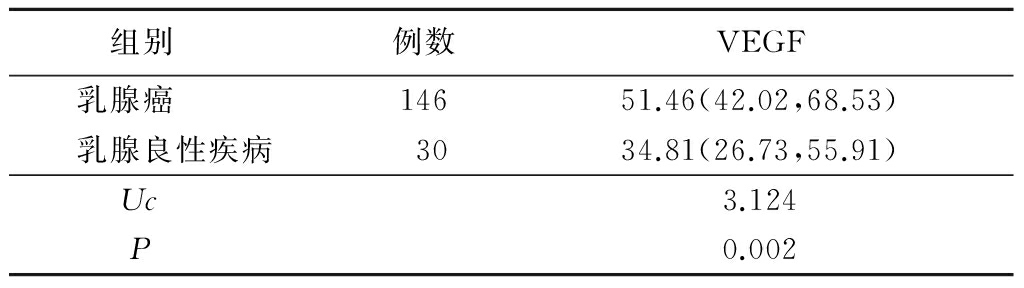
2.2不同临床因素患者血清VEGF表达水平比较 患者组织学分级越高,TNM分期越晚,HER2阳性状态,血清中VEGF的表达水平越高,差异有统计学意义(P<0.05);不同年龄、雌激素受体、孕激素受体乳腺癌患者血清VEGF的表达水平差异无统计学意义(P>0.05)。见表2。
表2 不同临床因素患者血清VEGF表达水平比较
Table2The comparison of serum VEGF expression inpatients with different clinical factors[M(Q1,Q3), ng/L]
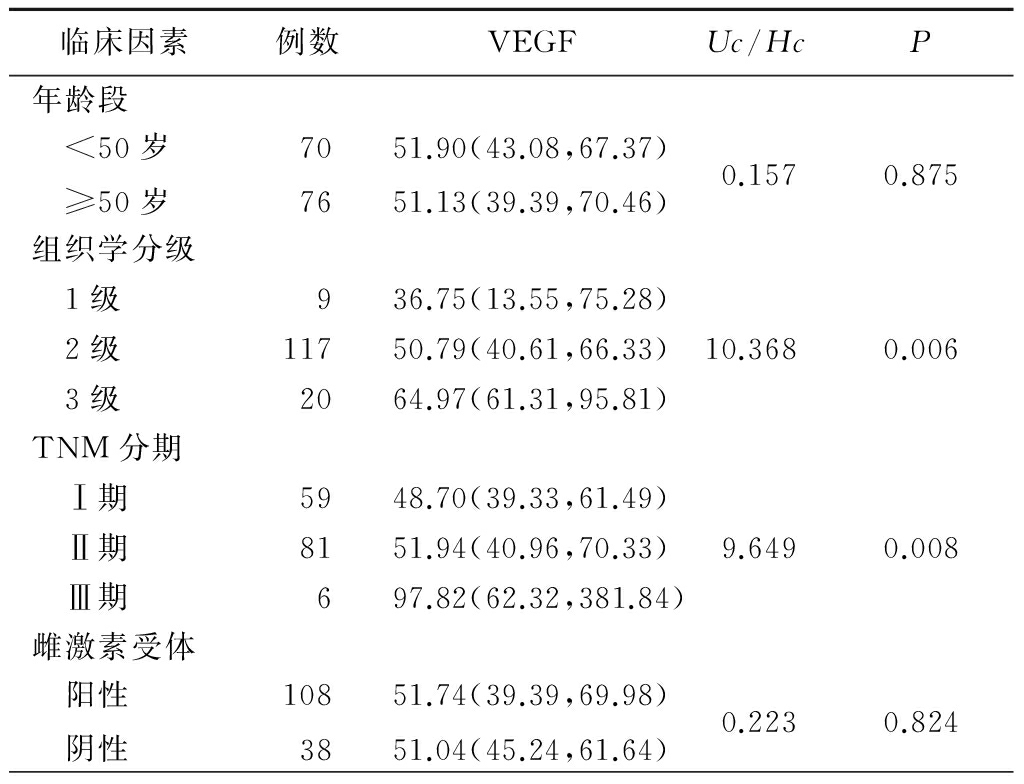
表2(续)

3 讨 论
乳腺癌是全球女性中最常见的癌症之一[4]。寻找可用于早期诊断、靶向治疗和预后评估的生物标志物,成为当前乳腺癌研究中的热点。
VEGF是刺激肿瘤血管生成的最重要的分子之一,VEGF在不同类型的癌症如乳腺癌、脑癌、肺癌、泌尿系统肿瘤和胃肠道肿瘤中均有表达[5]。在乳腺肿瘤中,VEGF被人乳腺癌细胞释放并结合VEGF受体,引起内皮细胞的增殖、生长、存活和迁移[6]。研究显示除VEGF外,VEGF家族还包括VEGF-B、VEGF-C、VEGF-D、VEGF-E以及胎盘生长因子[7]。VEGF通过与其相应的受体结合直接刺激内皮细胞增殖,介导血管的生成,并且可提高血管的通透性从而为肿瘤细胞的侵袭及转移提供合适的基础[8]。VEGF的表达受不同因素的影响,Dore-Savard等[9]研究显示缺氧可诱导VEGF的高表达,另外,癌基因、一氧化氮等也可调控VEGF的表达水平。有学者认为,VEGF不仅可以由肿瘤细胞自身分泌产生,还可能促进乳腺肿瘤干细胞的自我更新[10]。
国内外对于VEGF与乳腺癌相关性的研究大多通过免疫组织化学法对组织VEGF进行检测,且结论大部分一致,均提示VEGF在乳腺癌组织中存在高表达,与临床分期、组织学分级以及淋巴结转移密切相关;而检测血清中VEGF表达的研究相对较少,且结论不一致。本研究检测乳腺癌患者血清VEGF的表达水平,分析其与临床病理因素的关系,旨在为乳腺癌的诊断、治疗和预后评估提供理论依据。
有研究显示,与健康对照组相比,早期乳腺癌患者血清VEGF表达水平升高[11]。有学者通过对547例未行辅助治疗且淋巴结阴性的乳腺癌患者进行研究,发现血清VEGF是乳腺癌的独立预后因素。研究表明乳腺癌患者血清中VEGF浓度升高,且高浓度的VEGF及其可溶性受体与临床分期呈正相关[12]。有学者认为乳腺癌血清VEGF的表达水平越高,其在体内侵袭和转移的能力越强,可作为评估乳腺癌有无转移及评价预后的有效指标[13-15]。陈鑫[16]研究发现,乳腺癌患者血清中VEGF的表达水平明显高于健康女性,并且临床分期越高,肿瘤直径越大,有淋巴结转移,血清VEGF的表达水平越高,差异有统计学意义(P<0.05),但是在浸润性导管癌、导管内癌和浸润性小叶癌3种类型中血清VEGF的表达差异无统计学意义(P>0.05)。本研究共纳入146例乳腺癌患者,通过酶联免疫吸附测定法定量检测血清VEGF的表达水平,结果显示与乳腺良性疾病患者相比,乳腺癌患者血清VEGF表达水平显著升高(P<0.05);在TNM分期方面,Ⅲ期乳腺癌患者血清VEGF表达水平显著高于Ⅰ期、Ⅱ期患者(P<0.05);在组织学分级方面,3级乳腺癌患者血清VEGF表达水平明显高于1级和2级患者(P<0.05)。本研究结果与以上报道结论相符。
体外实验已经证实,HER2可引起VEGF及其蛋白水平的增加,抑制HER2的药物可降低VEGF的表达水平。而2012年公布的一项报告显示,早期乳腺癌患者血清中VEGF表达与HER2阳性或阴性无关[17]。本研究结果显示,HER2阳性乳腺癌患者其血清VEGF表达水平明显高于阴性患者(P<0.05)。与上述报道不符。
在过去的几年中, HER2信号通路与VEGF之间的关系已由以下几个方面的证据得到证实:①HER-2通过激活mTOR/p70S6K途径增加VEGF蛋白的合成,从而导致乳腺癌细胞的血管生成和转移[18];②VEGF的表达与乳腺癌中HER-2的表达呈正相关;③HER-2信号转导增加缺氧诱导因子1α的合成速率,后者又可介导VEGF的表达[19];④HER-2信号通过不同途径调节促血管生成因子和抗血管生成因子之间的平衡。基于这些理论基础以及本研究结果,更有力地说明了HER-2与VEGF两者具有协同作用,共同促进肿瘤新生血管生成,并且HER-2的过表达可提高VEGF的表达水平。
此外,临床研究证实VEGF及其蛋白的表达水平受到雌激素、孕激素的影响,血清VEGF的表达与雌激素、孕激素呈负相关[20]。还有学者报道,在三阴性乳腺癌患者中,血清VEGF的浓度显著升高[21]。而本研究结果显示,不同雌激素受体、孕激素受体表达乳腺癌患者血清VEGF的表达水平差异无统计学意义(P>0.05)。与上述报道不符。
在乳腺癌中VEGF的高表达成为有吸引力的治疗靶点。全球第一个针对VEGF靶点的药物贝伐珠单抗于2004年2月经美国FDA批准应用于临床,但因其严重的不良反应于2011年11月被美国FDA撤销了其用于乳腺癌治疗的适应证。雷莫卢单抗是针对VEGF的单克隆抗体,多个临床试验已证实其对胃癌和直结肠癌患者有效。但有研究表明其在针对转移性乳腺癌患者的治疗过程中,临床意义较小[22]。其他药物如索拉菲尼、舒尼替尼尚需更多的临床研究证实其临床意义[23-24]。此外,联合抑制HER2和VEGF通路可能增加乳腺癌疗效[25]。
HER-2阳性与血管生成的相关性在许多临床试验中得到了广泛的应用,曲妥珠单抗、贝伐珠单抗和拉帕替尼的各种组合已显示出明显的疗效,针对抗HER-2和VEGF的双靶向药物治疗可能会克服抗HER-2单药治疗的耐药性[26]。但是在一项Ⅲ期临床试验中发现,贝伐珠单抗、多西紫杉醇和曲妥珠单抗联合用药未能改善局部复发或转移乳腺癌患者的无疾病进展生存期[27]。国外一项临床试验中,基于HER-2与帕妥珠单抗和VEGF与VEGF受体的结合设计和合成肽,在小鼠体内和体外用HER-2和VEGF肽模拟物进行单一或联合治疗,结果显示2种肽联合应用时肿瘤细胞的存活率降至25%,而单一治疗时存活率可达70%,单一治疗组与联合治疗组差异有统计学意义(P<0.01)。表明联合治疗可诱导强有力的抗肿瘤和抗血管反应,相对于两者单独治疗而言,可产生更大的功效。Nasir等[28]研究了164例原发性乳腺癌患者的临床分子亚型,发现HER-2阳性乳腺癌患者VEGF蛋白在肿瘤间质血管中的表达显著高于激素受体阳性患者和三阴性乳腺癌患者,与HER-2阴性者相比,VEGF蛋白的表达呈现较高水平。一项回顾性研究分析了298例接受辅助治疗的高危早期乳腺癌患者肿瘤组织中的RNA,结果显示VEGF和VEGF受体mRNA的过表达对患者预后具有重要价值,主要取决于HER-2基因的状态[29]。
综上所述,VEGF与乳腺癌的发生发展关系密切,血清VEGF可为乳腺癌的早期诊断、靶向治疗和预后评估提供重要的理论依据。血清VEGF的检测方法较标本组织中VEGF的检测方法更简单、快捷,临床更易于应用和推广。而VEGF与HER-2的密切关系使得靶向抗HER-2和VEGF的联合治疗成为防治乳腺癌的一个新领域,这是一个巨大的挑战,但肯定是未来可以实现的目标,必将使广大乳腺癌患者受益。本研究由于样本量较少,尚有待于开展大样本前瞻性临床研究。
[参考文献]
[1] Strasser-Weippl K,Horick N,Smith IE,et al. Identification of early breast cancer patient cohorts who may benefit from lapatinib therapy[J]. Eur J Cancer,2016,56:85-92.
[2] Zhang L,Wang H,Li C,et al. VEGF-A/Neuropilin 1 Pathway Confers Cancer Stemness via Activating Wnt/β-Catenin Axis in Breast Cancer Cells[J]. Cell Physiol Biochem,2017,44(3):1251-1262.
[3] Chen Y,Liu Y,Wang Y,et al. Quantification of STAT3 and VEGF expression for molecular diagnosis of lymph node metastasis in breast cancer[J]. Medicine (Baltimore),2017,96(45):e8488.
[4] Edwards SL,Poongavanam V,Kanwar JR,et al. Targeting VEGF with LNA-stabilized G-rich oligonucleotide for efficient breast cancer inhibition[J]. Chem Commun(Camb),2015,51(46):9499-9502.
[5] Holzer TR,Fulford AD,Nedderman DM,et al. Tumor cell expression of vascular endothelial growth factor receptor 2 is an adverse prognostic factor in patients with squamous cell carcinoma of the lung[J]. PLoS One,2013,8(11):e80292.
[6] Li H,Chen K,Su F,et al. Preoperative CA 15-3 levels predict the prognosis of nonmetastatic luminal A breast cancer[J]. J Surg Res,2014,189(1):48-56.
[7] Soukup V, apoun O,Pe
apoun O,Pe l M,et al. Placental growth factor in bladder cancer compared to the diagnostic accuracy and prognostic performance of vascular endothelial growth factor A[J]. Anticancer Res,2018,38(1):239-246.
l M,et al. Placental growth factor in bladder cancer compared to the diagnostic accuracy and prognostic performance of vascular endothelial growth factor A[J]. Anticancer Res,2018,38(1):239-246.
[8] Wu M,Xiong H,Yan X,et al. Association between VEGF-A and VEGFR-2 polymorphisms and response to treatment of neovascular AMD with anti-VEGF agents:a meta-analysis[J]. Br J Ophthalmol,2016,101(7):976-984.
[9] Dore-Savard L,Lee E,Kakkad S,et al. The Angiogenic Secretome in VEGF overexpressing Breast Cancer Xenografts[J]. Sci Rep,2016,6:39460.
[10] Zhao D,Pan C,Sun J,et al. VEGF drives cancer-initiating stem cells through VEGFR-2/Stat3 signaling to upregulate Myc and Sox2[J]. Oncogene,2015,34(24):3107-3119.
[11] 张占东,戚辉,杨超,等.乳腺癌围术期血清血管内皮生长因子-C的变化及其临床意义[J].实用临床医药杂志,2015,19(7):147-148.
[12] Thielemann A,Baszczuk A,Kopczyński Z,et al. Clinical usefulness of assessing VEGF and soluble receptors sVEGFR-1 and sVEGFR-2 in women with breast cancer[J]. Ann Agric Environ Med,2013,20(2):293-297.
[13] Ciobanu M,Eremia IA,Cräitoiu S,et al. Lymphatic microvessels density,VEGF-C,and VEGFR-3 expression in 25 cases of breast invasive lobular carcinoma [J]. Rom J Morphol Em bryol,2013,54(4):925-934.
[14] 沈恒山,胡健伟,周敏,等.血管内皮生长因子在乳腺癌患者中表达的临床意义[J].中国血液流变学杂志,2016,26(1):17-19.
[15] 刘平贤,门琤,郭满.乳腺癌患者血清VEGF、PRL、HER2、TPS、sCD40L及MVD与复发转移的相关性研究[J].中国妇幼保健,2015,30(9):1377-1379.
[16] 陈鑫.乳腺癌患者血清中血管内皮细胞生长因子和碱性成纤维细胞生长因子的表达情况[J].中国妇幼保健,2016,31(12):2460-2462.
[17] Dalamaga M. Nicotinamide phosphoribosyl-transferase/visfatin:a missing link between overweight/obesity and postmenopausal breast cancer? Potential preventive and therapeutic perspectives and challenges[J]. Med Hypotheses,2012,79(5):617-621.
[18] Wang J,Li G,Wang Y,et al. Suppression of tumor angiogenesis by metformin treatment via a mechanism linked to targeting of HER2/HIF-1α/VEGF secretion axis[J]. Oncotarget,2015,6(42):44579-44592.
[19] Aghazadeh S,Yazdanparast R. Activation of STAT3/HIF-1α/Hes-1 axis promotes trastuzumab resistance in HER2- overexpressing breast cancer cells via down-regulation of PTEN[J]. Biochim Biophy Acta,2017,1861(8):1970-1980.
[20] 张玉洲,赵芳,徐高磊,等.ER、PR、Her-2与VEGF在乳腺癌组织中的表达及其相互关系的研究进展[J].医学研究杂志,2015,44(2):28-31.
[21] 杨艳芳,刘君,姜战胜,等.VEGF在三阴性乳腺癌中的表达及临床意义[J].中国肿瘤临床,2012,39(8):439-442.
[22] Mackey JR,Ramosvazquez M,Lipatov O,et al. Primary results of ROSE/TRIO-12,a randomized placebo-controlled phase Ⅲ trial evaluating the addition of ramucirumab to first-line docetaxel chemotherapy in metastatic breast cancer [J]. J Clini Oncol,2015,33(2):141-148.
[23] 仲维兰,鲁美钰,司春枫,等.乳腺癌靶向治疗研究进展[J].现代肿瘤医学,2018,26(4):622-626.
[24] 王博,王敏,李俊海.VEGF在三阴性乳腺癌中的表达以及作为治疗靶点的研究进展[J].当代医学,2017,23(14):196-198.
[25] Zhu Y,Guo M,Zhang L,et al. Biomarker triplet NAMPT/VEGF/HER2 as a de novo detection panel for the diagnosis and prognosis of human breast cancer[J]. Oncol Rep,2016,35(1):454-462.
[26] Baselga J,Bradbury I,Eidtmann H,et al. Lapatinib with trastuzumab for HER2-positive early breast cancer(NeoALTTO):a randomised,open-label,multicentre,phase 3 trial[J]. Lancet,2012,379(9816):633-640.
[27] Gianni L,Romieu GH,Lichinitser M,et al. AVEREL:a randomized phase III Trial evaluating bevacizumab in combination with docetaxel and trastuzumab as first-line therapy for HER2-positive locally recurrent/metastatic breast cancer[J]. J Clin Oncol,2013,31(14):1719-1725.
[28] Nasir A,Holzer TR,Chen M,et al. Differential expression of VEGFR2 protein in HER2 positive primary human breast cancer:potential relevance to anti-angiogenic therapies[J]. Cancer Cell Int,2017,17:56.
[29] Linardou H,Kalogeras KT,Kronenwett R,et al. Prognostic significance of VEGFC and VEGFR1 mRNA expression according to HER2 status in breast cancer:a study of primary tumors from patients with high-risk early breast cancer participating in a randomized hellenic cooperative oncology group trial[J]. Anticancer Res,2015,35(7):4023-4036.