在体外受精(in vitro fertilization,IVF)过程中,准确判断卵母细胞的成熟对于受精、胚胎发育、妊娠建立以及胎儿发育非常重要。目前主要采用形态学参数评估卵母细胞成熟及胚胎质量,如卵子直径、卵丘扩张程度、胚胎细胞个数及胚胎碎片率等。然而,这些形态学检查方法缺乏客观性及准确性。卵母细胞与周围颗粒细胞处于一个卵泡微环境中,与颗粒细胞、卵丘细胞间以及卵丘颗粒细胞和壁层颗粒细胞间均存在着广泛的缝隙连接,相互进行信息交流,构成了一个统一的整体[1-3]。卵母细胞与颗粒细胞之间有密切的关系,颗粒细胞通过自分泌、旁分泌、信号转导以及营养物质传递等方式影响卵母细胞的发育、成熟及受精,甚至影响所形成胚胎的早期发育状态[4-5]。因此,颗粒细胞在评估卵母细胞质量中的作用受到广泛的关注。在评估卵母细胞质量的多种方法中,颗粒细胞拥有取材方便、检测快速、无损伤性、实用性强等特点,是较为理想的评估卵母细胞质量的指标。骨形态发生蛋白9(bone morphogenetic protein-9,BMP-9)是转化生长因子β超家族的成员[6]。BMP-9是BMPs中的一种,有大鼠相关研究显示,BMP-9可能来源于血清和颗粒细胞;BMP-9可以显著降低颗粒细胞卵泡刺激素(follicle-stimulating hormone,FSH)诱导的孕酮(progesterone,P)的分泌,但对FSH诱导的雌二醇(estradiol,E2)的分泌无作用;经BMP-9处理后,FSH诱导的腺苷-3′,5′-环化一磷酸(Cyclic adenosine monophosphate,cAMP)的合成和FSH诱导的类固醇因子mRNA的表达被抑制[7-8]。Herrera等[9]研究显示,约25%上皮性卵巢癌发现BMP-9表达,而在正常人群卵巢上皮细胞中无表达;BMP-9对永生化人类卵巢表面上皮细胞和上皮性卵巢癌细胞起增殖因子的作用;一些卵巢癌细胞系已经获得增殖所需的自分泌BMP-9信号传导[7]。这些研究表明BMP-9可能参与生殖功能的调节。然而,BMP-9对卵巢卵泡发育的作用还有待阐明。本研究通过检测人卵巢颗粒细胞中BMP-9的表达,探讨其与卵母细胞成熟的关系,旨在为评估卵母细胞质量提供新的依据。
1 资 料 与 方 法
1.1一般资料 选择2016年10—12月于河北医科大学第四医院生殖医学科接受常规IVF-ET、采用长方案控制性促排卵治疗的患者85例作为研究对象 。年龄20~38岁,平均(29.10±5.24)岁;体质量指数23.00±1.13,基础FSH(6.33±0.37) U/L,基础血促黄体生成素(luteotropic hormone,LH)(5.87±0.24)U/L,促性腺激素(gonadotrophin,GN)总量(2 960±134.53) U、GN时间(13.40±0.23) d。
本研究经医院伦理委员会审批通过并备案;患者均签署知情同意书。
1.1.1纳入标准 长方案控制性促排卵治疗纳入标准:①年龄<38周岁;②窦卵泡≥7个;③因输卵管因素不孕妇女。
1.1.2排除标准 ①卵巢低反应;②子宫畸形;③多囊卵巢综合征及子宫内膜异位症;④高血压、糖尿病、血脂异常、甲状腺疾病等内分泌疾病。
1.2长方案控制性促排卵治疗 黄体中期皮下注射促性腺激素释放激素激动剂1.4 mg降调节,14 d后达到降调节标准给予r-FSH(果纳芬)促排卵,超声监测子宫内膜和卵泡生长情况,同时监测LH、E2、P水平,当有2个卵泡直径≥20 mm,当晚注射艾泽250 μg。艾泽注射后36 h左右经阴道超声下取卵,体外受精,评估卵母细胞成熟及胚胎质量。
1.3卵母细胞及胚胎评价 评估卵子颗粒细胞复合体采用MⅡ卵评分系统,观察颗粒细胞、卵丘和放射冠细胞密度和松散程度以及卵泡浆的形态等。受精后16~20 h采用SCOTT合子评分标准,观察原核期胚胎形态。受精卵继续培养48 h,采用WETZELS卵裂期胚胎评分标准进行评分检查胚胎发育情况。优质胚胎为第3天至少7个卵裂球,排列规则,1级2级胚胎。
1.4标本采集 留取全部卵泡液,收集细胞沉淀。50%(体积分数)的Percoll细胞分离液(索莱宝)分离颗粒细胞,红细胞裂解液裂解残留的红细胞,PBS洗涤2次,离心,下层即为颗粒细胞。部分颗粒细胞加入2 mL Trizol液完全裂解后置于-80 ℃冻存用于RT-PCR实验;部分-80 ℃直接冻存,用于Western blot 实验;另留取少量颗粒细胞,涂片用于免疫细胞化学实验。
1.5免疫细胞化学法 对颗粒细胞进行固定及透化处理;封闭内源性过氧化物酶及非特异性结合位点。一抗采用兔抗人多克隆BMP-9抗体(山羊血清按照1∶200),阴性对照以PBS代替一抗,并按照免疫细胞化学法进行检测。用Leica显微照相系统进行图像釆集:阴性(-)为无黄色颗粒沉着;弱阳性(+)为细胞内有稀疏分布浅黄色颗粒;阳性(++)为细胞内有黄色或棕色颗粒且分布较密。
1.6RT-PCR Trizol法提取颗粒细胞中的总RNA,反转录采用PROMEGA试剂盒,按照说明书进行。以GAPDH为内参,并于同一条件下扩增。产物于20 g/L琼脂糖凝胶电泳,目的基因与GAPDH扩增产物电泳条带亮度密度比值为BMP-9 mRNA的相对表达量。引物序列:β-actin F为5′-GTCACCTTCACCGTTCCAGTTTT-3′,R为5′-CTTAGTTGCGTTACACCCTTTCTT-3′;BMP-9 F为5′-GACCCTGGTGCATCTCAAGT-3′,R为5′-ACGCTCATGCCCTCGTAATG-3′。
1.7Western blot 细胞裂解液裂解颗粒细胞;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳;分离蛋白条带,转移至PVDF膜上;5%脱脂奶粉封闭1 h;将PVDF膜放入BMP-9工作液中(1∶1 000),4 ℃过夜;TBST洗膜3次,每次10 min;加二抗孵育1 h,用TBST液洗膜4次,每次5 min。β-actin为内参。用双色红外激光扫描器进行扫描,记录灰度值,目的条带与内参照的光密度比值为BMP-9蛋白的相对量。
1.8统计学方法 应用SPSS 21.0统计学软件分析数据。计量资料比较采用独立样本t检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1BMP-9的表达 BMP-9 mRNA及蛋白在颗粒细胞中均有表达,BMP-9表达于人颗粒细胞胞浆内,呈棕黄色颗粒,不同个体间表达水平有差异(图1~3)。
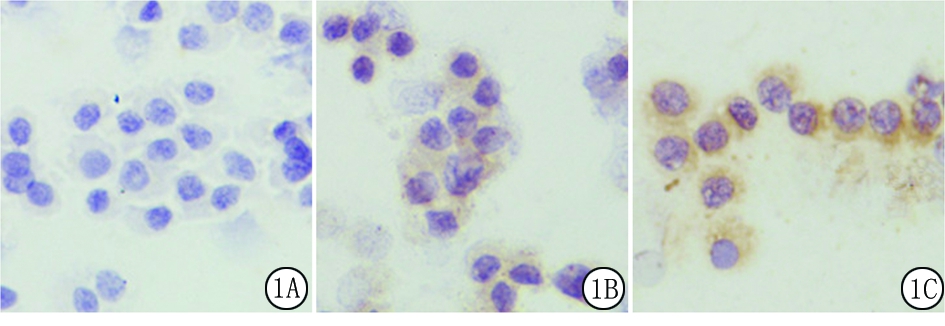
图1 免疫细胞化学法检测BMP-9于人颗粒细胞中的表达定位(IHC×400)
A.-;B.+;C.++
Figure1Immunocytochemistry detection of BMP-9expression in human granulosa cells(IHC× 400)
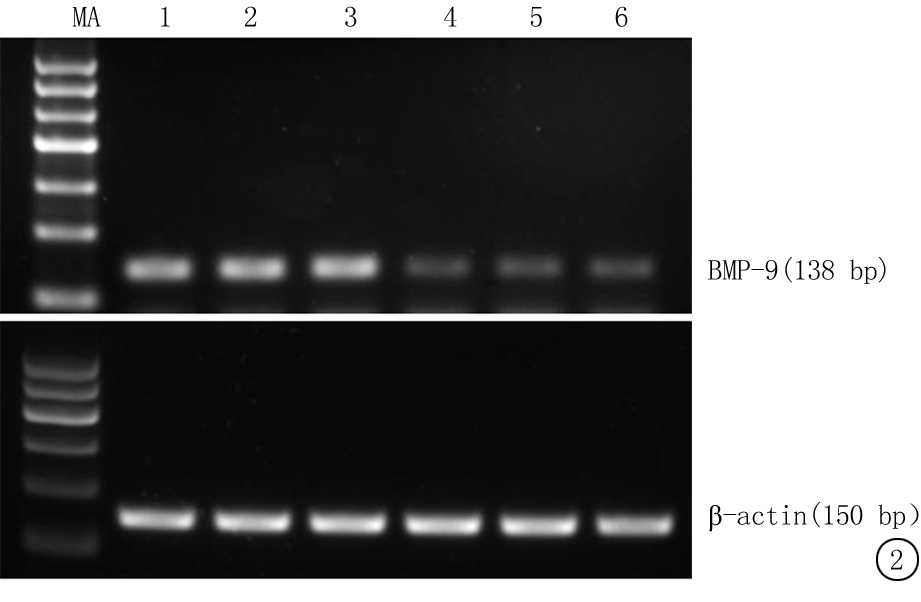
图2 BMP-9 mRNA 表达于人类颗粒细胞
MA:DNA Marker;1~3:高表达组;4~6:低表达组
Figure2BMP-9mRNA expression in human granulosa cells
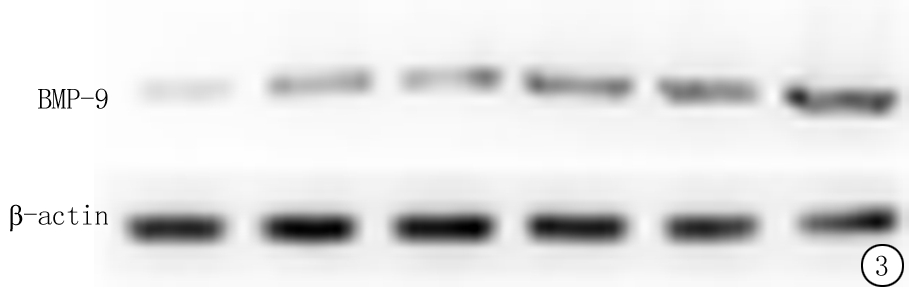
图3 BMP-9蛋白表达于人颗粒细胞
Figure3BMP-9protein expression in human granulosa cells
2.2颗粒细胞中BMP-9 mRNA表达与蛋白表达的相关性分析 颗粒细胞中BMP-9 mRNA表达与蛋白表达呈正相关(r=0.220,P<0.05),但相关性不大。
2.3颗粒细胞中BMP-9 mRNA和蛋白表达与患者临床数据相关性分析 颗粒细胞中BMP-9 mRNA和蛋白表达与患者的年龄、体质量指数、基础FSH、基础LH、GN总量、GN时间均无直线相关关系(P>0.05),见表1。
2.4颗粒细胞中BMP-9 mRNA和蛋白表达与患者实验室数据相关性分析 颗粒细胞中BMP-9 mRNA表达与患者的获卵数、MⅡ卵数、受精数、2PN(2-Pronucleus)数、受精率、优质胚胎率、卵子利用率均无直线相关关系(P>0.05),见表2。
2.5BMP-9 mRNA低表达组和高表达组临床数据比较 85例患者BMP-9 mRNA的相对表达量为0.155~0.690,选取均数0.403为节点,分为低表达组41例和高表达组44例,2组年龄、体质量指数、基础FSH、基础LH、GN总量、GN时间差异均无统计学意义(P>0.05),见表3。
2.6BMP-9 mRNA低表达组和高表达组实验室数据比较 BMP-9 mRNA高表达组优质胚胎率、卵子利用率均高于BMP-9 mRNA低表达组,差异有统计学意义(P<0.05);2组获卵数、MⅡ卵数、受精数、2PN数、受精率差异均无统计学意义(P>0.05)。见表4。
表1 BMP-9表达与临床数据相关关系
Table1The relationship between BMP-9expressionand clinical data
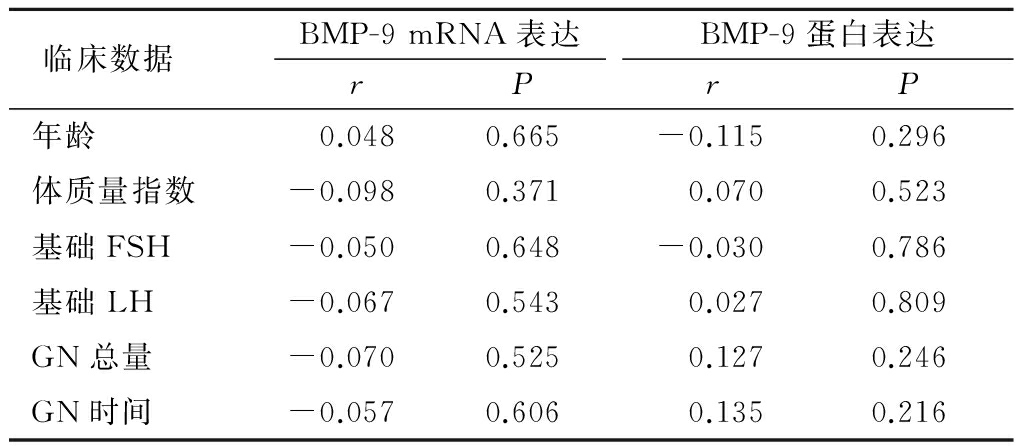
表2 BMP-9表达与实验室数据相关关系
Table2The relationship between BMP-9expression and laboratory data
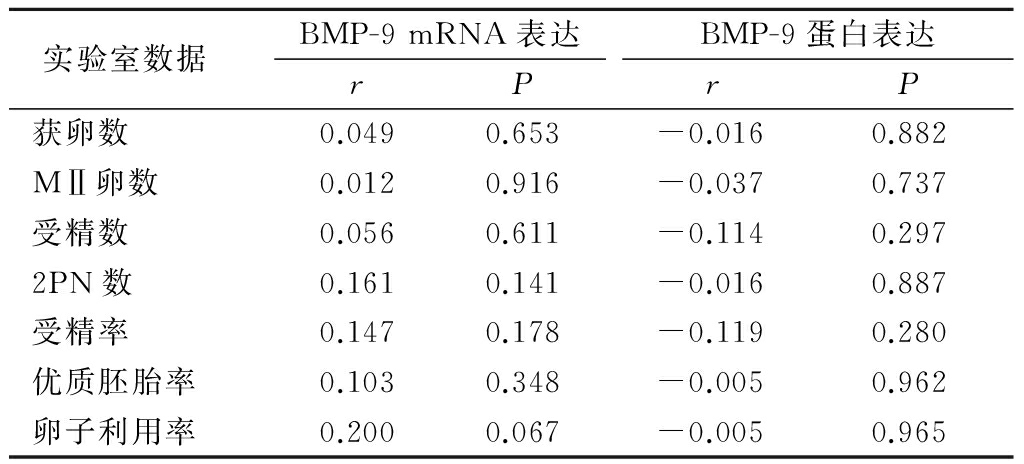
Table3The comparison of clinical data between BMP-9mRNA low expression group and high expression group
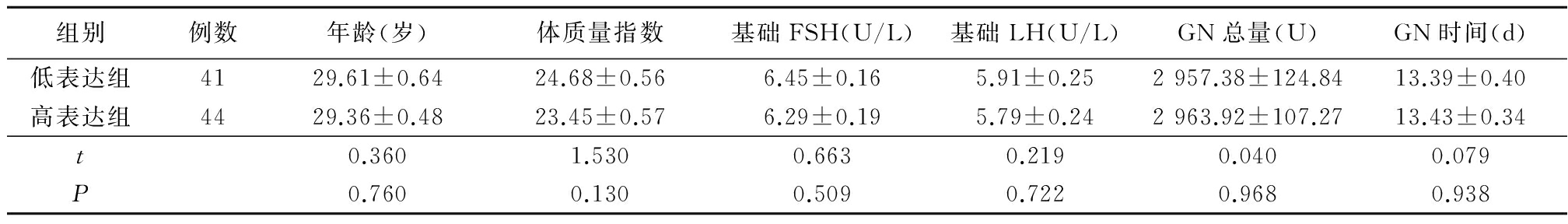
Table4The comparison of laboratory data between BMP-9mRNA low expression group and high expression group
3 讨 论
BMPs是具有高度保守类似结构的功能蛋白[10]。BMPs能够在体内诱导骨和腱样组织形成,并且参与肢体生长、软骨内骨化、骨折早期及肌腱修复,在骨骼发育、再生修复及肌腱再生修复中发挥重要作用。BMPs还在胚胎的发育、神经系统发育及修复、造血组织的发育中调节细胞的增殖、分化和凋亡[11-13]。此外,可通过卵巢自分泌/旁分泌调控卵泡发育和卵母细胞成熟。基因表达研究显示BMPs系统关键部件(配体、受体、信号分子和结合蛋白)在整个生殖系统基本细胞类型的模式中表现出协调的空间和时间的表达,可以调控生殖组织中细胞的增殖、分化与凋亡[7,14-15]。
BMP-9是目前已知的成骨能力最强的骨形态发生蛋白[16]。BMP-9高度表达于肝脏中[17],能调控铁在体内的平衡[18],更能够调节葡萄糖和脂肪酸的代谢[19]。此外,BMP-9可与成纤维细胞生长因子协同作用于神经系统的发育,成纤维细胞生长因子对原始细胞起增殖作用,可使原始细胞特性保持一致性,BMP-9可促进细胞分化,有利于种族特异性的保持[20]。BMP-9可参与造血功能调节,对体内元代造血祖细胞的增生和集落形成起协同作用[21]。近期一项研究发现,使用腺病毒介导BMP-9的表达,证实BMP-9是诱导间充质干细胞成骨分化最有力的BMPs之一,而之前的研究中使用重组BMP-9未得到这样的结论[22-23]。在人类颗粒细胞胞浆中检测到BMP-9的表达,推测人卵巢颗粒细胞可能分泌BMP-9,并通过自分泌/旁分泌作用参与生殖系统的调控。
BMPs家族的成员具有相似的生理作用,可调节类固醇激素的生成,对于卵泡的发育和调控起关键的作用。Hosoya等[7]研究结果显示,BMP-9 mRNA在大鼠颗粒细胞中表达,而在卵母细胞中没有表达;BMP-9可以显著降低大鼠初级颗粒细胞FSH诱导的P的分泌,但对FSH诱导的E2的分泌无作用;此外,还可以影响FSH的信号机制,抑制FSH诱导的cAMP合成和FSH诱导的类固醇生成因子的mRNA表达,包括类固醇激素合成急性调节蛋白、3β羟类固醇脱氢酶和FSH受体。BMP-9很容易激活颗粒细胞中细胞信号转导分子磷酸化作用与DNA结合抑制因子1的转录。使用间变性淋巴瘤激酶抑制剂分析表明BMP-9功能是通过ALK1型受体介导而不是ALK-2、ALK-3和ALK-6。此外,使用BMPⅠ型和Ⅱ型受体胞外结构区域的构建实验显示BMP-9的效应被逆转。因此,颗粒细胞中BMP-9功能受体最有可能的是ALK-1和BMPRⅡ的复合体[24]。
本研究结果显示,BMP-9mRNA高表达组优质胚胎率、卵子利用率明显高于低表达组。表明BMP-9或可调控卵母细胞成熟,提高卵母细胞质量。BMP-9在人类卵母细胞生成过程中可能也参与类固醇激素的生成,由于类固醇激素对卵泡发育有重要作用[25],BMP-9可能携同其他BMPs作为黄素化抑制剂,防止卵泡提前黄素化,并调控卵泡的正常发育,但其在人类颗粒细胞中作用机制还需进一步研究。
BMP-9对血管生成有抑制作用,其作为抗血管生成因子,以较高的水平存在于人血清中(2~12 μg/L)[26]。循环中的BMP-9可能作用于生殖系统,协同颗粒细胞中BMP-9共同影响卵母细胞的发育。卵泡液作为颗粒细胞和卵母细胞生存的微环境,也有可能存在BMP-9蛋白。进一步研究血清、颗粒细胞和卵泡液中BMP-9的作用浓度及相互关系,深入探讨其对卵母细胞的作用机制是十分必要的。
[参考文献]
[1] 黄鑫,郝翠芳.人卵丘细胞及卵母细胞发育成熟的关系[J].生殖与避孕,2012,32(8):546-552.
[2] Ortiz ME,Arias-Torres AJ,Zelaray n LI. Role of arachidonic acid cascade in Rhinella arenarum oocyte maturation[J]. Zygote,2015,23(4):603-614.
n LI. Role of arachidonic acid cascade in Rhinella arenarum oocyte maturation[J]. Zygote,2015,23(4):603-614.
[3] Deguchi R,Takeda N,Stricker SA. Calcium signals and oocyte maturation in marine invertebrates[J]. Int J Dev Biol,2015,59(7-9):271-280.
[4] 赵杰,陈秀娟.颗粒细胞与卵母细胞关系研究进展[J].国际生殖健康,2015,34(5):406-409.
[5] Majumder S,Das S,Moulik SR,et al. G-protein coupled estrogen receptor(GPER) inhibits final oocyte maturation in common carp,Cyprinus carpio[J]. Gen Comp Endocrinol,2015,211:28-38.
[6] Shinohara Y,Nakamura T,Shirakata Y,et al. Bone healing capabilities of recombinant human bone morphogenetic protein-9(rhBMP-9) with a chitosan or collagen carrier in rat calvarial defects[J]. Dent Mater J,2016,35(3):454-460.
[7] Hosoya T,Otsuka F,Nakamura E,et al. Regulatory role of BMP-9 in steroidogenesis by rat ovarian granulosa cells[J]. J Steroid Biochem Mol Biol,2015,147:85-91.
[8] Moreno JM,Nú ez MJ,Qui
ez MJ,Qui onero A,et al. Follicular fluid and mural granulosa cells microRNA profiles vary in in vitro fertilization patients depending on their age and oocyte maturation stage[J]. Fertil Steril,2015,104(4):1037-1046.
onero A,et al. Follicular fluid and mural granulosa cells microRNA profiles vary in in vitro fertilization patients depending on their age and oocyte maturation stage[J]. Fertil Steril,2015,104(4):1037-1046.
[9] Herrera B,van Dinther M,Ten Dijke P,et al. Autocrine bone morphogenetic protein-9 signals through activin receptor like kinase-2/Smad1/Smad4 to promote ovarian cancer cell proliferation[J]. Cancer Res,2009,69(24):9254-9264.
[10] 赵敏英,孙东霞,王素改,等.多囊卵巢综合征不孕患者的4种促排卵方案比较[J].河北医科大学学报,2016,37(6):712-715.
[11] Fuchigami S,Nakamura T,Furue K,et al. Recombinant human bone morphogenetic protein-9 potently induces osteogenic differentiation of human periodontal ligament fibroblasts[J]. Eur J Oral Sci,2016,124(2):151-157.
[12] 张云鹏,白希壮.BMP家族的研究近况[J].解剖科学进展,2008,14(3):334-336.
[13] Chen X,Cui J,Yan Z,et al. Sustained high level transgene expression in mammalian cells mediated by the optimized piggyBac transposon system[J]. Genes Dis,2015,2(1):96-105.
[14] Lamplot JD,Liu B,Yin L,et al. Reversibly immortalized mouse articular chondrocytes acquire long-term proliferative capability while retaining chondrogenic phenotype[J]. Cell Transplant,2015,24:1053-1066.
[15] Shimasaki S,Moore RK,Otsuka F,et al. The bone morphogenetic protein system in mammalian reproduction[J]. Endocr Rev,2004,25(1):72-101.
[16] Wang W,Weng Y,Ren W,et al. Biological roles of human bone morphogenetic protein 9 in the bone microenvironment of human breast cancer MDA-MB-231 cells[J]. Am J Transl Res,2015,7(9):1660-1674.
[17] Chen L,Wei H,Tan J,et al. Bone morphogenetic protein 9 and 13 Induce C3H10T1/2 cell differentiation to cardiomyocyte-like cells in vitro[J]. Cell Transplant,2015,24(5):909-920.
[18] Miller AF,Harvey SA,Thies RS,et al. Bone morphogenetic protein-9 an autocrine/paracrine cytokine in the liver[J]. J Biol Chem,2000,275(24):17937-17945.
[19] Lamplot JD,Qin J,Nan G,et al. BMP9 signaling in stem cell differentiation and osteogenesis[J]. Am J Stem Cells,2013,2(1):1-21.
[20] Herrera B,Dooley S,Breitkopf-Heinlein K. Potential roles of bone morphogenetic protein(BMP)-9 in human liver diseases[J]. Int J Mol Sci,2014,15(4):5199-5220.
[21] Liu S,Geng X,Fang S,et al. Wnt3a combined with bone morphogenetic protein 9 induce C3H10T1/2 cells differentiation into cardiomyocyte-like cells in vitro[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2015,31(4):448-451.
[22] Lopez-Coviella I,Mellott TM,Kovacheva VP,et al. Developmental pattern of expression of BMP receptors and Smads and activation of Smad1 and Smad5 by BMP9 in mouse basal forebrain[J]. Brain Res,2006,1088(1):49-56.
[23] Scharpfenecker M,van Dinther M,Liu Z,et al. BMP-9 signals via ALK1 and inhibits bFGF-induced endothelial cell proliferation and VEGF-stimulated angiogenesis[J]. J Cell Sci,2007,120(Pt 6):964-972.
[24] Zhang Q,Wang J,Deng F,et al. TqPCR:a Touchdown qPCR Assay with Significantly Improved Detection Sensitivity and Amplification Efficiency of SYBR Green qPCR[J]. PLoS One,2015,10(7):e0132666.
[25] Li H,Zhao D,Wang S,et al. Bone morphogenetic protein-9 promotes the differentiation of mouse spleen macrophages into osteoclasts via the ALK1 receptor and ERK 1/2 pathways in vitro[J]. Mol Med Rep,2016,14(5):4545-4550.
[26] Moreno JM,Nú ez MJ,Qui
ez MJ,Qui onero A,et al .Follicular fluid and mural granulosa cells microRNA profiles vary in in vitro fertilization patients depending on their age and oocyte maturation stage[J]. Fertil Steril,2015,104(4):1037-1046.
onero A,et al .Follicular fluid and mural granulosa cells microRNA profiles vary in in vitro fertilization patients depending on their age and oocyte maturation stage[J]. Fertil Steril,2015,104(4):1037-1046.