原发性肝癌(hepatocellular carcinoma,HCC)是全球发病率位居第5位的常见恶性肿瘤,每年在全球范围内约有50万人死于该病,HCC已经成为全球第三大恶性肿瘤死亡原因,乙型肝炎病毒(hepatitis B virus,HBV),丙型肝炎病毒(hepatitis C virus,HCV)和酗酒是HCC的主要危险因素,其中HBV感染所致HCC约占全球HCC病例的80%[1-2]。在亚洲和非洲,HBV和HCV感染率远远高于全球其他地区,HCC的发病率逐年上升。HBV感染是人类具有挑战性的健康问题,我国约有9 300万人为HBV携带者,约3 000万人被确诊为慢性乙型病毒性肝炎[3]。尽管目前临床检查方法和治疗方法有所改善,但HCC患者的预后仍然很差,复发率高。导致HCC发生的分子学机制尚未完全明确。肿瘤大小、肿瘤数目、病理类型、脉管瘤栓和炎症程度已被确定为影响HCC患者预后的预测因素[4-6]。HBV是一种嗜肝病毒,据世界卫生组织报道,每年在全球范围内约3亿人感染HBV并造成约100万人死亡。根据HBV全基因序列差异,已经鉴定出了具有不同地理分布的HBV基因型,HBV分为A~J 10个基因型。其中,B和C基因型是东亚地区主要的HBV基因型[7-8]。东亚地区不同年龄组人群中HBV基因型与HCC发病风险有关[8]。本研究应用HBV-HCC患者肝癌组织标本,对HBV X区的DNA序列进行测序分析,以鉴定出与HBV-HCC患者术后生存相关的突变位点。
1 资 料 与 方 法
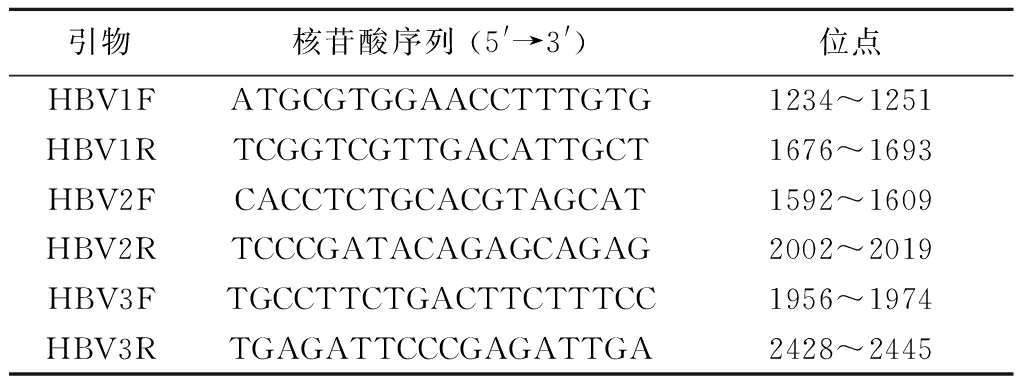
1.1肝癌组织标本及DNA的提取 收集2007—2009年在河北医科大学第四医院行外科手术的81例HBV-HCC患者癌组织标本,其中男性71例,女性10例,年龄30~86岁,中位数年龄54岁,所有患者均被证实感染HBV并排除其他肝脏疾病。用基因组DNA提取试剂盒(Promega,Madison,WI,USA)提取基因组DNA,置于-20 ℃冰箱存放备用。
1.2病毒学检测、PCR扩增及DNA测序 应用ABI 7300 TaqMan平台(Life Technologies,Carlsbad,CA,USA)通过多重PCR方法测定HBV-HCC患者癌组织的HBV基因型。根据NCBI数据库中列出的引物(表1),针对HBV X区的DNA序列进行PCR扩增,PCR产品经净化处理后使用BigDye Terminator v3.1循环测序试剂盒(Life Technologies)进行循环测序,应用ABI PRISM Genetic Analyzer 3100进行测序分析。同一标本采用双向重复测序,即正反链同时测序,以确保测序的准确性,明确其突变位点。
1.3统计学方法 应用SPSS 18.0统计软件分析数据。用Kaplan-Meier和Log-rank test方法分析HBV-HCC患者的临床特征与术后总生存期之间的关系;用Cox比例风险回归模型分析HBV突变与HBV-HCC患者术后生存的关系。P<0.05为差异有统计学意义。
表1 HBV X区基因扩增和测序引物
Table1Primer pairs used in amplified andsequencing in HBV X gene
2 结 果
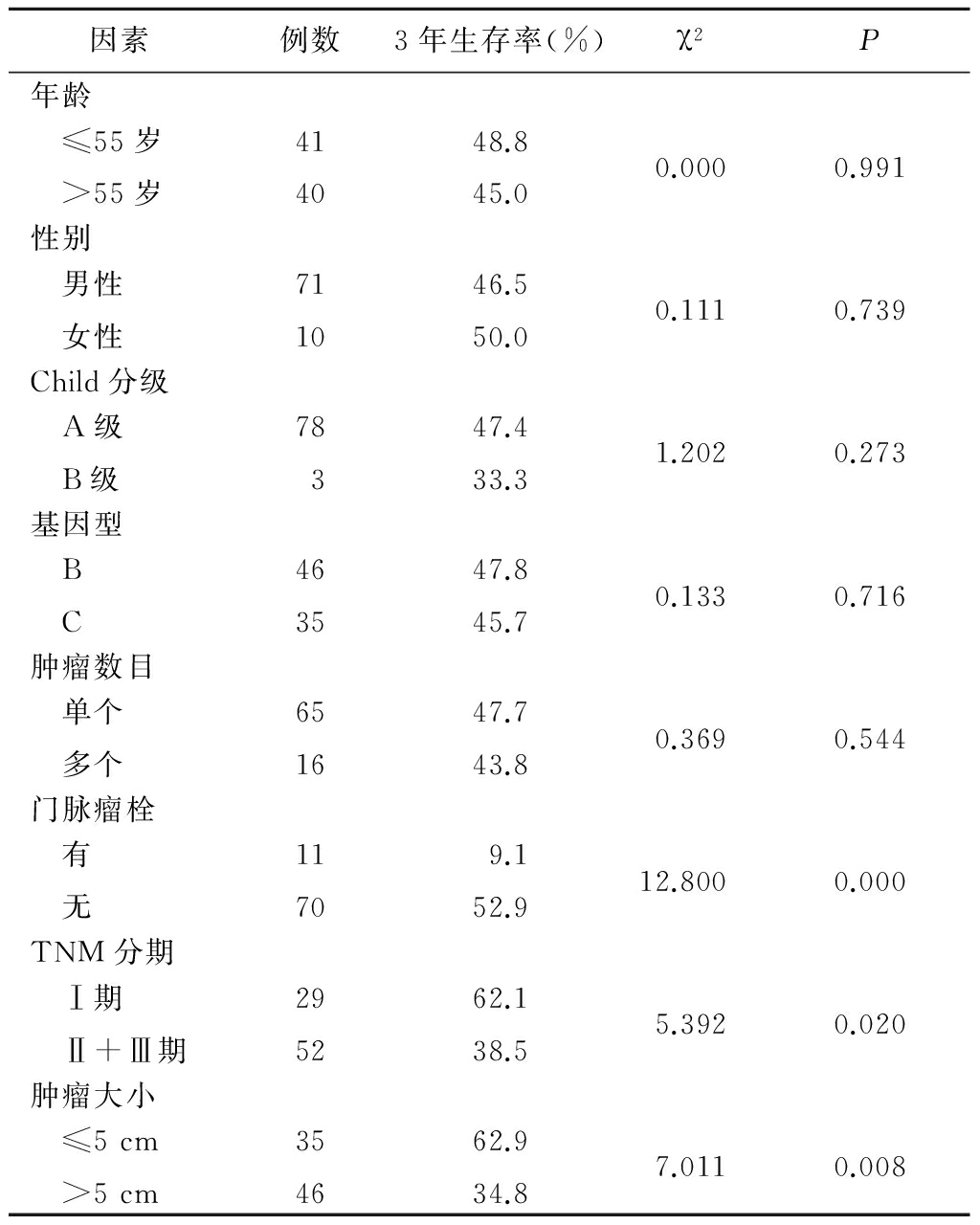
2.1HBV-HCC患者的临床特征与生存率的相关性 对81例HBV-HCC患者随访3年,每3个月随访1次。结果显示肿瘤大小、肿瘤分期和门脉瘤栓与HBV-HCC患者的术后生存相关,见表2。
表2 与HBV-HCC患者术后生存相关的临床因素
Table2Univariate analysis of clinical factors associatedwith postoperational survival in HBV-HCC patients
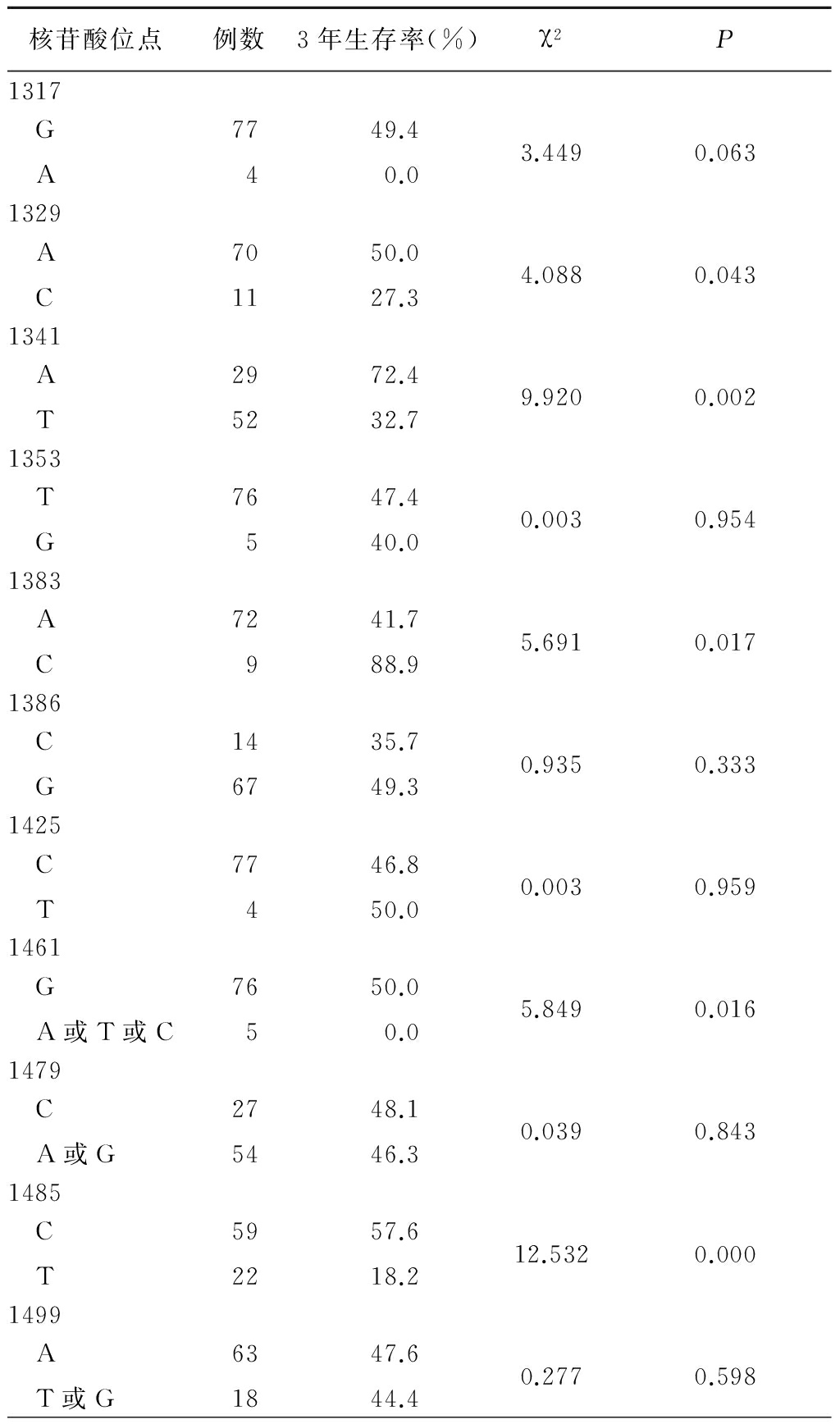
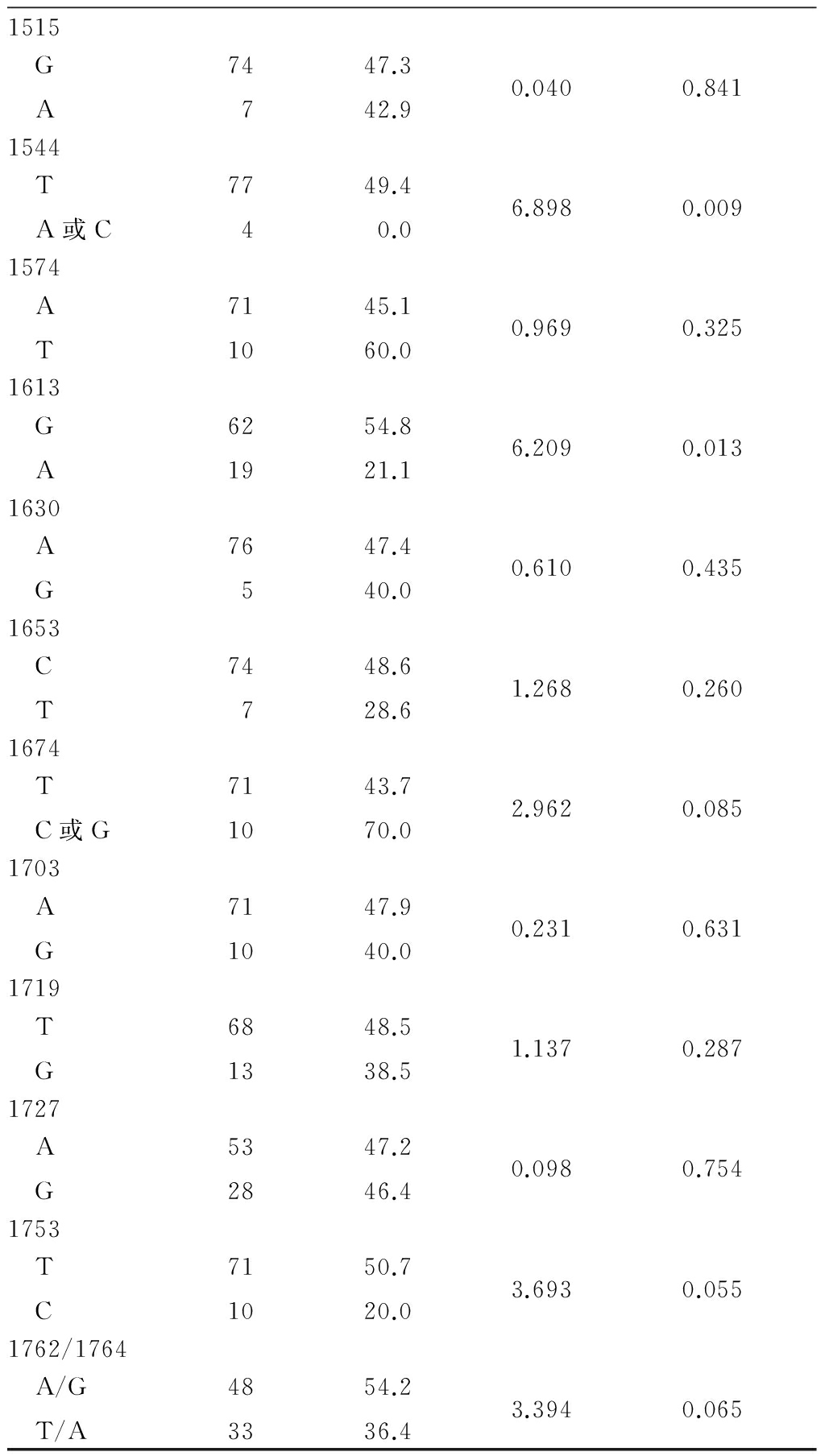
2.2HBV X区基因突变分布与生存率的相关性 从HBV-HCC患者肝癌组织中提取HBV DNA并进行分析,对HBV X区的DNA序列进行基因测序。C和B基因型患者的HBV DNA突变分布频率差异无统计学意义。发现有23个位点的突变频率高于5%,应用Kaplan-Meier和Log-rank test方法分析,发现有11个位点与HBV-HCC患者的生存相关。以下7个突变位点(1329、1341、1383、1461、1485、1544和1613位点)与HBV-HCC患者的生存差异有统计学意义。另外4个突变位点(1317、1674、1753和1762/1764位点)具有临界统计学差异,见表3。
表3 与HBV-HCC患者术后生存相关的HBV X区基因突变位点
Table3Univariate analysis of HBV X gene mutationsassociated with postoperative survivalin patients with HBV-HCC
2.3多因素分析结果 Cox回归模型分析结果显示肿瘤大小、门脉瘤栓、1329、1341、1383、1461和1485位点与HBV-HCC患者术后预后密切相关,被确定为与HBV-HCC患者术后预后相关的独立危险因素,见表4。
表4 与HBV-HCC患者术后生存相关的临床特征及HBV X区基因突变位点
Table4Multivariate analysis of clinical characteristics and HBV X gene mutations associated withpostoperative survival in patients with HBV-HCC
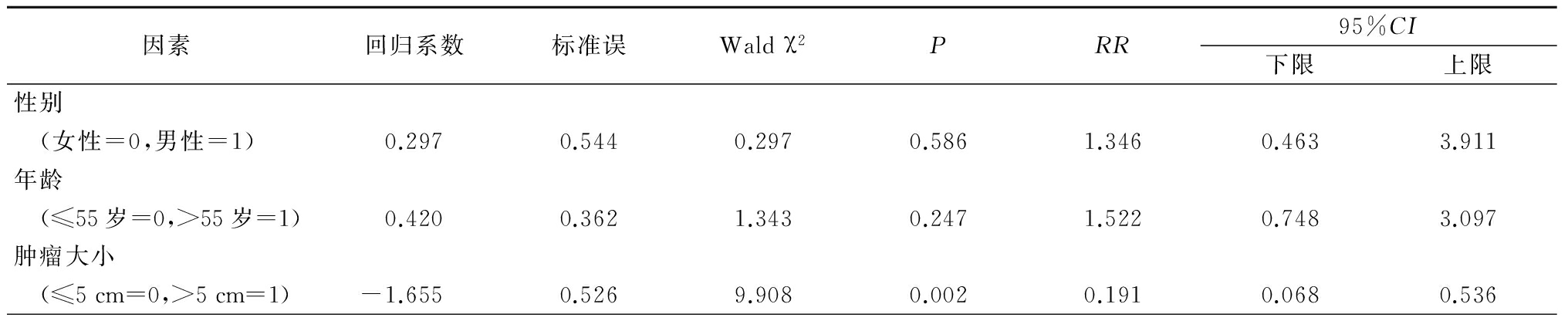
表4(续)
3 讨 论
HBV基因组包括4个重叠的开放阅读框(open reading frame,ORF),即X、P、pre S/S、pre C/C基因区,它们分别编码X蛋白、聚合酶蛋白、外膜蛋白、核壳蛋白[9-11]。X基因(1374~1838位点)与增强子Ⅱ( enhancer Ⅱ,EnH Ⅱ,1636~1744位点)和基础核心启动子(the basal core promoter,BCP,1751~1769位点)重叠,后两者均可以控制HBV前核心区和核心区的转录。由于HBV聚合酶存在校正功能缺陷,故HBV DNA容易发生基因突变[10-11]。有研究表明,HBV基因型与HBV-HCC发病风险相关,研究者通过病例对照研究方法,对preS1、preS2、BCP和EnH Ⅱ区域的突变位点进行了广泛的研究,发现这些区域的几个位点突变与HBV-HCC发生有关[9-11]。然而,HBV基因突变与HBV-HCC患者预后关系的研究鲜有报道,特别是针对X基因区进行的研究则更少。Yeh等[12]研究发现基本核心启动子(BCP)区域A1762T/G1764A双突变与HBV-HCC的预后相关,可独立预测HCC患者的术后生存期。有研究者针对HCC与HBV之间的关系进行了大量研究,如HBV DNA、基因型、基因突变等,并且鉴定出了与HCC相关的HBV X、BCP、EnH Ⅱ和pre C/C区域中的突变位点[9-13]。然而,只有少数基因突变位点被认为与HBV-HCC患者的预后相关[12]。本研究评估了HBV X区DNA序列的突变,并且鉴定出了与HBV-HCC生存相关的11个突变位点。与以往的研究报告相一致,即A1762T/G1764A突变与HCC患者术后生存相关[11]。因此,HBV基因突变不仅与HCC发生相关,而且还影响HCC患者术后的预后。
基本核心启动子(BCP)区位于HBV基因组的X基因区,主要调控HBV前核心区、核心区的转录和HBeAg的表达,大量研究表明HBV DNA突变频率最高的位点为BCP区A1762T/G1764A突变,其与HCC的发生发展有关[9-12]。在本研究中,A1762T/G1764A突变被确定为与HCC患者的生存具有临界统计学差异。这种突变在肝癌发生和影响患者生存过程中的作用机制尚未完全明确,该突变导致HBeAg表达量显著降低,并增强了病毒基因组复制,故可能会增加HCC过程中的病毒侵袭性[14]。此外,该突变也可导致HBV X蛋白被截断,这一变化不仅可以促进肝细胞增殖,而且还能增强HCC细胞侵袭和转移,从而促进HCC的发生发展[15]。HBV X蛋白的突变,如I127A氨基酸替换,可以改变HBV X与BCL2的亲合力,从而影响HBV X诱导的细胞凋亡[16]。
HBV X蛋白是一种由154个氨基酸组成的蛋白质,编码它的基因通过与宿主DNA进行整合,不仅促进了病毒基因的表达和复制,而且还增加了遗传不稳定性[11]。HBV X蛋白不仅能直接与抑癌基因p53、炎症因子IL-6以及核转录因子NF-κB、STAT等相互调控,还可以激活信号转导系统如JAK/STAT,故HBV X蛋白被认为具有广泛生物学作用的反式作用因子,并且有研究揭示了HBV X蛋白在慢性乙型病毒性肝炎病理过程和肝癌的发生发展以及侵袭转移中所发挥的重要作用[17]。有研究发现HBV X蛋白可以通过与线粒体膜上的电压依赖性阴离子通道(VDAC3)结合,从而改变线粒体的跨膜势能,通过影响ROS使NF-κB和STAT3等活化,进一步干扰宿主细胞基因转录,从而导致HCC的发生[18]。它可以通过作用于细胞质信号通路诱导的表观遗传修饰,灭活p53介导的HBV-HCC[19]。最近的研究还显示HBV X基因在肝癌发生过程中可调节microRNA表达[20]。本研究鉴定出了在HBV X基因区有11个突变位点与HBV-HCC生存相关,其中突变位点1317、1329、1341、1383、1461、1485、1544和1613位于EnH Ⅱ和BCP重叠区域以外的基因区。1613位点则位于EnH Ⅱ上游的负调控元件(negative regulatory element,NRE),有研究显示1613A突变与HCC发生相关,并可抑制HBeAg分泌以及增强病毒DNA的合成[21],1485T突变也被证实与HCC发生有关。谢佳新[22]研究发现1674位点及1753位点基因突变可增加HCC发病风险。另外8个突变位点尚未见报道,但它们中一部分位于HBV转录调控元件(posttranscriptional regulatory element,PRE)区域,可使表面蛋白通过输出不被剪接的RNA从而绕过细胞microRNA剪接机制[23]。
HBV X基因区中的5个突变位点(1329、1341、1383、1461、1485)被确定为与HBV-HCC患者术后预后相关的独立危险因素。然而,本研究结果需要在其他人群和实验室进行验证研究。总之,对于HBV X区基因突变位点的研究分析有助于在临床中评估HCC患者的预后,提高HCC患者的生存期。
[参考文献]
[1] Massarweh NN,El-Serag HB. Epidemiology of hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J]. Cancer Control,2017,24(3):1073274817729245.
[2] 王向阳,王艳红.赤峰市敖汉旗肝癌危险因素分析[J].医学动物防制,2011,27(4):353-355.
[3] Lu FM,Zhuang H. Management of hepatitis B in China[J]. Chin Med J(Engl),2009,122(1):3-4.
[4] Shen J,He L,Li C,et al. Prognostic omograms for patients with resectable hepatocelluar carcinoma incorporating systemic inflammation and tumor characteristics[J]. Oncotarget,2016,7(49):80783-80793.
[5] Wang C,Zhang F,Fan H,et al. Sequence Polymorphisms of mitochondrial D-loop and hepatocellular carcinoma outcome[J]. Biochem Biophys Res Commun,2011,406(3):493-496.
[6] 吴义娟,李胜棉,魏丽珍.HBV与HCV相关原发性肝癌临床特征及生存期比较[J].河北医科大学学报,2009,30(10):992-996.
[7] Li HM,Wang JQ,Wang R,et al. Hepatitis B virus genotypes and genome characteristics in China[J]. World J Gastroenterol,2015,21(21):6684-6697.
[8] Liu S,Zhang H,Gu C,et al. Associations between hepatitis B virusmutations and the risk of hepatocellular carcinoma:a meta-analysis[J]. J Natl Cancer Inst,2009,101(15):1066-1082.
[9] 董绍斌,王富珍,张爽,等.原发性肝癌合并HBV感染者的HBV基因特征分析[J].中华实验和临床病毒学杂志,2017,31(2):92-97.
[10] Lamontagne RJ,Bagga S,Bouchard MJ. Hepatitis B virus molecular biology and pathogenesis[J]. Hepatoma Res,2016,2:163-186.
[11] Wen J,Song C,Jiang D,et al. Hepatitis B virus genotype,mutations,human leukocyte antigen polymorphisms and their interactions in hepatocellular carcinoma:a multi-centre case-control study[J]. Sci Rep,2015,5:16489.
[12] Yeh CT,So M,Ng J,et al. Hepatitis B virus-DNA level and basal core promoter A1762T/G1764A mutation in liver tissue independently predict postoperative survival in hepatocellular carcinoma[J]. Hepatology,2010,52(6):1922-1933.
[13] Lee D,Lyu H,Chung YH,et al. Genomic change in hepatitis B virus associated with development of hepatocellular carcinoma[J]. World J Gastroenterol,2016,22(23):5393-5399.
[14] Hunt CM,McGill JM,Allen MI,et al. Clinical relevance of hepatitis B viral mutations[J]. Hepatology,2000,31(5):1037-1044.
[15] Sze KM,Chu GK,Lee JM,et al. C-terminal truncated hepatitis B virus x protein is associated with metastasis and enhances invasiveness by C-Jun/matrix metalloproteinase protein 10 activation in hepatocellular carcinoma[J]. Hepatology,2013,57(1):131-139.
[16] Jiang T,Liu M,Wu J,et al. Structural and biochemical analysis of Bcl-2 interaction with the hepatitis B virus protein HBx[J]. Proc Natl Acad Sci USA,2016,113(8):2074-2079.
[17] Bandopadhyay M,Sarkar N,Datta S,et al. Hepatitis B virus X protein mediated suppression of miRNA-122 expression enhances hepatoblastoma cell proliferation through cyclin G1-p53 axis[J]. Infect Agent Cancer,2016,11:40.
[18] Xie Q,Zhang S,Wang W,et al. Inhibition of hepatitis B virus gene expression by small interfering RNAs targeting cccDNA and X antigen[J]. Acta Virol,2012,56(1):49-55.
[19] Zhang B,Han S,Feng B,et al. Hepatitis B virus X protein-mediated non-coding RNA aberrations in the development of human hepatocellular carcinoma[J]. Exp Mol Med,2017,49(2):e293.
[20] Wang G,Dong F,Xu Z,et al. MicroRNA profile in HBV-induced infection and hepatocellular carcinoma[J]. BMC Cancer,2017,17(1):805.
[21] Zhang ZH,Wu CC,Chen XW,et al. Genetic variation of hepatitis B virus and its significance for pathogenesis[J]. World J Gastroenterol,2016,22(1):126-144.
[22] 谢佳新.乙肝病毒变异及STAT3基因多态性在肝细胞癌发生中交互作用的研究[D]. 上海:第二军医大学,2012.
[23] Lim CS,Brown CM. Hepatitis B virus nuclear export elements:RNA stem-loop α and β,key parts of the HBV post-transcriptional regulatory element[J]. RNA Biol,2016,13(9):743-747.