在中国每年有超过80万人死于胃癌,胃癌在我国恶性肿瘤发病率居第二位,病死率居第三位,严重威胁人民生命健康[1]。胃腺癌是由胃腺体细胞恶化产生,胃腺癌的发病率占全部胃癌发病率的95%,腺癌是胃癌最主要的病理组织学类型,其肿瘤的浸润、转移能力关系到患者的预后及生存期。因此,肿瘤转移抑制基因在胃腺癌发生和转移过程中的作用机制,一直是研究热点。亲吻素(kisspeptin 1,Kiss-1)最初发现于黑素瘤细胞株中,是一种与肿瘤转移密切相关的基因。Kiss-1广泛存在于正常的组织和器官中,在小肠、胎盘、睾丸、脑等组织中均有不同程度的表达。Kiss-1基因作为肿瘤转移抑制基因,其编码的Kiss-1蛋白可与亲吻素受体(kisspeptin 1 receptor,Kiss-1R)蛋白(G蛋白偶联受体54,GPR54)特异性结合,对肿瘤的浸润和转移发挥抑制作用[2-3]。与正常胃黏膜相比,胃癌组织中Kiss-1表达下调,过表达胃癌细胞中Kiss-1水平能够抑制胃癌细胞的侵袭能力,说明Kiss-1影响胃癌细胞生物学特性的发挥。本研究采用免疫组织化学方法检测Kiss-1、Kiss-1R蛋白在胃腺癌组织与正常胃黏膜组织中的表达情况及其与临床病理特征之间的关系,探讨两者在胃腺癌发病过程中的作用及临床意义,旨在为预后判断提供依据。
1 资 料 与 方 法
1.1一般资料 选择2013年1月—2016年1月在河北医科大学第一医院普外科行手术治疗的胃腺癌患者40例。纳入标准:胃腺癌患者,术前均未进行放疗、化疗和其他抗肿瘤相关治疗,临床病理资料完整。排除标准:①病理提示非胃腺癌患者;②术前已行放疗、化疗和其他抗肿瘤相关治疗;③临床病理资料不完整。其中男性24例,女性16例,年龄34~82岁,平均(61.90±9.62)岁;胃癌组肿瘤标本3.00~5.75 cm;分化类型:低分化腺癌19例,中高分化腺癌21例;浸润程度:侵透浆膜23例,未侵透浆膜17例;TNM分期:Ⅰ+Ⅱ期23例,Ⅲ+Ⅳ期17例;无淋巴结转移15例,有淋巴结转移25例。另选取前述胃腺癌患者癌旁正常胃黏膜组织28例(均距离癌组织边缘5 cm以上)为对照组标本,男性17例,女性11例,年龄34~82岁,平均(63.25±9.54)岁。全部患者诊断均由2位病理科主任医师验证。
本研究获得河北医科大学第一医院伦理委员会批准,所有患者均签署知情同意书。
1.2方法
1.2.1主要试剂 浓缩型鼠抗Kiss-1抗体、兔抗Kiss-1R抗体购于艾博抗(上海)贸易有限公司,免疫组织化学染色试剂盒、浓缩型DAB试剂盒均购于北京中杉金桥生物技术有限公司。
1.2.2常规组织学处理 所有标本均经10%福尔马林溶液固定,常规石蜡包埋切片,HE染色供病理学观察确诊。肿瘤组织学分级根据2015年美国联合癌症委员会/国际抗癌联盟制定的胃癌TNM分期系统。
1.2.3免疫组织化学检测 石蜡包埋组织以3.5~4 μm厚度连续切片,烤箱60~65 ℃过夜,常规脱蜡,柠檬酸修复液煮沸修复,采用免疫组织化学链霉菌抗生物素蛋白-过氧化酶连接(SP)法染色,严格按照免疫组织化学试剂盒说明书步骤进行,DAB显色,苏木素复染,以已知Kiss-1蛋白阳性切片作阳性对照,以PBS液代替一抗作阴性对照。
1.2.4结果判定 采用双盲法显微镜下观察结果,每张切片随机取5个400倍视野。Kiss-1、Kiss-1R蛋白为细胞质染色,胞质染色棕黄色为阳性,不着色为阴性。阳性判定以阳性细胞百分比及染色强度记分综合判定。阳性细胞百分比记分按视野内阳性细胞所占总细胞数的比例记分,<5%为0分,6%~25%为1分,26%~50%为2分,≥51%为3分;染色强度不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。二者相加,≤4分者为阴性,>4分者为阳性。
1.3统计学方法 应用SPSS 16.0统计学软件分析数据。计数资料比较采用χ2检验;相关性采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1Kiss-1蛋白表达情况 Kiss-1蛋白在细胞质呈棕黄色阳性表达(图1,2)。Kiss-1蛋白在胃腺癌组织的阳性表达率为45.0%(18/40),明显低于胃正常黏膜组织的阳性表达率78.57%(22/28),差异有统计学意义(χ2=7.664,P<0.01)。低分化胃腺癌组织Kiss-1蛋白阳性表达率低于中高分化胃腺癌组织,有淋巴结转移胃腺癌组织Kiss-1蛋白阳性表达率低于无淋巴结转移胃腺癌组织,TNM Ⅲ+Ⅳ期胃腺癌组织Kiss-1蛋白阳性表达率低于Ⅰ+Ⅱ期胃腺癌组织,差异均有统计学意义(P<0.05);不同性别、年龄、肿瘤大小和肿瘤浸润深度胃腺癌组织Kiss-1蛋白阳性表达率差异均无统计学意义(P>0.05)。见表1。
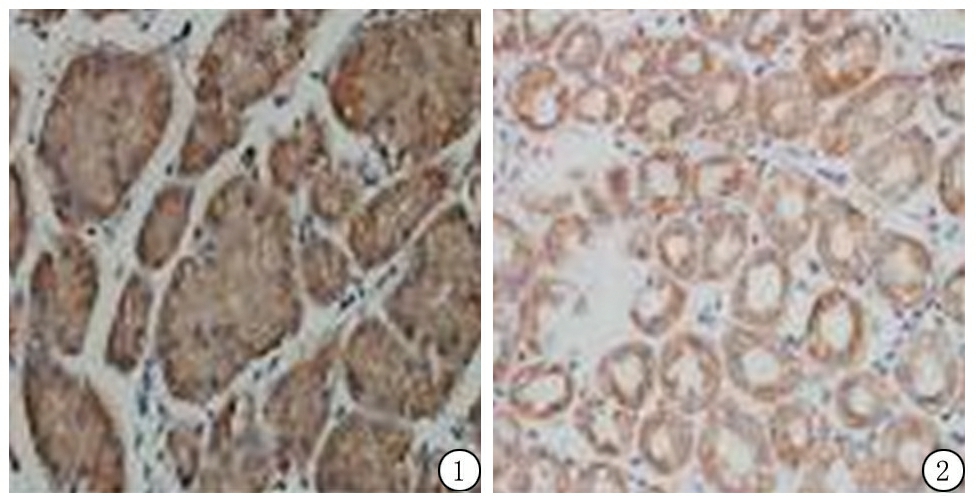
图1 胃腺癌组织Kiss-1蛋白阳性表达(SP ×400)
Figure1Positive expression of Kiss-1protein in gastric adenocarcinoma(SP×400)
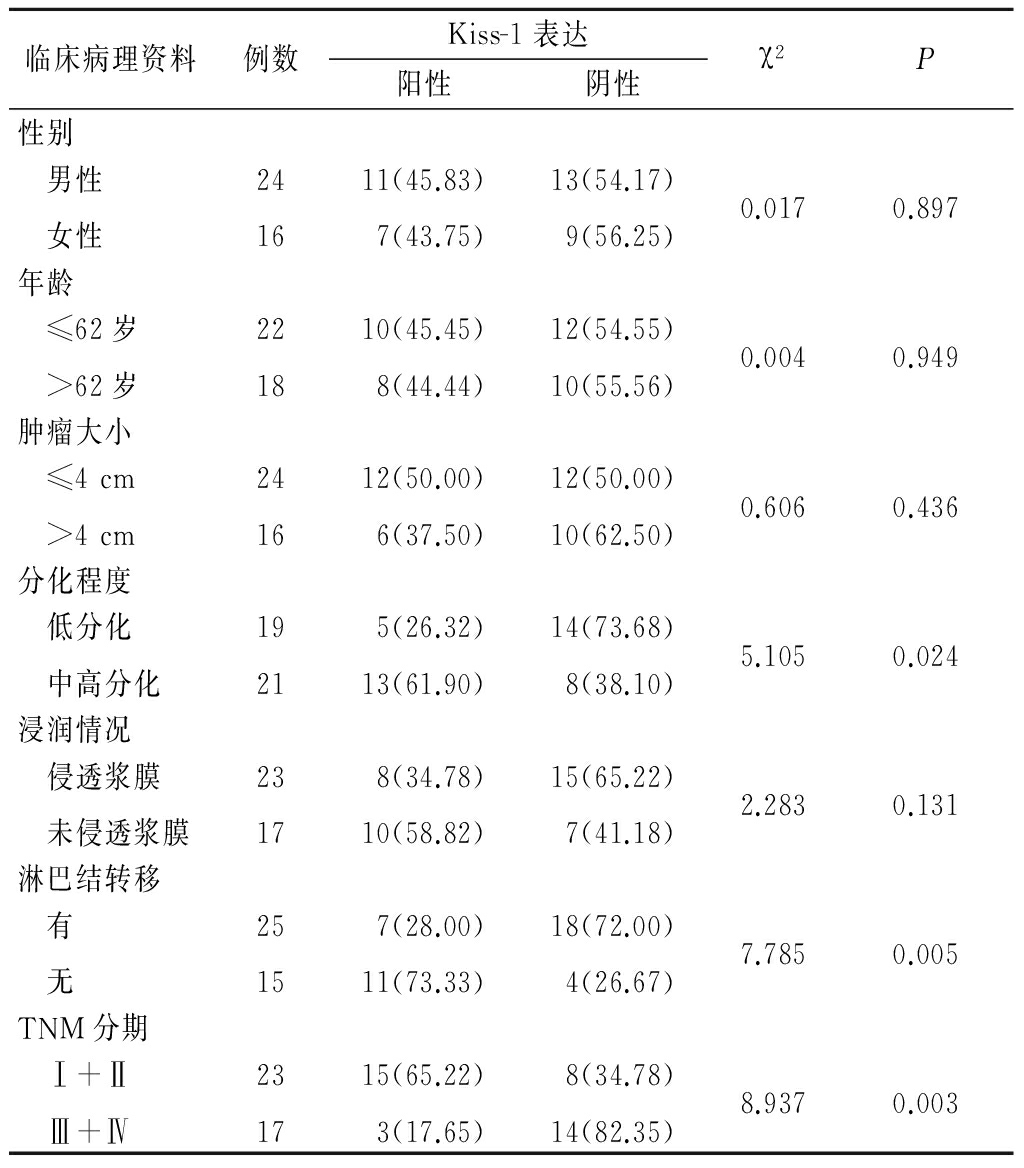
图2胃正常黏膜组织Kiss-1蛋白阳性表达(SP×400)
Figure2Positive expression of Kiss-1protein in gastric normal mucosa(SP×400)
表1 Kiss-1蛋白在不同临床特征胃腺癌组织中表达比较
Table1Comparison of Kiss-1protein expression indifferent clinical features of gastric adenocarcinoma(例数,%)
2.2Kiss-1R蛋白表达情况 Kiss-1R蛋白在细胞质呈棕黄色阳性表达(图3,4)。Kiss-1R蛋白在胃腺癌组织的阳性表达率为22.5%(9/40),明显低于胃正常黏膜组的阳性表达率82.14%(23/28),差异有统计学意义(χ2=23.518,P<0.01)。不同性别、年龄、肿瘤大小、分化程度、浸润深度、淋巴结转移、TNM分期胃腺癌组织中Kiss-1R蛋白阳性表达率差异均无统计学意义(P>0.05),见表2。
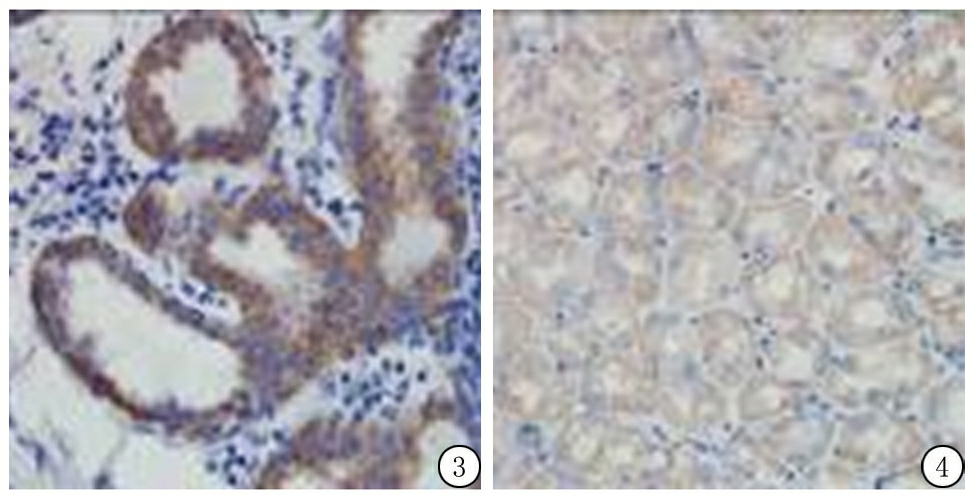
图3 胃腺癌组织Kiss-1R蛋白阳性表达(SP ×400)
Figure3Positive expression of Kiss-1R protein in gastric adenocarcinoma(SP×400)
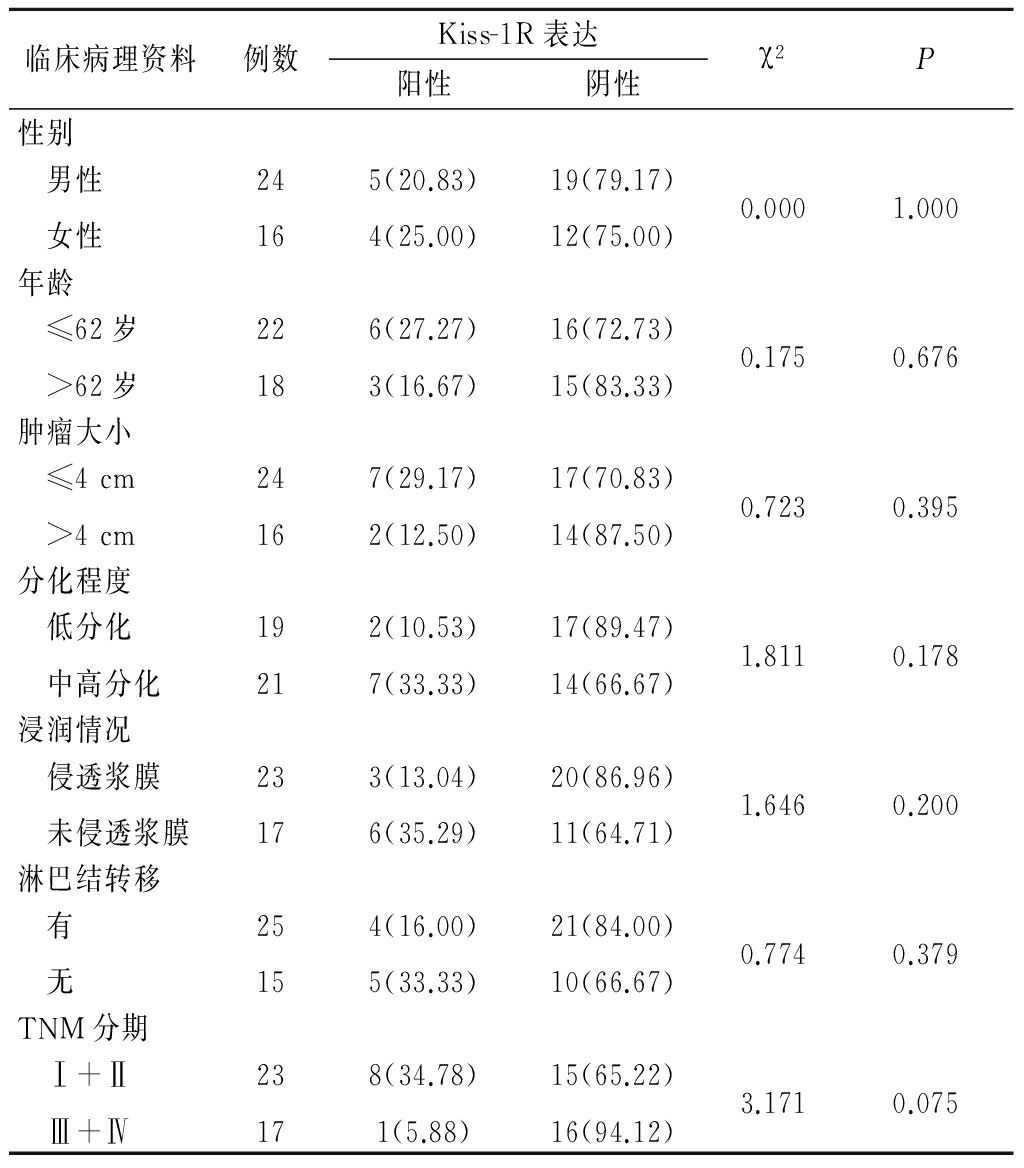
图4胃正常黏膜组织Kiss-1R蛋白阳性表达(SP×400)
Figure4Positive expression of Kiss-1R protein in gastric normal mucosa(SP×400)
表2 Kiss-1R蛋白在不同临床特征胃腺癌组织中
表达比较Table2Comparison of Kiss-1R protein expression indifferent clinical features of gastric adenocarcinoma(例数,%)
2.3Kiss-1与Kiss-1R蛋白的相关性 在40例胃腺癌组织中Kiss-1蛋白阳性表达18例,Kiss-1R阳性表达9例,Spearman等级相关分析显示,胃腺癌组中Kiss-1与Kiss-1R蛋白表达呈正相关(rs=0.312,P<0.05)。
3 讨 论
Kiss-1基因最初发现于黑素瘤细胞株中,是一种与肿瘤转移密切相关的基因,将其转染入高转移肿瘤细胞株中,细胞转移能力得到明显抑制。研究表明,Kiss-1基因作为肿瘤转移抑制基因,与黑色素瘤[4]、胰腺癌[5]、结肠癌[6]、膀胱癌[7]等的侵袭转移密切相关。Kiss-1基因抑制肿瘤转移可能的机制有:Kiss-1基因编码的Kiss-1蛋白可与其受体Kiss-1R蛋白特异性结合,产生细胞内第二信使三磷酸肌醇和二甘油酯,通过增加细胞内钙离子浓度抑制肿瘤细胞增生、诱导分化和凋亡[8-9];两者特异性结合可导致细胞外信号调节蛋白激酶磷酸化,使肿瘤细胞产生大量张力纤维丝,出现局部黏附,影响细胞迁移;通过p38丝裂原活化蛋白激酶信号通路抑制肿瘤细胞的机动性、趋化性和侵袭性[10-11]。细胞迁移在癌症的发展过程中具有重要作用,是癌症浸润转移的重要组成部分。过表达Kiss-1能够抑制C8161黑素瘤细胞在大鼠中的转移能力,同样的,过表达Kiss-1的乳腺癌细胞和胃癌细胞的迁移能力与对照组比较明显下降。
本研究收集了胃腺癌组织及对应的癌旁组织,通过免疫组织化学技术分别检测Kiss-1和Kiss-1R蛋白在胃腺癌组织和癌旁胃正常黏膜组织中的表达情况,结果显示Kiss-1蛋白在胃腺癌组织的阳性表达率显著低于癌旁胃正常黏膜组织(P<0.01)。提示Kiss-1蛋白通过表达下调参与胃腺癌的发病过程,Kiss-1基因发挥类抑癌基因作用。周蕾等[12]检测261例胃腺癌和80例癌旁胃正常黏膜组织中Kiss-1蛋白的表达情况,胃腺癌组织Kiss-1蛋白阳性表达率显著低于癌旁胃正常黏膜组织(P<0.05)。李欣等[13]通过免疫组织化学方法检测子宫内膜病变中Kiss-1的表达,结果表明从正常子宫内膜到子宫内膜癌的病变过程中Kiss-1的表达有逐渐降低趋势(P<0.05)。本研究结果显示,不同肿瘤分化程度、淋巴结转移、TNM分期胃腺癌组织的Kiss-1蛋白表达率差异有统计学意义(P<0.05),其阳性表达率在低分化组、有淋巴结转移组、TNM分期的Ⅲ+Ⅳ期组中显著降低。提示Kiss-1表达下调可能与胃腺癌恶性程度、侵袭与转移有关,对临床制定个体化治疗及判断预后有参考价值。冯斌[14]检测50例胃癌组织中Kiss-1基因表达情况,结果显示Kiss-1基因在低分化、有淋巴结转移、远处脏器转移的胃癌中表达显著降低(P<0.05)。Kim等[15]研究发现,下调Kiss-1表达后,会显著增加胃癌细胞株MGC-803细胞的侵袭和迁移能力。说明Kiss-1对胃癌细胞株侵袭和转移有抑制作用。周蕾等[12]研究发现,Kiss-1阳性胃癌患者的生存时间明显长于阴性患者。以上研究结果进一步印证了Kiss-1基因作为肿瘤转移抑制基因与胃腺癌的恶性程度、侵袭与转移有关,检测Kiss-1蛋白表达情况对指导临床选择治疗方案、判断患者预后有一定的价值。
本研究结果表明,Kiss-1R蛋白在胃腺癌组织的阳性表达率显著低于胃正常黏膜组织(P<0.01)。提示Kiss-1R蛋白在胃腺癌的发病过程发挥类抑癌作用。Wang等[16]研究表明,Kiss-1R蛋白在前列腺癌中表达显著低于正常前列腺组织(P<0.05)。提示其可能在不同部位肿瘤中发挥相近的类抑癌作用。本研究结果显示,不同临床特征胃腺癌组织的Kiss-1R蛋白阳性表达率差异无统计学意义(P>0.05)。Kang等[17]发现,Kiss-1R阳性子宫内膜癌患者的整体生存率高于Kiss-1R阴性患者(P<0.05),并与FIGO分期、组织类型、肌层浸润深度、淋巴结转移相关(P<0.05)。Zhu等[18]分析了50例结直肠癌肝转移组织中Kiss-1R与整体生存率有相关性,Kiss-1R高表达的患者5年生存率明显高于低表达者。Sun等[19]发现,Kiss-1R在非小细胞肺癌中mRNA和蛋白水平均比正常组织低,并且与患者预后密切相关(P<0.05)。本研究结论与其相左,考虑可能原因是:①本研究样本量小,应加大样本量进一步印证;②同一信号通路可能在不同恶性肿瘤中的作用机制不同。本研究显示Kiss-1与Kiss-1R蛋白在胃腺癌组中表达呈正相关(P<0.05),表明两者在胃腺癌发病中协同发挥作用。
综上所述,Kiss-1在胃腺癌组织中表达缺失。过表达Kiss-1能够抑制胃腺癌细胞的增殖和迁移能力,抑制Kiss-1能够促进胃腺癌细胞的增殖和迁移能力,Kiss-1在胃腺癌发病过程中发挥类抑癌作用,可通过与Kiss-1R特异性结合抑制胃腺癌的侵袭和转移,有潜力成为判断胃腺癌转移和预后的生物学指标。Kiss-1/Kiss-1R通路有潜力成为胃腺癌治疗的有效干预靶点。通过探讨Kiss-1表达水平对胃腺癌细胞增殖迁移的影响机制,可为进一步研究胃腺癌的发病机制奠定基础,并为治疗胃腺癌提供新思路。
[参考文献]
[1] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[2] Ji K,Ye L,Mason MD,et al. The Kiss-1/Kiss-1R complex as a negative regulator of cell motility and cancer metastasis(Review)[J]. Int J Mol Med,2013,32(4):747-754.
[3] Ji K,Ye L,Ruge F,et al. Implication of metastasis suppressor gene,Kiss-1 and its receptor Kiss-1R in colorectal cancer[J]. BMC Cancer,2014,14:723.
[4] Radhakrishnan P,Ruh N,Harnoss JM,et al.Prolyl hydroxylase 3 attenuates MCL-1-mediated ATP production to suppress the metastatic potential of colorectal cancer cells[J]. Cancer Res,2016,76(8):2219-2230.
[5] Wang CH,Qiao C,Wang RC,et al. KiSS-1-mediated suppression of the invasive ability of human pancreatic carcinoma cells is not dependent on the level of KiSS-1 receptor GPR54[J]. Mol Med Rep,2016,13(1):123-129.
[6] Kostakis ID,Agrogiannis G,Vaiopoulos AG,et al. A clinicopathological analysis of KISS1 and KISS1R expression in colorectal cancer[J]. APMIS,2015,123(7):629-637.
[7] Zhang Y,Huang Z,Zhu Z,et al. Upregulated UHRF1 promotes bladder cancer cell invasion by epigenetic silencing of KiSS1[J]. PLoS One,2014,9(10):e104252.
[8] Okada K,Naito AT,Higo T,et al. Wnt /β-catenin signaling contributes to skeletal myopathy in heart failure via direct interaction with forkhead Box O[J]. Circ Heart Fail,2015,8(4):799-808.
[9] Radwa ska P, Kosior-Korzecka U.Relationships between leptin KiSS-1/GPR54 expression and TSH secretion from pituitary cells of pubertal ewes in vitro[J]. Res Vet Sci,2016,105:180-187.
ska P, Kosior-Korzecka U.Relationships between leptin KiSS-1/GPR54 expression and TSH secretion from pituitary cells of pubertal ewes in vitro[J]. Res Vet Sci,2016,105:180-187.
[10] Taylor J,Pampillo M,Bhattacharya M,et al. Kisspeptin/KISS1R signaling potentiates extravillous trophoblast adhesion to type-I collagen in a PKC- and ERK1/2-dependent manner[J]. Mol Reprod Dev,2014,81(1):42-54.
[11] Xie MS,Zheng YZ,Huang LB,et al. Infliximab relieves blood retinal barrier breakdown through the p38 MAPK pathway in a diabetic rat model[J]. Int J Ophthalmol,2017,10(12):1824-1829.
[12] 周蕾,胡永莲,武世伍,等.Slug、ZEB1和KISS-1在胃腺癌中的表达及其临床意义[J].南方医科大学学报,2016,36(4):532-537.
[13] 李欣,张志刚,孙金豹,等.KiSS-1在子宫内膜病变中的表达及意义[J].河北医科大学学报,2011,32(8):893-895.
[14] 冯斌.KISS-1基因在胃癌组织中的表达与胃癌复发转移的关系[J].现代肿瘤医学,2013,21(10):2289-2291.
[15] Kim TH,Cho SG. Kisspeptin inhibits cancer growth and metastasis via activation of EIF2AK2[J]. Mol Med Rep,2017,16(5):7585-7590.
[16] Wang H,Jones J,Turner T,et al. Clinical and biological significance of KISS1 expression in prostate cancer[J]. Am J Pathol,2012,180(3):1170-1178.
[17] Kang HS,Baba T,Mandai M,et al. GPR54 is a target for suppression of metastasis in endometrial cancer[J]. Mol Cancer Ther,2011,10(4):580-590.
[18] Zhu C,Takasu C,Morine Y,et al. KISS1 Associates with Better Outcome via Inhibiting Matrix Metalloproteinase-9 in Colorectal Liver Metastasis[J]. Ann Surg Oncol,2015,22(Suppl 3):1516-1523.
[19] Sun YB,Xu S. Expression of KISS1 and KISS1R(GPR54) may be used as favorable prognostic markers for patients with non-small cell lung cancer[J]. Int J Oncol,2013,43(2):521-530.