肾脏肿瘤是人类泌尿系统生殖系统常见的肿瘤之一,因单一检查方法的局限性,肾脏的良性病变易误诊为恶性肿瘤,导致不必要的手术治疗。故术前提高肾脏肿瘤诊断的准确性极为重要。超声造影(contrast-enhanced ultrasonography,CEUS)凭借其无放射性损伤、无肝肾毒性、操作相对简单、可重复性强等优点越来越受到人们的重视。本研究旨在探讨CEUS、强化电子计算机断层扫描(contrast-enhanced computed-tomography,CECT)及两者联合诊断肾脏肿瘤的临床应用价值。
1 资 料 与 方 法
1.1一般资料 选取2015年3月—2017年1月于河北医科大学第二医院泌尿外科手术治疗的肾肿瘤患者101例,其中男性72例,女性29例;年龄31~77岁,平均(55.00±13.46)岁;病灶位于左侧51例,右侧49例,双侧1例;肾上极22例,中极44例,下极35例;临床表现为间断血尿13 例,间断腰部不适的40例,间断血尿伴腰痛5例,无任何症状于体检时偶然发现43例;肿瘤直径0.9~15 cm,平均(4.6±3.41) cm。患者术前未进行任何抗肿瘤治疗,均行CECT及CEUS检查,有完整病历资料及术后病理结果。
1.2方法
1.2.1CEUS检查 应用GE LOIGQE9和Philips iU22彩色多普勒超声诊断仪,配备CEUS定量分析软件,采用凸阵探头,频率1~5 MHz,机械指数0.06~0.12。造影剂为注射用六氟化硫微泡。询问患者是否存在既往蛋白质类过敏史,检查前禁食水4~6 h。5 mL注射器抽取0.9%氯化钠注射液5 mL,注入注射用六氟化硫微泡造影剂粉末中,充分振荡,摇均匀,备用。行常规超声检查,以明确患者肾占位的部位、大小、形态、边界及彩色多普勒血流信号。选取较为适宜观察切面,转换为低机械指数CEUS模式,取0.9 mL造影剂,以团注方式经肘正中静脉留置针迅速注入,随即迅速注入5 mL氯化钠注射液,嘱患者屏气或缓慢呼吸,动态观察3 min,记录影像并保存。
1.2.2CECT检查 应用GE 64排CT 检查机。常规碘过敏试验,检查前8 h禁食,30 min口服2.5%泛影葡胺1 000 mL。先行肾脏CT平扫(层厚5 mm、螺距1.375),并行冠状面、矢状面等多面的图像构建,观察病灶和周围组织的一般关系。高压注射器经肘正中静脉注入30%碘海醇50 mL,速度2.5~3.0 mL/s,注射对比剂后30 s行肾脏皮质期增强扫描,60 s行肾脏实质期扫描,3 min行肾盂期扫描。扫描时患者在平静呼吸状态下屏气,观察增强扫面各期,肿瘤病灶与周围组织的强化方式,记录影像并保存。
1.3图像分析及良恶性判断标准
1.3.1CEUS 回放记录的影像资料,将整个造影过程分为皮质期(10~35 s)、实质期(36~120 s)、延迟期(121~360 s)[1]。依据病灶与肾皮质的增强与廓清时间对比分为快进、慢进、快退、慢退。依据病灶与周围肾皮质的强化程度分为高强化、等强化、低强化[2]。分析造影剂注入前后病灶的强化及消退方式,是否存在“假包膜”即环状高增强征象。将造影方式为快进快退、快进慢退或存在“假包膜”征象者归为恶性病变。将造影方式为等增强、慢进慢退或无强化归为良性病变。为避免检查医生主观误差,分析均由2名医院腹部超声科副主任医师完成。
1.3.2CECT检查 观察肿瘤病灶在皮质期、实质期、消退期与肾皮质强化方式的不同判别良恶性。将强化方式为“快进快出”、“缓慢增高”或出现异常强化团块归为恶性。结果由2名医院影像科副主任医师及以上职称者判定。
1.3.3病理学良恶性判断标准 所有手术切除病变肾脏组织均行甲醛固定、石蜡切片并存档,所有切片均由2名医院副主任医师及以上职称者依据WHO 2014《泌尿和男性生殖系统肿瘤分类》作出病理学诊断。
1.4统计学方法 应用 SPSS 21.0统计学软件分析数据。以病理诊断结果为金标准,采用四格表的诊断性试验分析计算CEUS、CECT、2种联合检查诊断肾脏肿瘤的敏感度、特异度和准确度;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1病理结果 101例患者中,术后病理为恶性肿瘤73例,其中透明性肾细胞癌54例、嫌色性肾细胞癌5例、肾盂癌5例、多房囊性肾细胞癌3例、乳头状肾细胞癌3例、未分化癌2例、颗粒细胞癌1例。术后病理为良性病变28例,其中肾囊肿10例、肾血管平滑肌脂肪瘤8例、炎症病灶4例、嗜酸性细胞瘤3例、良性间叶来源肿瘤1例、肾海绵状血管瘤1例、血管畸形1例。见表1,2。
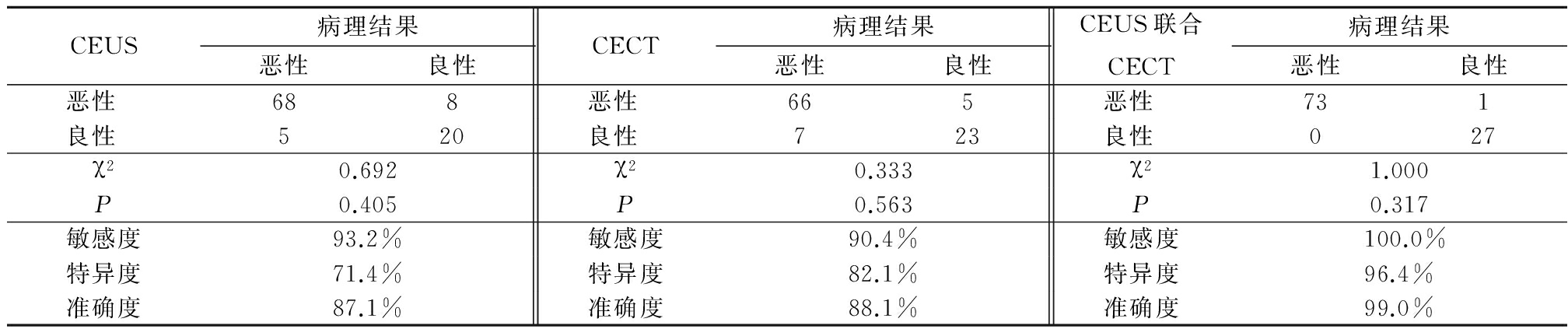
2.2CEUS和CECT诊断结果 CEUS诊断恶性肿瘤76例(75.2%),CECT诊断恶性肿瘤71例(70.3%),CEUS联合CECT诊断恶性肿瘤74例(73.4%)。CEUS、CECT、CEUS联合CECT诊断与病理诊断恶性肿瘤的阳性率差异均无统计学意义(P>0.05)。以病理结果为金标准,对CEUS、CECT、CEUS联合CECT进行评价,CEUS联合CECT诊断肾肿瘤的敏感度、特异度、准确度较高。见表3。
表1 肾恶性占位性病变术后病理与CEUS及CECT检查结果
Table1The results of CECT,CEUS and thepathology of the malignant renal lesions(例数)
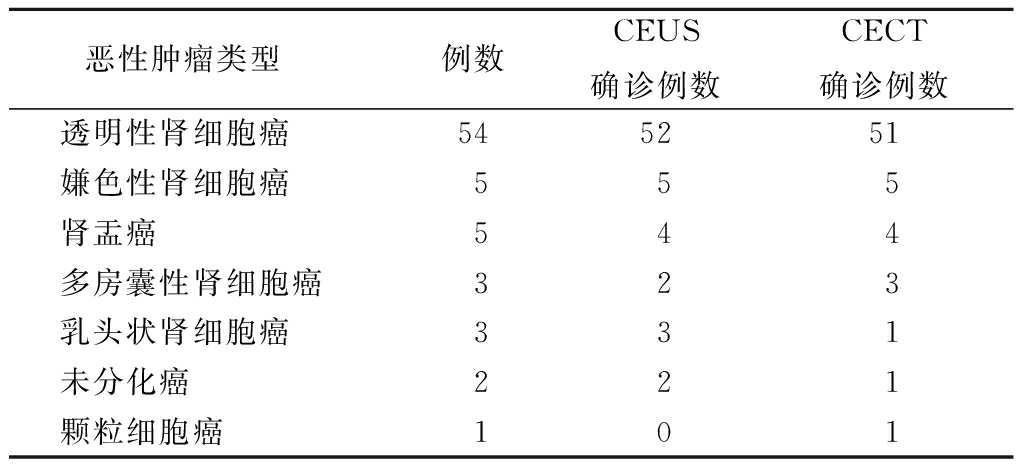
表2 肾良性占位性病变术后病理与CEUS及CECT检查结果
Table2The results of CECT,CEUS andthe pathology of the benign renal lesions(例数)
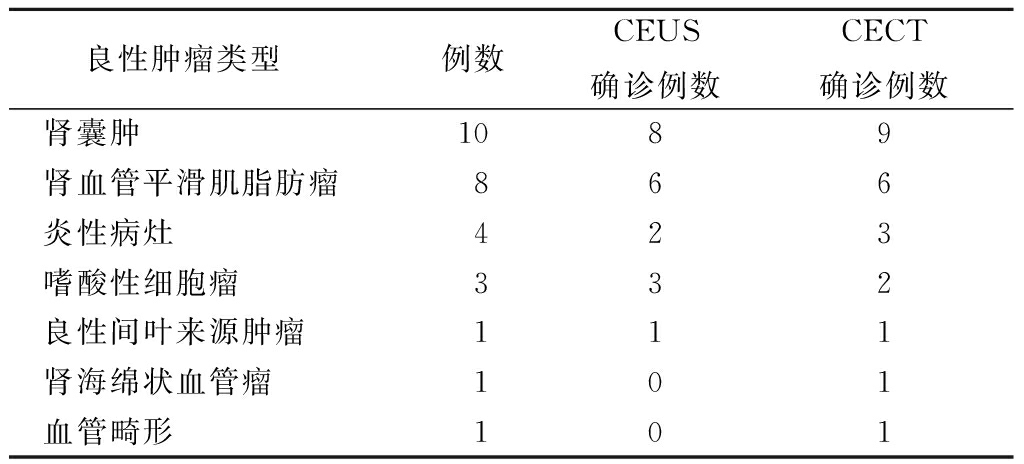
表3 CEUS和CECT诊断结果与病理结果比较
Table3Comparison of CEUS and CECT diagnosis and pathological results(例数)
3 讨 论
CECT是目前临床工作中诊断、鉴别肾脏肿瘤及其性质的主要手段,但对于直径<3 cm,其内伴出血、坏死、囊性改变,周边有“假包膜”征象或血供比较少等特殊类型的肾肿瘤则难以判断其性质[1]。CEUS主要是以肿瘤病灶内新生毛细血管为基础,造影剂注入血液循环,通过形成大量的气-液界面而产生较为强烈的散射回声信号,使造影剂滞留病灶的回声信号极大的增强, 提高了超声回声信号的信噪比[2]。这种气-液界面产生的散射回声信号有效地增加了肾脏的血流强化信号。通过观察正常组织与病变部位血流灌注特征及强化方式、强化程度的不同,提高了肿瘤病灶内出血、坏死、囊性改变以及“假包膜”征象的检出率,通过这种对比,可以对病灶良恶性进行更进一步的判断,在一定程度上可以弥补CECT的不足,提高了肾脏肿瘤病变诊断的准确率。同时与CECT相比,CEUS的造影剂气体部分经肺排出,脂质部分由肝脏消除。无肾毒性,对肾功能受损的患者同样适用[3],而CECT或MRI的造影剂均会加重肾脏的负担,故对于肾功能较差或对射线过敏患者,CEUS检查具有较为明显的优势,这个特性对于临床工作具有较大的意义,不但可使无法行CECT检查的患者得到进一步的诊断,也可减少造影剂肾损伤的发生,减轻医疗风险。
肾良性肿瘤新生血管较少、血供差,CECT及CEUS检查常常表现为低或等强化,且与正常组织强化时相同步。如肾囊肿,造影模式呈无强化征象,血管平滑肌脂肪瘤常常表现慢进慢退、低增强。但若良性病变合并出血、感染,伴随炎症刺激,生成不同数量的毛细血管,则可能表现为“快进快退、高增强”等不同程度的强化表现而易误诊为恶性[1,4]。另外,由于血管平滑肌脂肪瘤组织内血管成分和脂肪的构成比不同,造影过程中也呈现出不同的强化方式。如血管成分丰富、脂肪成分含量较少,CEUS可能由于强化方式及程度的不同而误诊为恶性,而CECT在显示肿瘤病灶内脂肪成分方面更具优势,两者结合会提高血管平滑肌诊断正确率。肾恶性肿瘤大致分为富血供及乏血供两类,富血供恶性肿瘤如肾透明细胞癌新生血管多、血供极为丰富并往往因为合并动-静脉瘘等情况,故影像检查模式为“快进快退、高增强” 征象。部分患者因肿瘤和周围肾实质受压后,其内毛细血管数量变多,从而使造影剂达到较快且停留时间较长,出现“快进慢退、高增强”现象。肾脏乳头状和嫌色肾细胞癌因肿瘤血供不丰富,病灶较周围正常肾实质增强时间相对较慢, 消退较慢, 肿瘤病灶内造影剂灌注相对正常肾实质少, 造影时间与强度曲线中造影剂到达时间及达到高峰时间均较晚, 峰值密度较低,造影模式主要表现为“慢进慢退、低增强”。富血供肿瘤也可能因肿瘤体积较大,压迫周围血管,影响周围血供,表现为乏血供特征,与乏血供肿瘤的造影模式类似[5]。“假包膜”征象即肿瘤周边所形成的环状高增强征象,形成的主要原因为肾脏肿瘤向外生长过程中, 挤压周围正常组织, 使肿瘤病灶周边的正常肾实质缺血坏死发生纤维化, 进一步形成由纤维结缔组织和受压的肾实质组成的“假包膜”。“假包膜”征象表明,该肿瘤病灶为恶性肿瘤的可能性极大。研究表明,CEUS检查比普通超声发现肾脏肿瘤“假包膜”的概率明显增高,即使是与CECT 比较,在显示肾脏肿瘤病灶“假包膜”征象方面,CEUS检查也具有明显的优势[6-7]。
本研究结果显示,良性病变28例,肾囊肿9例患者CEUS与CECT均无强化,1例因表现为“快进快退、高增强”征象,CEUS及CECT均误诊为恶性肿瘤,误诊原因主要由于肾囊肿并发出血发生炎症,刺激周围毛细血管生成较多所致。血管平滑肌脂肪瘤8例,其中2例因CEUS表现为“快进快退、高增强”征象而误诊为恶性肿瘤,CECT也因强化模式为“快进快退”误诊为恶性肿瘤,误诊原因与2例患者血管成分所占比率较大有关。73例恶性肿瘤中,透明细胞癌占53例,其中46例表现为“快进快退、高增强”征象,33例出现了“假包膜”,这与透明细胞癌的病理生理特征相符,CEUS诊断出52例,CECT诊断出51例。这可能与CEUS可以清楚显示并观察整个病灶灌注过程及“假包膜”等情况判断肿瘤的良恶性有关。恶性肿瘤生长迅速,肿瘤中心缺血坏死液化,在CEUS检查时可以出现了灌注缺损[8-9]。CEUS在诊断乏血供肾肿瘤方面优于CECT[10-11]。乳头状肾细胞患者3例中2例CECT显示病灶无明强化,误诊为高密度囊肿,而CEUS全部诊断为恶性肿瘤。误诊的原因可能与肿瘤分化程度相对较高、瘤体较小、肿瘤血供与周围肾实质血供差距较小有关,这说明CEUS在肿瘤病灶微细血管的显示方面更具优势[12]。同样,对肾囊性病变微血管的显示CEUS较CT更有优势,可能清晰观察囊内分隔微血供情况,从而提高肾囊性占位诊断的准确性[13-14]。
总之,CEUS可以实时观察肾肿瘤组织内血液供应及血液灌注特征、强化程度、强化方式的整个过程,并通过加强肾脏肿瘤“假包膜”的显示概率,在一定程度上弥补CECT 的不足[15]。同时,CEUS具有无创性、无放射性、无肾毒性、可重复性等优点,与CECT互补可提高肾脏肿瘤诊断准确度。但CEUS结果与检查医师的经验水平有关,容易受检查医师主观性、检查仪器性能、病灶位置(如受肋骨阻挡)、检查者是否配合等因素影响[16],故需要不断积累临床经验,改进仪器设备,加强对患者的宣教,才能为临床诊疗提供更准确的信息。
[参考文献]
[1] 陈寒冰,沈钧康,王澂,等.超声造影和增强CT在肾癌和肾血管平滑肌脂肪瘤诊断鉴别中的临床价值[J].中国老年学杂志,2017,37(12):2965-2968.
[2] Chung YE, Kim KW.Contrast-enhanced ultrasonography: advance and current status in abdominal imaging[J].Ultrasonography,2015,34(1):3-18.
[3] 李华,高月花,贾化平,等.急性肾损伤肾脏超声造影的初步临床研究[J].中国超声医学杂志,2017,33(6):533-536.
[4] 王东彬,田晖,杨书文,等.超声造影在乏血供小体积肾肿瘤中的诊断价值[J].临床误诊误治,2016,29(3):42-44.
[5] 李淑兰,张学兰,周祖邦,等.肾透明细胞癌常规超声和超声造影特征及其与病理分化程度的相关性[J].中国超声医学杂志,2014,30(6):534-537.
[6] Smajerova M,Petrasova H,Little J,et al. Contrast-enhanced ultrasonography in the evaluation of incidental focal liver lesions:a cost-effectiveness analysis[J]. World J Gastroenterol,2016,22(38):8605-8614.
[7] Amioka A, Masumoto N,Gouda N,et al. Ability of contrast-enhanced ultrasonography to determine clinical responses of breast cancer to neoadjuvant chemotherapy [J]. Jpn J Clin Oncol,2016,46(4):303-309.
[8] 刘春蕊,黄鹏飞,谢迎东,等.超声造影定性分析鉴别诊断甲状腺良恶性结节的价值[J/CD].中华医学超声杂志:电子版,2017,14(3):220-225.
[9] Yi D,Feng M,Wen Ping W,et al. Contrast-enhanced US-guided percutaneous biopsy of anterior mediastinal lesions[J]. Diagn Interv Radiol,2017,23(1):43-48.
[10] Lee MW. Fusion imaging of real-time ultrasonography with CT or MRI for hepatic intervention [J]. Ultrasonography,2014,33(4):227-239.
[11] 马慧,王瑞霞,郑敏娟,等.胃窗超声造影对胃肿瘤的诊断价值及分型[J].河北医科大学学报,2015,36(10):1209-1211.
[12] 莫承强,蒋双键,李柏谋,等.超声引导下射频消融治疗小肾癌32例疗效分析[J].现代泌尿外科杂志,2017,22(10):743-747.
[13] 陈超男,梁萍,于晓玲,等.超声造影引导经皮微波消融治疗肾癌的临床应用[J/CD].中华医学超声杂志:电子版,2015,12(4):325-329.
[14] 王小花,林益怡,吕夕明,等.超声造影用于诊断肝脓肿的影像学表现及临床价值研究[J].中华医院感染学杂志,2017,27(2):337-340.
[15] 唐金华,李凡,蔡应娱,等.罕少见肾脏恶性肿瘤的超声造影表现[J].南京医科大学学报:自然科学版,2017,37(2):242-246.
[16] 韩泽朝,张宇,田雅翠,等.TRUS及超声造影联合MRI引导前列腺靶向穿刺的临床研究[J].河北医科大学学报,2017,38(8):929-932,944,992.